
Лекции химия_1 / ЭлементыVГруппыP,As,Sb
.pdf
Оксид P4O6 – белый рыхлый летучий порошок, с температурой плав-
ления 22,5оС. Легко реагирует с кислородом, в интервале температур 20 – 50оС окисление P2O6 сопровождается интенсивной хемилюминисценцией. Образуется при сжигании фосфора при недостатке кислорода.
Структура молекулы P4O6 близка к структуре P4O10, но построена не из тетраэдров, а из пирамид (PO3) и в ней у Р нет концевых кислородных атомов. Простейшая стехиометрическая формула – P2O3. Оксид растворяется в холод-
ной воде с образованием фосфористой кислоты.
Фосфористая кислота H2(HPO3) или H3PO3 – двухосновна, ей со-
ответствуют соли – фосфиты с анионом HPO32– и гидрофосфиты H2PO3–. В молекуле фосфористой кислоты один атом водорода непосредственно связан с фосфором:
O
P
H OH
HO
Фосфористая кислота и ее соли являются хорошими восстановите-
лями. Окисление фосфита выражается полуреакцией:
HPO32– + H2O – 2 e– PO43– + 3H+.
Известны многочисленные органические производные фосфористой кислоты, в частности, эфиры P(OR)3.
Соединения фосфора с водородом и галогенами
Фосфин. Это ядовитый газ с чесночным запахом. Молекула фосфина подобна молекуле аммиака. Но из-за большего размера атома фосфора связь Р–
–Н менее прочна, нежели N––H. Поэтому устойчивость фосфина и его способность к присоединению Н+ мала.
Фосфин является сильным восстановителем и легко возгорается на воздухе.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

В отличие от азота фосфор непосредственно с водородом не реагирует. Фосфин может быть получен лишь косвенными методами. Например, его можно получить при диспропорционировании белого фосфора в щелочной среде при нагревании.
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2.
Значительно более устойчивы соединения, в которых к фосфору наряду с атомами водорода присоединен также и кислород. Примерами таких соединений являются кислоты: фосфористая – H3PO3 и фосфорноватистая – H3PO2.
Фосфорноватистая кислота
В молекуле фосфорноватистой кислоты H(H2PO2) или H3PO2 два атома водорода непосредственно связаны с фосфором:
O
P
H H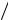 OH
OH
По кислотному типу диссоциирует лишь водород из связи О–Н, вследст-
вие чего кислота H3PO2 является одноосновной.
Соли фосфорноватистой кислоты называются гипофосфитами. Фосфорноватистая кислота и гипофосфиты являются сильными
восстановителями. Окисление гипофосфита выражается полуреакцией: H2PO2– + H2O – 2e– HPO32– + 3H+
Восстановительные свойства гипофосфитов используют в промышленности для получения металлопокрытий, чаще всего никелевых, из водных растворов
H2PO2– + Ni2+ + H2O => HPO32– + Ni + 3H+
Галогениды фосфора
Фосфор непосредственно соединяется со всеми галогенами, причем реакции сопровождаются выделением большого количества тепла.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Наибольшее практическое значение имеют хлориды фосфора: PCl3 и
PCl5. Их используют в качестве хлорирующих агентов в реакциях органического синтеза. Хлорид PCl3 получают, пропуская хлор над расплавленным белым фосфором. Хлорид PCl5 получают при пропускании хлора через PCl3.
Трихлорид PCl3 – это бесцветная летучая легко кипящая жидкость, а PCl5 – в обычных условиях белое твердое вещество. Указанные хлориды являются типичными кислотообразующими соединениями, при растворении в воде гало-
гениды подвергаются полному гидролизу:
PCl3 + 3H2O = H3PO3 + 3HCl,
PCl5 + 4H2O = H3PO4 + 5HCl.
По аналогичным схемам взаимодействуют с водой и все другие галогениды фосфора.
Оксотрихлорид фосфора POCl3 (часто называемый хлорокисью фосфора) – бесцветная сильно дымящая жидкость, которая является растворителем для многих органических и неорганических хлорпроизводных. Получается при взаимодействии P4O10 с PCl5.
Мышьяк, сурьма, висмут
33 As
мышьяк
74,922
51 Sb
сурьма
121,75
83 Bi
висмут
208,98
Атомы As, Sb, Bi имеют такой же набор валентных электронов, как Nи Р, но они отличаются от азота и фосфора строением предпоследнего слоя, который содержит 18 электронов. Между собой As, Sb, Bi являются полными электронными анало-
гами. Часто эти три элемента объединяют общим названием – подгруппа мышьяка. Эти элементы проявляют сходство между собой и существенные отличия от свойств фосфора.
У этих элементов в образовании химических связей могут участвовать d-орбитали последнего слоя, и координационное число увеличивается до 6.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Возрастающее влияние заряда ядра на валентные s–электроны приводит к
уменьшению устойчивости высшей степени окисления (+5) и увеличению устойчивости степени окисления +3.
Увеличение размера атома приводит к все большему различию в проч-
ности σ- и π-связей и усиливает тенденцию к образованию полимерных структур.
Простые вещества мышьяка, сурьмы, висмута, также как и фосфора, являются твердыми и существуют в нескольких полиморфных модификациях. Но устойчивость модификации состоящей из молекул типа Э4 (желтые мышьяк и сурьма) падает. Более устойчивыми являются полимерные модификации, по внешнему виду напоминающие металл, но существенно отличающиеся от типичных металлов своей структурой, хрупкостью и низкой тепло- и электропроводностью. В то время как для типичных металлов характерны плотные упаковки атомов, где каждый атом окружен двенадцатью равноудаленными атомами, мышьяк, сурьма и висмут имеют слоистые кристаллические ре-
шетки. В пределах слоя каждый атом имеет лишь трех ближайших соседей и три более удаленных атома в другом слое. В ряду As, Sb, Bi происходит усиление металлических свойств. Висмут, подобно типичным металлам, обладает электронной проводимостью, которая уменьшается с повышением температуры.
В природе As, Sb, Bi чаще всего находятся в соединениях с серой.
К числу наиболее важных промышленных минералов обычно относят: FeAsS – арсенопирит,
As2S3 – ауринигменит, Sb2S3 – сурьмяный блеск, Bi2S3 – висмутовый блеск
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Простые вещества
Серый мышьяк – темно-серое кристаллическое вещество с металлическим блеском, возгоняется, не плавясь, при температуре 633оС, плотность 5,75 г/см3, очень хрупкое.
Серая сурьма – блестящее кристаллическое вещество плавится при температуре 630,5оС, плотность 6,7 г/см3.
Висмут – серый металл с красноватым блеском, с плотностью 9,8
г/см3 и температурой плавления 271,3оС. Низкая температура плавления обуславливает большинство применений висмута: на его основе изготавливают очень легкоплавкие сплавы, а чистый Bi используют в качестве теплоносителя в ядерных реакторах.
Чистый мышьяк, сурьма и висмут в компактном состоянии по отношению к кислороду воздуха ведут себя по-разному: висмут и сурьма при обычных условиях в сухой атмосфере не окисляются, мышьяк же быстро тускнеет,
покрываясь пленкой оксида As2O3. При нагревании на воздухе все три эле-
мента сгорают с образованием оксидов типа Э2О3.
Ионами водорода в водных растворах мышьяк, сурьма и висмут не окисляются, поэтому они не растворяются в кислотах типа HCl и H2SO4 (разб.) и в щелочах. В раствор их можно перевести действием сильных окислителей, например, концентрированных кислот H2SO4 и HNO3. По отношению к азотной кислоте эти элементы ведут себя по-разному.
Мышьяк, подобно неметаллам окисляется до ортомышьяковой кислоты: As + 5 HNO3 (конц.) = H3AsO4 + 5 NO2 + H2O
Сурьма окисляется с образованием гидратированнного оксида Sb2O5 . nH2O. Висмут в отличие от мышьяка и сурьмы, подобно металлам, всегда образует катион Bi3+.
Bi + 4HNO3 = Bi(NO3) 3 + NO + 2H2O.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Сгалогенами мышьяк и сурьма реагируют при комнатной температуре, висмут – при нагревании. При нагревании все три элемента реагируют с халькогенами – серой, селеном и теллуром.
Сводородом, азотом, углеродом элементы подгруппы мышьяка не реагируют. С активными металлами 1A и 2A подгрупп они (кроме Bi) образуют солеобразные соединения типа М3Э (например, Na3As, K3Sb) и М3Э2 (например, Мg3Sb2, Ca3As2), переходя при этом в свою низшую степень окисления (–3). Со многими переходными металлами образуются нестехиометрические кристаллические фазы, например Co2As. С Au, Ag, Pb мышьяк образует сплавы.
Получение простых веществ
Для получения свободных мышьяка, сурьмы, висмута природные сульфиды подвергают окислительному обжигу с последующим восстановлением углем:
O2 C
Э2S3 Э2O3 Э
Например:
2Sb2S3 + 9O2 = 6SO2 + 2Sb2O3 Sb2O3 + 3C = 2Sb + 3CO
Вметаллургии мышьяк, сурьму и висмут используют в качестве добавок
кспециальным сплавам. Добавка мышьяка, например, повышает литейные качества свинца. Это используют при изготовлении ружейной дроби. Сурьма повышает твердость сплавов на оловянно-свинцовой основе (типографский сплав
ибаббиты). Висмут используют для изготовления легкоплавких сплавов.
Соединения мышьяка, сурьмы и висмута
Оксиды и гидроксиды Э(+3)
Оксиды Э2О3 образуются при непосредственном окислении мышьяка, сурьмы и висмута на воздухе. Эти оксиды различны по своим кислотно-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

основным свойствам: As2O3 и Sb2O3 – амфотерные оксиды, Bi2O3 – основной оксид.
Кислотный характер оксида As2O3 проявляется уже при его растворении в воде. Образуется слабая мышьяковистая кислота, состав которой твердо не установлен. Условно этот процесс выражают уравнением:
As2O3 + 3H2O = 2H3AsO3
Оксиды Sb2O3 и Bi2O3 в воде не растворяются. Кислотно-основной ха-
рактер этих оксидов выявляется их отношением к кислотам и щелочам. Так амфотерный оксид Sb2O3 может растворяться и в кислотах, и в щелочах.
Sb2O3 + 3 H2SO4 = Sb2(SO4)3 + 3 H2O,
Sb2O3 + 2 KOH + 3 H2O = 2 K[Sb(OH)4].
Подобным образом реагирует со щелочью и оксид As2O3. Основной оксид Bi2O3 со щелочами не реагирует, но легко реагирует с сильными кислотами,
образуя соли BiCl3, Bi(NO3)3 и Bi2(SO4)3.
Гидроксиды сурьмы и висмута в степени окисления (+3) в воде прак-
тически нерастворимы и получаются в виде белых осадков переменного состава Э2О3 . nH2O действием щелочей на катионные производные Э(+3) или действием кислот на анионные гидроксокомплексы:
Bi(NO3)3 + 3 KOH = Bi(OH)3 (т.) + 3 KNO3,
Na[Sb(OH)4] + HCl = Sb(OH)3 (т.) + NaCl + H2O
Условно эти гидроксиды обозначают формулами Sb(OH)3 и Bi(OH)3.
Так как гидроксиды Sb(OH)3 и Bi(OH)3 являются очень слабыми основаниями
нитраты, сульфаты и хлориды Sb(+3) и Bi(+3) в водных растворах подвергаются глубокому гидролизу с образованием нерастворимых оксосолей,
например:
Bi(NO3)3 + H2O ' BiONO3 (т.) + 2HNO3
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Добавлением избытка сильной кислоты можно подавить гидролиз и получить растворы солей без осадка.
Оксиды и гидроксиды Э(+5)
Оксиды Э2О5 значительно менее устойчивы по сравнению с оксидами Э2О3. Их нельзя получить непосредственным окислением мышьяка, сурьмы и висмута кислородом воздуха. Напротив, при нагревании эти оксиды разлагаются с выделением кислорода:
Э2О5 Э2О3 + О2
В ряду As – Sb – Bi устойчивость оксидов Э2О5 уменьшается. Оксид
Bi2О5 разлагается уже при 100оС.
Все оксиды Э2О5 – это кислотные оксиды, соответствующие им гидроксиды относятся к классу кислот. Оксиду As2О5 соответствует мышьяко-
вая кислота – H3AsO4, которая образуется при окислении мышьяка или оксида As2О3 азотной кислотой или другими сильными окислителями
3As2О3 + 4HNO3 + 7H2O = 6H3AsO4 + 4NO
Мышьяковая кислота H3AsO4 похожа на фосфорную и по силе, и
по растворимости в воде. Из сильно концентрированного раствора она выделяется в виде мелких бесцветных кристаллов. Прокаливая эти кристаллы при 120о С, можно получить оксид As2О5 (мышьяковый ангидрид).
2 H3AsO4 As2О5 + 3H2O.
Растворяясь в воде, As2О5 снова образует мышьяковую кислоту.
Мышьяковая кислота и ее соли в кислой среде являются довольно сильными окислителями, в этом их существенное отличие от фосфатов.
Соответствующую оксиду Sb2О5 сурьмяную кислоту можно получить, действуя концентрированной азотной кислотой на элементарную сурьму. При этом образуется белый осадок гидратированного оксида Sb2О5. nH2O, кото-
рый и называют сурьмяной кислотой. При обезвоживании этого вещества по-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

лучают оксид Sb2О5. Сурьмяная кислота и оксид Sb2О5 в воде нерастворимы и проявляют свои кислотные свойства, растворяясь при нагревании в щелочи.
Sb2О5 + 5H2O + 2KOH = 2K[Sb(OH)6]
В кислой среде Sb2О5 является сильным окислителем, например
Sb2О5 +10HCl = 2SbCl3 + 2Cl2 +5H2O.
Оксид Bi2О5 (красно-коричневого цвета) можно получить взаимодей-
ствием Bi2О3 с очень сильным окислителем озоном О3: 3 Bi2О3 +2О3 = 3 Bi2О5
Bi2О5 – это очень нестойкое соединение. Получение производных Bi(+5) в водных растворах возможно только в щелочной среде, которая стабилизирует высокие степени окисления. Так при обработке окислителями взвеси Bi(OH)3 в концентрированной щелочи образуются висмутаты, соли висмутовой кислоты HBiO3, например
Bi(OH)3 + Cl2 +3 NaOH = NaBiO3 + 2 NaCl + 3 H2O.
Соединения Bi (+5) – очень сильные окислители. В кислой среде Bi2О5
и соответствующие ему соли (висмутаты) по своей окислительной способности превосходят даже такой сильный окислитель, как перманганат. Об этом свидетельствуют реакции окисления соединений марганца в кислой среде, например
4MnSO4 + 10KBiО3 + 14H2SO4 = 4KMnO4 + 5Bi2(SO4)3 + 3K2SO4 + 14H2O
Соеденения с галогенами
Все элементы подгруппы мышьяка легко вступают в прямое взаимо-
действие с галогенами. Самый активный из галогенов, фтор, со всеми элементами этой подгруппы образует фториды состава ЭF3 (трифториды) и ЭF5 (пентафториды). Кроме фторидов, есть только один устойчивый пентагалогенид – SbCl5, остальные устойчивые галогениды имеют состав ЭГ3. Чаще всего на
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

практике используются соединения с хлором. В последнее время хлор приме-
няют для отделения мышьяка, сурьмы и висмута от металлов, с которыми они тесно связаны как в сульфидных рудах, так и в первичных продуктах восстановления. С этой целью сплав (полупродукт) при высокой температуре подвергают хлорированию, в ходе которого летучие хлориды мышьяка, сурьмы и висмута отгоняют и после разделения их восстанавливают до свободного состояния.
Устойчивые трихлориды AsCl3, SbCl3, BiCl3 – имеют сравнительно невысокие температуры кипения: 131, 223 и 447 оС, соответственно. Это бесцветные легкоплавкие вещества с молекулярной структурой. Растворяясь в воде, все они подвергаются глубокому гидролизу:
AsCl3 + 4 H2O ' H[As(OH)4] + 3HCl,
SbCl3 + H2O ' SbOCl (т.) + 2HCl,
BiCl3 + H2O ' BiOCl (т.) + 2HCl.
Характерным типом реакций для галогенидов мышьяка, сурьмы и висмута является комплексообразование. Все эти соединения обладают высокой способностью к присоединению галогенидных ионов. Поэтому они хорошо растворяются при избытке этих ионов в растворе, например:
SbCl3 + HCl(конц) = H[SbCl4](р-р),
BiI3(тв) + КI(р-р) = K[BiI4](р-р)
Сульфиды
Все элементы подгруппы мышьяка проявляют высокое сродство к сере. Сульфиды мышьяка, сурьмы, висмута – очень плохо растворяются в воде. Поэтому в природе элементы подгруппы мышьяка находятся глав-
ным образом в виде сульфидов. Мышьяк и сурьма образуют сульфиды состава Э2S3 и Э2S5, у висмута устойчив лишь сульфид Bi2S3. В этом проявляется
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
