
- •Общие сведения о растворах
- •Парциальные мольные свойства компонентов раствора
- •Химический потенциал компонента раствора
- •Выбор стандартного состояния для растворителя и растворенного вещества
- •1. В идеальном газовом растворе стандартным будет состояние каждого компонента в виде идеального газа . (4)
- •2. В идеальном совершенном растворе за стандартное состояние любого компонента k раствора принимают его состояние в виде чистого вещества.
- •Функции смешения
- •Расчет некоторых функции смешения при образовании идеального газового раствора
- •Функции смешения при образовании неидеального раствора
- •Расчет некоторых избыточных функций
- •Регулярные и атермальные растворы
2. В идеальном совершенном растворе за стандартное состояние любого компонента k раствора принимают его состояние в виде чистого вещества.
![]() .
(7)
.
(7)
Выражение для химического потенциала компонента k в этом растворе будет иметь следующий вид:
![]() .
(8)
.
(8)
Идеальные совершенные растворы – это растворы, в которых и растворитель и растворенные вещества обладают сходным химическим строением и имеют близкие термодинамические характеристики, например растворы оптических изомеров, или растворы изотопов.
Выражение для химического потенциала компонента реального газового раствора будет таким же как (6). В качестве концентрации для жидких растворов помимо N –шкалы используются с и d шкалы, т.е. активность компонента может быть выражена как
![]() ;
;
![]() ;
;
![]() .
.
Идеальный предельно - разбавленный раствор – это раствор, в котором невозможно достичь больших концентраций одного из компонентов , например, раствор солей. В такой модели идеального раствора стандартные состояния для растворителя и растворенных веществ различны.
Стандартное состояние растворителя как компонента раствора определяется его состоянием в чистом виде. Выберем стандартное состояние растворителя (часто растворитель обозначается как компонент 1) в некотором растворе. Пусть единицей концентрации является мольная доля
 ,
(9)
,
(9)
где
![]()
число молей компонента 1 (растворителя);
число молей компонента 1 (растворителя);
![]()
число
молей всех компонентов раствора.
число
молей всех компонентов раствора.
Активность растворителя из формулы (16) равна:
![]() ,
(10)
,
(10)
где
![]()
активность растворителя;
активность растворителя;
![]()
коэффициент
активности растворителя в шкале мольных
долей.
коэффициент
активности растворителя в шкале мольных
долей.
Стандартное состояние выбирается таким образом, чтобы активность растворителя стала равна мольной доле его, когда мольная доля приближается к единице, или математически
![]() .
(11)
.
(11)
Поскольку
![]() =
=![]() ,
то (11) можно выразить как
,
то (11) можно выразить как
![]() .
.
Выбор
![]() определяет стандартное состояние, при
котором активность равна единице. Для
жидкого раствора стандартное состояние
растворителя определяется как чистая
жидкость. Пример
это разбавленные водные растворы, для
которых
определяет стандартное состояние, при
котором активность равна единице. Для
жидкого раствора стандартное состояние
растворителя определяется как чистая
жидкость. Пример
это разбавленные водные растворы, для
которых
![]() =1. При написании многих уравнений
равновесий в водных растворах традиционно
исключается активность воды, т.к. для
растворителя используется активность
в шкале мольных долей, а в разбавленных
растворах
=1. При написании многих уравнений
равновесий в водных растворах традиционно
исключается активность воды, т.к. для
растворителя используется активность
в шкале мольных долей, а в разбавленных
растворах
![]() и
и
![]() .
.
Итак, для активности растворителя используются следующие выражения:
Очень
разбавленный раствор:
![]() =
1;
=
1;
Разбавленный
или идеальный раствор:
![]() ;
;
Реальный
раствор:
![]() .
.
Уравнение соответствует идеальному раствору: при любой концентрации растворитель имеет те же свойства, что и в разбавленном растворе.
Стандартнее состояние растворенного вещества в этом случае определяется как экстраполированное состояние, когда концентрация равна 1, а свойства те, что экстраполированы из очень разбавленных растворов. Стандартное состояние растворенного вещества это гипотетическое состояние в том смысле, что оно соответствует единичной концентрации идеального раствора (молярной или моляльной).
Активность
растворенного вещества (![]() )
может быть выражена в разных
концентрационных шкалах:
Nшкале
(шкала мольных долей), с
шкале (шкала молярностей), d
или m
шкале (шкала мольно-массовых отношений
или шкала моляльности) .
)
может быть выражена в разных
концентрационных шкалах:
Nшкале
(шкала мольных долей), с
шкале (шкала молярностей), d
или m
шкале (шкала мольно-массовых отношений
или шкала моляльности) .
Рассмотрим случай, когда активность растворенного вещества выражена в шкале молярности, т.е. в сшкале.
![]() ,
,
где
![]()
активность растворенного вещества; в
случае двухкомпонентного раствора эту
величину обозначают
активность растворенного вещества; в
случае двухкомпонентного раствора эту
величину обозначают
![]() ,
т.к. 1-й компонент это растворитель;
,
т.к. 1-й компонент это растворитель;
![]()
коэффициент
активности растворителя в шкале
молярности ;
коэффициент
активности растворителя в шкале
молярности ;
![]()
молярная
концентрация растворенного вещества,
моль/л.
молярная
концентрация растворенного вещества,
моль/л.
Стандартное состояние в шкале молярности выбрано так, что активность равна концентрации, когда концентрация стремится к нулю:
![]() ;
;
![]() .
.
На рис. 1 приведены концентрационные зависимости активности растворенного вещества (сплошная линия) и активности идеального раствора (пунктирная линия), экстраполированного из очень разбавленного раствора.

Из рис. 1 видно, что стандартное состояние в шкале молярности (для растворенного вещества) это точка, лежащая на экстраполированной прямой идеального раствора.
Стандартное состояние растворенного вещества должно соответствовать следующим требованиям:
-
если

 0,
то
0,
то

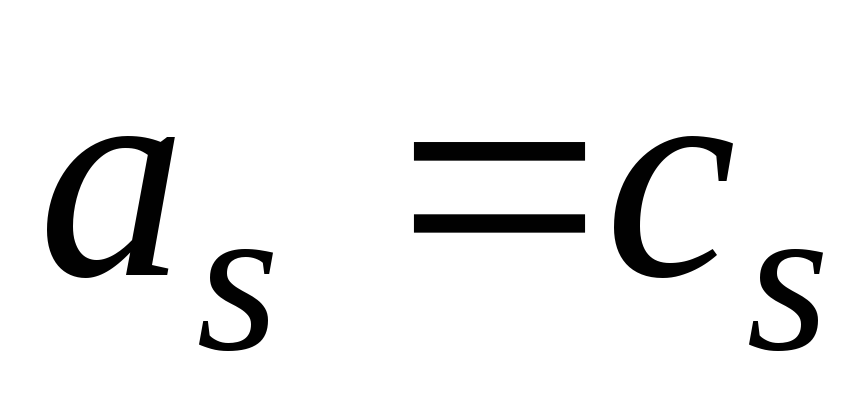 ;
; -
в стандартном состоянии
 .
.
На рис. 2 приведены зависимости химического потенциала растворенного вещества от логарифма молярности для реального раствора (сплошная линия) и для идеального раствора, экстраполированного из очень разбавленного раствора (пунктирная линия).

Для определения стандартного химического потенциала растворенного вещества нужно получить зависимость химического потенциала от натурального логарифма концентрации растворенного вещества и проэкстраполировать эту линию к состоянию, когда концентрация равна единице, т.е. ln сs= 0.
Тогда
мы получим
![]() (рис.2). Таким образом, стандартное
состояние растворенного вещества
это состояние, в котором проявляются
свойства очень разбавленного раствора,
проэкстраполированного к единичной
концентрации. Это гипотетическое
состояние, а не реальный раствор, который
можно приготовить.
(рис.2). Таким образом, стандартное
состояние растворенного вещества
это состояние, в котором проявляются
свойства очень разбавленного раствора,
проэкстраполированного к единичной
концентрации. Это гипотетическое
состояние, а не реальный раствор, который
можно приготовить.
Другой часто используемой единицей концентрации является моляльность ms (или ds - мольно массовые отношения, dшкала) это число молей растворенного вещества на единицу массы растворителя.
Активность вещества в шкале моляльности равна
![]() ,
(25)
,
(25)
где
![]()
активность растворенного вещества;
активность растворенного вещества;
![]()
коэффициент
активности растворителя в шкале
моляльности ; или возможно обозначение
коэффициент
активности растворителя в шкале
моляльности ; или возможно обозначение
![]() ;
;
![]() или
или
![]()
молярная концентрация растворенного
вещества или мольно-массовое отношение
растворенного вещества.
молярная концентрация растворенного
вещества или мольно-массовое отношение
растворенного вещества.
Применение моляльности идентично применению молярности.
Разбавленный
или идеальный раствор:
![]() ;
;
Реальный
раствор:
![]() .
.
Стандартное состояние это экстраполированное состояние; стандартный химический потенциал получается при линейной экстраполяции химического потенциала измеренного в разбавленном растворе, в единичной моляльности. Моляльность используется вместо молярности при самых точных термодинамических измерениях. Поскольку моляльность определяется весом, а не объемом, ее измерения более точно и она не зависит от температуры. Для разбавленных водных растворов 1 л раствора практически содержит 1 кг воды, поэтому численные значения молярности и моляльности очень близки.
Следует отметить, что коэффициенты активности в разных концентрационных шкалах связаны между собой определенными математическими соотношениями и имеют разную величину для одного и того же раствора. Так, например, зависимость между коэффициентами активности какого-либо вещества в N шкале и в mшкале в водных растворах описывается уравнением:
![]() .
.
Очевидно чем больше концентрация раствора, тем больше разница между коэффициентами активности в различных концентрационных шкалах.
Биохимические стандартные состояния
Рассмотрим некоторую биохимическую реакцию, которая включает ион трехосновной кислоты H2A. Реально в растворе могут существовать кроме названного также ионы HA2 ; A3 заряженные частицы H3A. Соотношение их существенно зависит от величины рН, и концентрацию иона H2A трудно определить.
Важная особенность биохимического стандартного состояния заключается в том, что оно рассматривается при величине рН=7, который близок к физиологическому рН и это является стандартным значением активности ионов водорода.
Следовательно
![]() ,
для концентрации H+
= 107
моль/л.
,
для концентрации H+
= 107
моль/л.
Активность
любой другой молекулы равна общей
концентрации всех модификаций этой
молекулы при рН=7:
![]() (при рН=7), т.е. в нашем примере это общая
концентрация трехосновной кислоты,
определяемая аналитически. При этом
раствор рассматривается как идеальный.
(при рН=7), т.е. в нашем примере это общая
концентрация трехосновной кислоты,
определяемая аналитически. При этом
раствор рассматривается как идеальный.
