
КВАНТЫ билеты / Энергетический спектр и волновые функции стационарных состояний водородоподобного атома
.pdf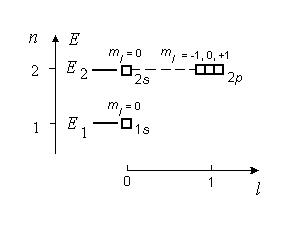
Энергетический спектр и волновые функции стационарных состояний водородоподобного атома
Для того, чтобы указать стационарное состояние электрона в атоме, используют специальную комбинацию двух символов. В ней первым символом является число, равное значению главного квантового числа n, которое нумерует стационарное состояние, вторым – малая буква из латинского алфавита, соответствующая орбитальному квантовому числу l по
схеме:
s l 0 , p l 1,
d l 2 и т.д.
Например, состояние, которое характеризуется квантовыми числами n 0 и l 0, обозначается символом 1s .
При заданном главном квантовом числе n наименьшее значение орбитального квантового числа l есть нуль, а наибольшее соответствует случаю, когда nr = 0, следовательно, оно равно n – 1. В связи с этим число l изменяется следующим образом: l = 0, 1, 2, … , (n – 1). Отсюда приходим к выводу, что существует n стационарных состояний, которые отличающихся значением квантового числа l, но имеют одинаковое значение квантового числа n. Причем при фиксированном значении орбитального квантового числа l магнитное орбитальное квантовое число ml может принимать (2l + 1) различных значений (было показано в п. 5.3). Другими словами, имеется (2l + 1) стационарных состояний с различными значениями ml и одинаковым значением l.
Из формулы (6.23) для энергии электрона, движущегося в кулоновском поле водородоподобного атома, видно, что его энергия Еn в стационарных состояниях зависит только главного квантового числа n. Поэтому значения энергии электрона в стационарных состояниях, которые характеризуются одинаковым значением n, но различными значениями l и ml, одни и те же. Это означает, что n-й энергетический уровень, за исключением первого (основного) n = 1, является вырожденным.
При этом надо помнить, что каждый n-й уровень вырожден по квантовому числу l с кратностью n, в свою очередь каждый l-й подуровень вырожден по квантовому числу ml с кратностью (2l + 1). Таким образом, общая кратность вырождения n-го энергетического уровня равна
n 1 |
|
(n 1)n |
n n2 . |
|
(2l 1) 2 |
||||
2 |
||||
l 0 |
|
|
||
|
|
|
||
На |
рис. |
6.2 |
показана |
|
энергетическая |
|
диаграмма |
||
водородоподобного атома, на которой изображены два энергетических
Рис. 6.2
уровня, соответствующих пяти стационарным состояниям. Квадратиками отмечены квантовые ячейки – символическое изображение орбиталей.
Используя выражения (6.24) для радиальной функции Rn,l (r) и (5.54) для сферической функции Yl,ml ( , ) , найдем явный вид нормированных собственных функций n,l,ml ( r , , ) электрона, который находится в
стационарных состояниях в водородоподобном атоме. Запишем орбитали (6.26), для нескольких случаев, а именно, когда электрон находится в 1s-, 2s- и 2p-состояниях:
1,0,0 |
(r) |
1 |
|
|
Z |
я |
3/2 |
e Z яr /a |
(1s-орбиталь) , |
(6.27а) |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|||||||||
|
|
|
|
a |
|
|
|
||||
2,0,0 |
(r) |
|
|
1 |
|
|
|
Z я |
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||||
|
|
|||||||||||
|
|
2 |
|
2 a |
||||||||
2,1,0 |
(r, , ) |
|
1 |
|
|
|
Z я |
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|||||||||
|
|
4 |
|
2 a |
||||||||
3/2 |
|
Z яr |
||||
|
1 |
|
|
|
||
2a |
||||||
|
|
|||||
3/2 |
|
Z яr |
e |
Z я |
||
|
|
|
|
|
||
|
a |
|
|
|||
|
|
|
|
|
||
e Z яr/2a
r/2a cos
(2s-орбиталь) , (6.27б)
(2p-орбиталь) , (6.27в)
2,1, 1 |
(r, , ) |
1 |
|
|
|
Z |
я |
3/2 |
Z |
я |
r |
e Z яr/2a sin e i (2p-орбитали) . (6.27г) |
|
|
|
|
|
|
|
|
|||||
8 |
|
|
|
|
a |
|
||||||
|
|
|
||||||||||
|
|
|
a |
|
|
|||||||
В соответствии с четвертым постулатом квантовой механики вероятность dPn,l,ml (r, , ) того, что при измерении положения электрона в
квантовом состоянии, характеризуемом числами n, l и ml, он будет обнаружен в малом объеме dV r2dr sin d d около точки с координатами ( r, , ), определяется выражением
|
|
|
|
|
|
(r, , ) |
|
2 |
r 2dr sin d d . |
|
|||
dP |
|
(r, , ) = |
|
n,l,m |
|
(6.28) |
|||||||
n,l,m |
|
|
|
|
|
|
|
|
|
|
|
||
|
l |
|
|
l |
|
|
|
|
|
|
|
|
|
Если проинтегрируем эту вероятность по углам и , |
то получим |
||||||||||||
вероятность dPnl (r) |
обнаружения электрона между двумя сферами радиусов |
||||||||||||
r и r dr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dP |
(r) = |
|
R |
(r) |
|
2 |
r 2dr , |
(6.29) |
|||
|
|
|
|
||||||||||
|
|
n,l |
|
|
|
n,l |
|
|
|
|
|
|
|
другими словами, эта формула дает распределение вероятности в радиальном направлении.
В случае интегрирования вероятности (6.29) по радиальной переменной r от 0 до приходим к угловой зависимости вероятности dPl,ml ( , ) , иначе

вероятности того, что электрон окажется где-то в пределах элемента телесного угла d sin d d около луча, задаваемого углами ( , )
|
|
|
|
|
|
( , ) |
|
2 sin d d . |
|
|
|
|
|
dP |
( , ) = |
Y |
|
|
(6.30) |
||
|
|
|
l,m |
|
l,m |
|
|
|
|
|
|
|
|
l |
|
|
l |
|
|
|
|
В качестве примера на рис. 6.3 представлены зависимости плотности |
||||||||||
вероятности r2R2 |
|
(r) |
(сплошная кривая) от расстояния r |
для радиальных |
||||||
n,l |
|
|
|
|
|
|
|
|
|
|
функций Rn,l (r) |
(штриховая кривая), |
|
соответствующих |
трем различным |
||||||
состояниям электрона в водородоподобном атоме. Электронная плотность уменьшается с увеличением расстояния от ядра, но теоретически равна нулю только на бесконечном от него расстоянии. В сторону ядра плотность уменьшается еще более резко и вблизи него практически равна нулю.
r2 R 2(r) |
|
10 |
1s |
|
|
0.5 |
|
|
R 10 |
0 |
|
|
5 |
r2 R2 |
|
(r ) |
|
r 2R |
2(r) |
||
|
20 |
|
2s |
|
|
21 |
|
|
|
|
|
|
|
|
|
|
|
0.5 |
R 20 |
|
|
0.5 |
|
|
|
|
|
|
|
|
|
10 |
zr |
|
0 |
5 |
10 |
zr |
0 |
|
a |
|
|
|
|
a |
|
|
|
|
|
Рис. 6.3 |
|
|
|
2p |
|
|
R21 |
|
|
5 |
10 |
zr |
|
|
a |
Наглядную пространственную картину о положении электрона в атоме может дать изображение электронного облака. Под ним понимают область пространства, в каждой точке которой может находиться электрон. На рис. 6.4. показаны сечения электронных облаков плоскостью, проходящей через ядро, для двух простых случаев: электрон в водородоподобном атоме находится в 1s- и 2s-состояниях. Видно, что электронные облака отличаются
по размеру, форме и распределению плотности. Кроме того, электронные облака не имеют четких границ, края их размыты в пространстве. Электронное облако для 2s-состояния, будучи также, как и все s- облака шарообразным, является двухслойным.
Размеры электронных облаков зависят от заряда
ядра: чем больше его заряд, тем сильнее оно притягивает электрон и тем меньше размер электронного облака. При одном и том же заряде ядра размер облака зависит, прежде всего, от главного квантового числа n.
