
10_Gidroliz_soley
.pdf
ЛЕКЦИЯ 10
ГИДРОЛИЗ СОЛЕЙ
ПЛАН ЛЕКЦИИ
 Общие понятия
Общие понятия
 Количественные характеристики процесса гидролиза солей
Количественные характеристики процесса гидролиза солей
 Константа гидролиза
Константа гидролиза
 Степень гидролиза и ее зависимость от различных факторов
Степень гидролиза и ее зависимость от различных факторов
 Расчет степени гидролиза и pH водных растворов солей
Расчет степени гидролиза и pH водных растворов солей
 Примеры гидролиза солей
Примеры гидролиза солей  Гидролиз солей слабых кислот и сильных оснований
Гидролиз солей слабых кислот и сильных оснований
Гидролиз солей слабых оснований и сильных кислот
 Гидролиз солей слабых оснований и слабых кислот
Гидролиз солей слабых оснований и слабых кислот  Необратимый гидролиз
Необратимый гидролиз
ОБЩИЕ ПОНЯТИЯ
Гидролиз соли - процесс обменного взаимодействия ионов соли с молекулами воды.
В результате гидролиза происходит связывание ионов соли в малодиссоциирующие соединения;
смещение ионного равновесия воды.
Протекание процесса гидролиза возможно, если в составе соли присутствуют ионы, способные образовывать с ионами воды слабые электролиты. Следовательно, гидролизу подвергаются соли, образованные
слабыми кислотами и сильными основаниями;
слабыми основаниями и сильными кислотами;
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

слабыми кислотами и слабыми основаниями.
В растворе соли, образованной слабой одноосновной кислотой (HA) и
сильным основанием (MOH), присутствуют анионы слабой кислоты:
МА = М+ + А−.
В процессе гидролиза соли анион связывает ион водорода воды в слабый электролит – HA, т.е. соль гидролизуется по аниону. Сущность происходящей реакции выражают уравнения:
A− + HOH |
HA + OH , |
MA + H2O |
HA + МOH. |
В результате гидролиза в растворе повышается концентрация ионов ОН−, среда становится щелочной (pH>7).
При гидролизе соли, образованной слабым основанием (ROH) и сильной кислотой (HВ) катион соли связывает ион ОН− в слабый электролит, т.е. соль
гидролизуется по катиону. Уравнения реакции гидролиза:
R+ + HOH |
ROH + H+, |
RВ + H2O |
ROH + HВ. |
В результате гидролиза соли в растворе повышается концентрация ионов водорода, среда становится кислой (pH<7).
Гидролиз невозможен, если в составе соли – только ионы сильных электролитов. Соли, образованные сильной кислотой и сильным основанием,
например, NaВr, KNO3, CaCl2, гидролизу не подвергаются, их растворы нейтральны.
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ПРОЦЕССА ГИДРОЛИЗА СОЛЕЙ
Константа гидролиза
Процесс гидролиза обратим, равновесие в системе смещено в направлении образования более слабого электролита - воды, т. е. в направлении обратной реакции.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Глубину прохождения обратимой реакции гидролиза характеризует константа равновесия. Равновесная концентрация воды практически неизменна при постоянной температуре и давлении, ее условно считают величиной постоянной и не включают в выражение константы равновесия. В случае гидролиза по аниону:
A− + HOH 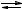 HA + OH
HA + OH ,
,
выражение константы гидролиза:
[HA][OH ] Kг [A- ] .
Константа гидролиза характеризует глубину протекания реакции гидролиза, большее значение Кг соответствует более полному протеканию гидролиза. Константа гидролиза зависит от природы соли, от температуры и не зависит от концентрации раствора.
Константу гидролиза можно выразить, используя справочные величины -
константу диссоциации слабого электролита и ионное произведение воды.
После умножения числителя и знаменателя на концентрацию ионов Н+ и
группировки сомножителей выражение Кг принимает вид:
Kг |
[HA][OH |
] [H |
] |
|
[HA] |
[H ][OH ]. |
|||
|
|
|
|
|
|
|
|
||
[A- ] |
|
[H |
] |
[A- ][H ] |
|||||
|
|
|
|||||||
Первый сомножитель – величина, обратная константе диссоциации слабой кислоты, второй сомножитель – ионное произведение воды K w .
|
|
Kг |
|
|
|
Kw |
. |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
Kкислоты |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Аналогично, для соли, гидролизующейся по катиону |
|||||||||||||||||||||
|
|
R+ + HOH |
|
|
|
|
ROH + H+, |
||||||||||||||
|
|
Kг |
|
|
|
Kw |
|
|
. |
|
|
|
|
|
|
|
|||||
|
|
Kоснования |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Величина Кг обратно пропорциональна константе диссоциации слабого электролита, образующегося в результате гидролиза. Следовательно, чем слабее кислота или основание, образующие соль, тем больше значение константы гидролиза, тем глубже протекает гидролиз соли.
Степень гидролиза и ее зависимость от различных факторов
Степень гидролиза (h) – отношение количества вещества (соли),
подвергшегося гидролизу, к общему количеству растворенного вещества.
Степень гидролиза рассчитывают по формуле
h |
Cгидр |
, |
|
С |
|||
|
|
где Сгидр – концентрация соли, подвергшейся гидролизу, моль/л; С – концентрация соли в растворе, моль/л.
Значение h выражают в долях единицы или процентах.
Степень гидролиза зависит от природы соли, концентрации раствора соли и температуры. При комнатной температуре степень гидролиза соли обычно невелика:
Формула соли |
Концентрация |
h, % |
|
раствора, моль/л |
|||
|
|
||
NH4Cl |
0,01 |
0,01 |
|
Na2CO3 |
0,1 |
2,7 |
|
CН3СООNH4 |
0,1 |
0,5 |
|
|
|
|
Степень гидролиза связана с константой гидролиза и концентрацией соли.
Для соли, гидролизующейся по аниону
A + HOH
+ HOH 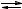 HA + OH ,
HA + OH ,
выражение константы гидролиза имеет вид:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Kг |
Kw |
. |
|
Kкислоты |
|||
|
|
Обозначим через C (моль/л) исходную концентрацию аниона кислоты в растворе соли. Тогда hC (моль/л) – концентрация анионов А , подвергшихся гидролизу, а равновесная концентрация анионов соли [A ] C hC , где h –
степень гидролиза (доли ед.). При гидролизе, согласно уравнению реакции,
образуется одинаковое количество молекул HA и ионов ОН−, следовательно,
[HA] [OH ] hC . После подстановки значений равновесных концентраций выражение константы гидролиза принимает вид:
K |
|
hC |
hC |
|
С (h 2 C) |
. |
г |
C |
hC |
|
С(1 h) |
||
|
|
|
|
h2 C Kг 1 h
Обычно степень гидролиза мала
h<<1, (1 - h) ≈ 1,
Kг h2C,
откуда следует приближенная формула для расчета степени гидролиза
h |
|
Kг |
|
. |
|
||||
|
|
С |
||
Полученное выражение справедливо для любой соли, подвергающейся гидролизу.
С учетом взаимосвязи константы гидролиза с константами диссоциации
слабых электролитов, образующих соль,
h |
|
K w |
|
. |
|
||||
|
|
K С |
||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Чем слабее основание или кислота, образующие соль, тем меньше значение К,
тем больше степень гидролиза соли.
Гидролиз соли - эндотермический процесс. Повышение температуры приводит к увеличению степени гидролиза.
При разбавлении раствора (уменьшении концентрации C ) степень гидролиза увеличивается.
Добавление кислоты приводит к смещению равновесия гидролиза соли по катиону
R+ + HOH  ROH + H+
ROH + H+
влево, т. е. к уменьшению степени гидролиза, а добавление щелочи – к
увеличению степени гидролиза.
Равновесие гидролиза соли по аниону,
A− + HOH 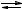 HA + OH ,
HA + OH ,
при добавлении кислоты смещается вправо, гидролиз усиливается; ослабить гидролиз можно добавлением кислоты.
РАСЧЕТ СТЕПЕНИ ГИДРОЛИЗА И PH ВОДНЫХ РАСТВОРОВ СОЛЕЙ
Константу гидролиза, степень гидролиза соли, а также значение pH
водного раствора можно рассчитать по значению констант диссоциации слабых электролитов, образующих соль.
Пример. Определите степень гидролиза ацетата натрия в 0,1М растворе и значение pH водного раствора.
Решение. Уравнение диссоциации соли
СH3COONa = Na++ СH3COO ,
исходная концентрация аниона слабой кислоты и концентрация раствора соли одинаковы, С = 0,1 моль/л.
Ионное уравнение гидролиза ацетата натрия
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

СH3COO + HOH
+ HOH  СH3COOH + OH .
СH3COOH + OH .
Константу гидролиза соли слабой кислоты и сильного основания рассчитываем по формуле
Kг |
|
K w |
|
10 |
14 |
|
5,5 10 |
10 |
. |
K |
CH 3COOH |
1,8 10 |
5 |
|
|||||
|
|
|
|
||||||
|
|
|
|
|
|
||||
Степень гидролиза соли определяем по значению константы гидролиза
|
|
|
|
|
|
10 |
|
|
|
h |
Kг |
|
5,5 10 |
7,4 10 |
5 |
, |
|||
С |
0,1 |
|
|
||||||
|
|
|
|
|
|
||||
или h 0,0074%.
Из уравнения гидролиза следует, что концентрация ионов OH− равна
концентрации соли, подвергшейся гидролизу:
[OH ] hC 7,4 10 5 |
0,1 7,4 10 6 моль/л, |
||||||
[H ] |
Kw |
|
10 14 |
|
1,4 10 |
9 |
моль/л. |
[OH ] |
7,4 10 |
6 |
|
||||
|
|
|
|
||||
Рассчитываем рН: |
|
|
|
|
|
|
|
|
pH |
lg(1,4 10 9 ) 8,9. |
|
|
|||
ПРИМЕРЫ ГИДРОЛИЗА СОЛЕЙ
Гидролиз солей слабых кислот и сильных оснований
Гидролиз соли NaNO2. Соль образована HNO2 – слабой одноосновной кислотой и NaOH – сильным основанием
NaNO2 = Na+ + NO2 .
Соль гидролизуется по аниону. При составлении уравнений гидролиза
целесообразно первым записывать ионное уравнение:
|
NO2 + HOH |
|
|
HNO2 + OH , |
|||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

NaNO2 + H2O  HNO2 + NaOH.
HNO2 + NaOH.
В результате гидролиза соли в растворе повышается концентрация ионов ОН−,
среда становится щелочной (pH>7).
Константа гидролиза
|
K w |
10 14 |
|
11 |
|||
Kг |
|
|
|
|
|
2 10 . |
|
K |
HNO 2 |
5,1 10 |
4 |
||||
|
|
||||||
|
|
|
|
||||
Значение Кг показывает, что равновесие гидролиза сильно смещено в направлении обратной реакции ( K г 1 ).
Гидролиз соли K2CO3.
Гидролиз солей слабых многоосновных кислот протекает ступенчато
Уравнение диссоциации соли
K2CO3 = 2K+ + CO32 .
Гидролиз идет по аниону, возможны две ступени гидролиза.
Уравнения гидролиза по I ступени:
CO32 + HOH
+ HOH  HCO3
HCO3 + OH ;
+ OH ;
K2CO3 + H2O  KHCO3 + KOH.
KHCO3 + KOH.
Уравнения гидролиза по II ступени:
HCO3 + HOH
+ HOH  H2CO3 + OH ;
H2CO3 + OH ;
KHCO3 + HOH  H2CO3 + KOH.
H2CO3 + KOH.
В результате гидролиза соли среда становится щелочной (pH>7).
Значения констант гидролиза по I ступени:
|
|
[HCO3 ] [OH ] |
|
[HCO3 ][OH ][H ] |
|
K w |
|
|
|
|
|
|
|||||||||||||||||||
|
Kг1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
H |
CO |
|
|
|
|
|
|
|||||||||
|
|
|
[CO3 |
] |
|
|
|
|
|
|
[CO3 |
][H ] |
|
K 2 2 |
|
3 |
|
|
|
|
|
||||||||||
10 |
14 |
|
2,1 10 4 |
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
4,8 10 11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Исполнитель: |
|
|
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

по II ступени:
Kг 2 |
[H 2CO3 ][OH ] |
[H 2CO3 ][OH ][H ] |
K w |
|
||||||||
|
|
[HCO3 |
] |
|
[HCO3 ][H ] |
|
H |
CO |
|
|||
|
|
|
|
|
K1 2 |
|
3 |
|||||
10 |
14 |
|
2,2 |
10 8. |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
4,5 10 |
7 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||
Значения Kг1 и Kг 2 << 1, равновесие гидролиза сильно смещено в направлении обратной реакции; Kг 2 << Kг1 , следовательно, гидролиз протекает преимущественно по первой ступени.
Соли слабых кислот и сильных оснований гидролизуются с увеличением концентрации ионов ОН− в растворе. Реакция среды водных растворов таких солей щелочная (pH>7). В результате образуются слабая одноосновная кислота или кислая соль (если кислота многоосновная) и сильное основание (щелочь).
Гидролиз солей многоосновных кислот в основном идет по первой ступени,
константу гидролиза по первой ступени можно рассчитать по формуле
Kг |
|
K w |
, |
1 |
кислоты |
||
|
|
K n |
|
где K n - константа диссоциации кислоты по n-й ступени, n - основность кислоты.
Гидролиз солей слабых оснований и сильных кислот
Гидролиз соли Cd(NO3)2.
Гидролиз солей большинства слабых оснований протекает ступенчато
(число возможных ступеней гидролиза равно заряду катиона).
Cd(NO3)2 = Cd2+ + 2NO3 .
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Гидролиз идет по катиону, возможны две ступени гидролиза.
Уравнения гидролиза по I ступени:
Cd2+ + HOH |
CdOH+ + H+; |
Cd(NO3)2 + H2O |
CdOHNO3 + HNO3. |
Уравнения гидролиза по II ступени: |
|
CdOH+ + HOH |
Cd(OH)2 + H+; |
CdOHNO3 + H2O |
Cd(OH)2 + HNO3. |
В результате гидролиза соли среда становится кислой, рН < 7. |
|
Равновесия при гидролизе по |
аниону также сильно смещены влево, |
причем гидролиз преимущественно протекает по первой ступени.
Соли слабых оснований и сильных кислот гидролизуются с увеличением концентрации ионов водорода в растворе. Реакция среды водных растворов таких солей кислая (pH<7). В результате образуются основная соль или слабое
основание и сильная кислота.
Гидролиз солей, образованных слабыми основаниями, в основном идет по первой ступени, константу гидролиза по первой ступени можно рассчитать по
формуле
Kг |
|
K w |
, |
1 |
основания |
||
|
|
K n |
|
где K n - константа диссоциации основания по n-й ступени; n - заряд катиона.
Гидролиз солей слабых оснований и слабых кислот
В случае гидролиза соли, образованной слабым основанием и слабой кислотой, в реакции одновременно участвуют и катион, и анион соли,
связывающие ионы воды.
Гидролиз соли CH3COONH4.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
