
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
23. Эдта и ее комплексы с металлами.
ЭДТУ — этилендиаминтетрауксусная кислота, гексодентатный лиганд, комплексон II, H4Y. Комплексоны- это аминополикарбоновые кислоты и их соли, относятся к полидентатным лигандам.
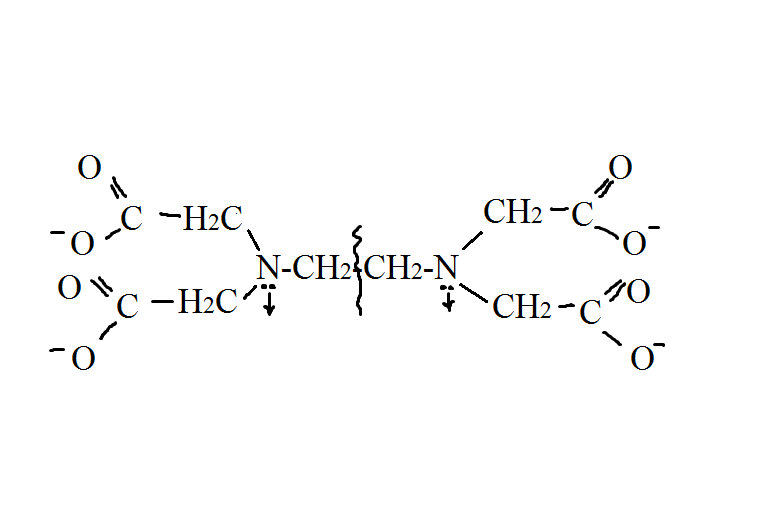
Такое присоединение дают комплексы с замкнутым циклом, которые называются хелаты(крайне прочные соединения состава 1:1).
В хелате один атом лиганда связывается с ионом Ме донорно-акцепторной связью, а другой атом — простой ковалентной.
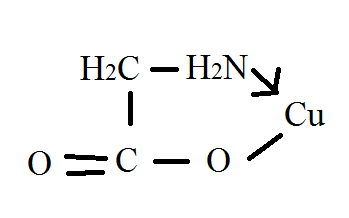
ЭДТА — двунатриевая соль ЭДТУ(комплексон III, трилон Б, Na2H2Y) Диссоциация ЭДТУ (комплексон II) в 4 стадии: H4Y ↔ H+ + H3Y- H3Y- ↔ H+ + H2Y2- H2Y2- ↔ H+ + HY3- HY3- ↔ H+ + Y4- по I и II стадии- это сильная кислота. Титруется как двухосновная.
Me2+ + H2Y2- ↔ [MeY]2- + 2H+ Me3+ + H2Y2- ↔ [MeY]- + 2H+ Me4+ + H2Y2- ↔ [MeY] + 2H+
Комплексоны с Ме дают бесцветные комплекс, очень прочные. В образовавшихся комплексах ионы Ме «защищают» водород карбоксильных групп титранта, и поэтому рН очень важен при титровании, и каждый Ме образует комплекс при определенном значении рН.
Не разделяя смесь Ме, но создавая нужный рН, можно оттитровать отдельные Ме. Точку эквивалентности фиксируют специфическими Ме-индикаторами.
24. Рабочие растворы и индикаторы в комплексонометрическом титровании
Основным рабочим раствором в комплексонометрии * является раствор Na2H2Y×2H2O. Эта соль легко получается в чистом виде, хорошо растворима в воде, растворы устойчивы при хранении. В обычных условиях препарат содержит примерно 0,3% влаги, поэтому титрованные растворы трилона Б можно готовить по точной навеске (с учетом 0,3% H2O). Однако обычно его титр устанавливают (например, по раствору соли цинка, полученному растворением точной навески металлического цинка в соляной кислоте). Применяемые для титрования растворы ЭДТА имеют концентрацию 0,01…0,05 моль/л и реже 0,1 моль/л.
В первых титриметрических методиках с применением ЭДТА использовались обычные кислотно-основные индикаторы
В качестве индикаторов в комплексонометрии используют металлохромные индикаторы. Это органические красители, образующие окрашенные комплексные соединения с ионами металла, менее прочные, чем комплекс металла с комплексоном.
Другим широко применяемым в комплексонометрии индикатором является эриохром черный Т, относящийся к группе азокрасителей и имеющий в молекуле хелатообразующие OH-группы
25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
Для характеристики ОВ процессов в отличие от других типов химических реакций чаще используют не константу равновесия, а стандартный электродный потенциал. aOx1 + bRed2 ↔ aRed1 + bOx2 1. aOx1 + ne ↔ aRed1 2. bOx2 + ne ↔ bRed2
Для
обратимой ОВ полуреакции зависимость
равновесного потенциала Е от активности
окисленной формы Ох и восстановленной
формы Red
выражается уравнением Нернста.
Ox
+ ne
↔ Red
 F
— число Фарадея = 96500 Кл/г-экв
Т —
абсолютная температура К
n
— число электронов, участвующих в ОВ
реакции
R
— газовая постоянная = 8,31 Дж/моль*К
При
Т=20°С
F
— число Фарадея = 96500 Кл/г-экв
Т —
абсолютная температура К
n
— число электронов, участвующих в ОВ
реакции
R
— газовая постоянная = 8,31 Дж/моль*К
При
Т=20°С
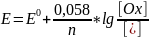 Если
в реакции участвуют ионы водорода, то
Если
в реакции участвуют ионы водорода, то
Ox
+ ne
+ Н+
↔ Red,
то
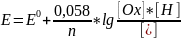 ОВ
реакция — сочетание двух полуреакций.
Для определения направления реакции
необходимо найти разность стандартных
потенциалов полуреакций.
Если разность
потенциалов положительна, то реакция
протекает слева-направо, но обе реакции
должны быть записаны в форме процесса
восстановления.
Глубина протекания
реакции определяется константой
равновесия.
ОВ
реакция — сочетание двух полуреакций.
Для определения направления реакции
необходимо найти разность стандартных
потенциалов полуреакций.
Если разность
потенциалов положительна, то реакция
протекает слева-направо, но обе реакции
должны быть записаны в форме процесса
восстановления.
Глубина протекания
реакции определяется константой
равновесия.
Связь Кр и Е полуреакций:
Ox1 + n1e ↔ Red1 Ox2 + n2e ↔ Red2
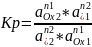
При
равновесии Е1
= Е2.
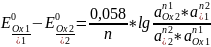

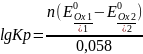 Формальный
потенциал.
Стандартный
потенциал используется для расчета
равновесия в системах, где можно
пренебречь конкурирующими реакциями
и электростатическими взаимодействиями
с участием Ox
и Red
форм.
В реальных условиях используется
формальный потенциал Е0(1).
при
условии, что СОх
= СRed
= 1 моль. Обычно формальный потенциал
приводится в справочниках при определенном
значении ионной силы.
Формальный
потенциал.
Стандартный
потенциал используется для расчета
равновесия в системах, где можно
пренебречь конкурирующими реакциями
и электростатическими взаимодействиями
с участием Ox
и Red
форм.
В реальных условиях используется
формальный потенциал Е0(1).
при
условии, что СОх
= СRed
= 1 моль. Обычно формальный потенциал
приводится в справочниках при определенном
значении ионной силы.
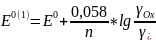
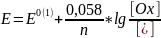 E
= E0(1)
, если [Ox]
= [Red]
= 1,0.
E
= E0(1)
, если [Ox]
= [Red]
= 1,0.
