
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
69. Детекторы в газовой хроматографии.
Детектор – устройство, для обнаружения в потоке газа-носителя анализируемых ве-в по какому-либо свойству. Отклик осуществляется благодаря преобразованию свойств в электрический сигнал.
Неселективные детекторы:
Детектор по теплопроводности (катарометр) – универсален. Процесс передачи тепла от нагретого чувствительного элемента к более холодному корпусу детектора за счет теплопроводности газового потока

Пламенно-ионизационный детектор – зависимость электрической проводимости ионизированного газа от его состава. Сигналом детектора является изменение ионного тока, вызванное введением в детектор анализируемого в-ва
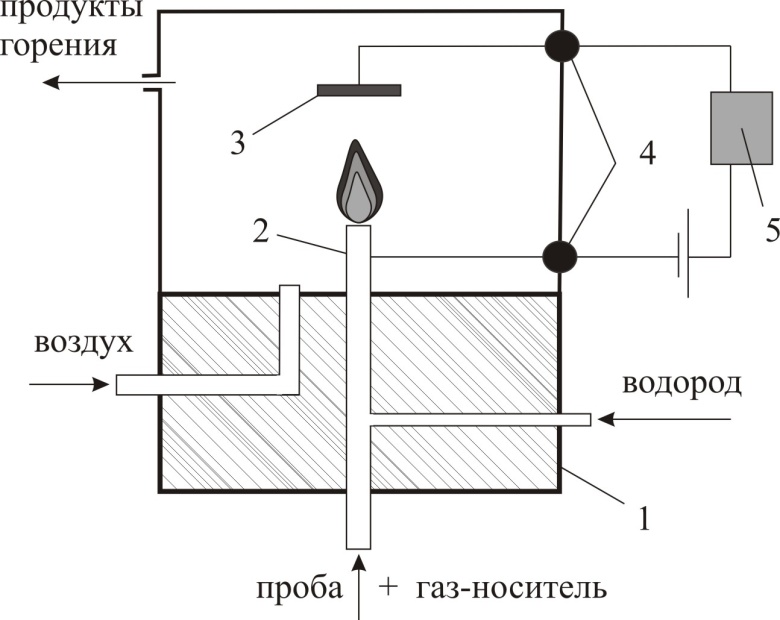
Селективные детекторы:
Термоионный – высокочувствителен и селективен к фосфорорганическим ве-ам

Элетронного захвата – определение соединений, обладающих большим сродством к электронам

Пламенно-фотометрический – селективен по отношению к фосфор и серосодержащим в-ам
70. Качественный анализ в газовой хроматографии.
Основными характеристиками, с помощью которых можно произвести качественный анализ смеси веществ, являются время удерживания вещества tu , удерживаемый объем VR и относительный удерживаемый объем V0.
Время удерживания tu – время от момента ввода пробы до момента регистрации максимума пика на хроматограме (см. рис.6.1.). Оно складывается из времени движения вещества с газом-носителем t0 вдоль колонки и суммарного времени нахождения в сорбированном состоянии tR (исправленное время удерживания).
tu= t0 +tR (6.1)
где t0 одинаково для всех веществ смеси и определяется скоростью потока газа-носителя u0, tR при постоянных условиях опыта (температуре и скорости газа-носителя) зависит от природы анализируемого вещества и неподвижной фазы. Компоненты смеси, различающиеся по энергии взаимодействия с данной неподвижной фазой, будут иметь различные значения tR.
Удерживаемый объем VR – это объем газа-носителя, прошедшего через колонку за время удерживания tR. Его значение рассчитывают по формуле:
VR = tRw, (6.2)
где w – объемная скорость газа-носителя (объем газа-носителя, проходящий через колонку за единицу времени ). Величина VR зависит от объема неподвижной фазы в колонке Va и коэффициента распределения вещества между двумя фазами G = Ca /C ( Са и С – концентрации анализируемого вещества в неподвижной фазе и газе-носителе, соответственно), который определяется температурой и природой вещества.
VR = VaG (6.2’)
Отношение удерживаемого объема вещества VR к удерживаемому объему вещества-стандарта VRst называют относительным удерживаемым объемомV0
V0 = VR /VRst = G/Gst (6.3)
Величина V0 зависит только от природы веществ и температуры и мало зависит от изменения других параметров опыта (размеров колонки, скорости потока и др.). Таким образом, относительный удерживаемый объем является более воспроизводимой качественной характеристикой вещества по сравнению с tu, tR, VR.
71. Методы количественного анализа в газовой хроматографии.
Используют три основных метода: метод абсолютной градуировки, метод внутренней нормализации и метод внутреннего стандарта.
М е т о д а б с о л ю т н о й г р а д у и р о в к и
Метод абсолютной градуировки основан на прямой зависимости между высотой или площадью хроматографического пика и количеством вещества в смеси. Данный метод удобно использовать, когда необходимо определить концентрацию лишь какого-либо одного компонента смеси. Метод абсолютной градуировки является основополагающим при анализе микропримесей.
Для
проведения градуировки хроматографа
гравиметрически готовят ряд искусственных
смесей (обычно 4-6 образцов), содержащих
анализируемый i-й
компонент в известных концентрациях
( ![]() ).
Для каждой из полученных смесей в строго
контролируемых условиях работы прибора
записывают 2-3 хроматограммы и рассчитывают
площади пиков (
).
Для каждой из полученных смесей в строго
контролируемых условиях работы прибора
записывают 2-3 хроматограммы и рассчитывают
площади пиков ( ![]() )
анализируемого i-ого
компонента. Площади пиков для каждой
смеси усредняют и в результате получают
набор значений (1), (2) и т. д. соответствующих
значениям (1), (2) и т. д. Если область
рабочих концентраций не выходит за
пределы линейного динамического
диапазона детектора, градуировочная
зависимость представляет собой прямую
линию, выходящую из начала координат и
описываемую уравнением
)
анализируемого i-ого
компонента. Площади пиков для каждой
смеси усредняют и в результате получают
набор значений (1), (2) и т. д. соответствующих
значениям (1), (2) и т. д. Если область
рабочих концентраций не выходит за
пределы линейного динамического
диапазона детектора, градуировочная
зависимость представляет собой прямую
линию, выходящую из начала координат и
описываемую уравнением
![]() (43)
(43)
График обрабатывают методом наименьших квадратов, в результате чего получают значение абсолютного градуировочного коэффициента Kабс, показывающего число единиц концентрации, приходящихся на 1 мм2 площади пика. В большинстве случаев отрезок, отсекаемый по оси абсцисс b = 0. Однако в некоторых случаях требуется оценка значимости коэффициента b.
При выполнении анализа методом абсолютной градуировки необходимо строго придерживаться следующих требований:
– анализируемая проба должна вводиться в прибор с высокой воспроизводимостью;
– в процессе калибровки и выполнения анализов необходимо строгое поддержание постоянства режима работы хроматографа (температур узла ввода пробы, термостата колонок и детекторов, скорости потока газа-носителя и вспомогательных газов, при использовании детектора по теплопроводности – тока моста).
При несоблюдении этих требований погрешность анализа может достигать значительных величин. Воспроизводимость и точность ввода пробы обеспечивается в достаточной мере при анализе газовых смесей с использованием крана-дозатора. Точный ввод жидких образцов микрошприцем требует определенного навыка оператора.
2. М е т о д в н у т р е н н е й н о р м а л и з а ц и и (н о р м и р о в к и)
Метод внутренней нормализации площадей пиков (нормировки) используют тогда, когда на хроматограмме зафиксированы пики всех компонентов, и они хорошо разделены. Метод широко используется при анализе многокомпонентных смесей, когда интересуют концентрации каждого из компонентов.
Сущность
метода внутренней нормализации состоит
в приравнивании (нормировании) суммы
площадей всех пиков хроматограммы ( ![]() )
к 100 % массовой концентрации. При делении
площади пика анализируемого i-го
компонента (
)
к 100 % массовой концентрации. При делении
площади пика анализируемого i-го
компонента ( ![]() )
на сумму площадей пиков получают массовую
долю компонента в процентах (
)
на сумму площадей пиков получают массовую
долю компонента в процентах ( ![]() ):
):
![]() (44)
(44)
Очевидно, что данный метод будет давать адекватные результаты при равной чувствительности используемого в приборе детектора ко всем компонентам смеси. Это достигается при использовании пламенно-ионизационого детектора или катарометра для анализа смесей, компоненты которых имеют сходное химическое строение (например, углеводородные фракции).
Для
получения точных результатов при анализе
смесей веществ различного строения
(например, спиртов, ароматических
углеводородов и сложных эфиров) необходимо
вводить относительные поправочные
(градуировочные) коэффициенты ( ![]() ):
):
![]() (45)
(45)
3. М е т о д в н у т р е н н е г о с т а н д а р т а
Метод внутреннего стандарта заключается в хроматографировании исследуемого образца с добавкой известного количества, не содержащегося в смеси специально подобранного вещества – «внутреннего стандарта» или «внутреннего эталона». На полученной хроматограмме определяют площади пиков определяемого компонента и внутреннего стандарта, для которых справедливо следующее соотношение:
![]() (46)
(46)
где
и ![]() –
концентрация анализируемого вещества
и внутреннего стандарта соответственно, масс.
%,
–
концентрация анализируемого вещества
и внутреннего стандарта соответственно, масс.
%, ![]() –
градуировочный коэффициент i-го
компонента по внутреннему стандарту
(st),
и
–
градуировочный коэффициент i-го
компонента по внутреннему стандарту
(st),
и ![]() –
площади хроматографических пиков
определяемого i-го
компонента и внутреннего стандарта
соответственно. Из данного уравнения
легко определить искомую концентрацию
.
–
площади хроматографических пиков
определяемого i-го
компонента и внутреннего стандарта
соответственно. Из данного уравнения
легко определить искомую концентрацию
.
Коэффициент определяют путем градуировки хроматографа по искусственным смесям, содержащим известные количества анализируемого компонента и внутреннего стандарта:
![]() (47)
(47)
где ![]() и
и ![]() –
массы анализируемого компонента и
внутреннего стандарта в искусственной
смеси соответственно, г.
–
массы анализируемого компонента и
внутреннего стандарта в искусственной
смеси соответственно, г.
можно приравнять к единице, при условии, что чувствительности детектора к определяемому компоненту и внутреннему стандарту достаточно близки между собой и подобное упрощение не вызывает существенной погрешности.
72.
Ионно-обменная хроматография. Иониты
и их свойства. Равновесие ионообменной
реакции. Примеры разделений.
Основана
на обратном стехиометрическом обмене
ионов, находящихся в растворе на ионы,
входящие в состав ионообменника. Широкое
применение получила в связи с созданием
синтетических полимерных ионообменников
или ионообменных смол или ионитов.
Иониты
— сополимеры стирола и дивинилбензола
трехмерной структуры, содержащие
различные функциональные группы, которые
и определяют основные свойства
ионообменных смол. Делятся на: 1)Катиониты
(весь каркас заряжен «-», компенсируется
«+» зарядом противоионов). 2)Аниониты
(аммониевые, пиридиновые основания;
противоионы — анионы)
Противоионы
подвижны, способны обмениваться на
эквивалентное
количество ионов из раствора.
3)Амфолиты
(могут обмениваться на анионы и
катионы).
Важной количественной
характеристикой явл. Обменная
емкость
— характеристика ионита. Это число
функциональных групп каркаса и степень
их ионизации при данном рН раствора;
количество моль эквивалента противоиона
на единицу массы или объема смолы.
Виды:1)
статическая-найденная в статических
условиях; 2)Динамическая- найденная в
динамических условиях. Полная динамическая
обменная емкость находится при полном
насыщении ионита данным ионом.
Ионообменные
реакции.
Реакции
в растворах электролитов, при которых
не происходит изменения зарядов ионов,
входящих в соединения, называются
ионообменными реакциями.
2RH
+ Ca2+↔R2-Ca
+ 2H+
R-OH
+ Cl-
↔RCl
+ OH-
Равновесие
характеризуется коэффициентом
распределения:
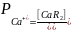 и
ТД и равновесной константами ионного
обмена.
С ростом заряда сродство
ионов к смоле увеличивается.
С
повышением Т избирательность поглощение
уменьшается.
Введение в раствор
комплексообразующих соединений смещает
равновесие. Используется для разделения
ионов.
Лаб.работа
: Определение содержания сульфата
натрия.
и
ТД и равновесной константами ионного
обмена.
С ростом заряда сродство
ионов к смоле увеличивается.
С
повышением Т избирательность поглощение
уменьшается.
Введение в раствор
комплексообразующих соединений смещает
равновесие. Используется для разделения
ионов.
Лаб.работа
: Определение содержания сульфата
натрия.
