
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
Связывает
высоту тарелок с процессами диффузии,
медленным установлением равновесия,
неравномерностью процесса.
Смысл
теории: подобрать оптимальную скорость,
чтобы Н была минимальной, а эффективность
разделения максимальна. Теория дает
основу для оптимизации Х процесса.
Уравнение
Ван-Демтера:
H=A+B/U +CU A, B, C – константы,
U- скорость ПФ
А- связан с вихревой
диффузией, зависит от размера частиц и
плотности упаковки (постоянный вклад).
В
-связан с продольной диффузией, существенно
влияет при малых скоростях.
С-
характеризует кинетику процесса.
С
увеличением U вклад СU
возрастает, а B/U
уменьшается.
Суммарная кривая-
гипербола и Минимальная Н соответствует
оптимальной скорости потока.
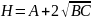 ;
;
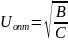
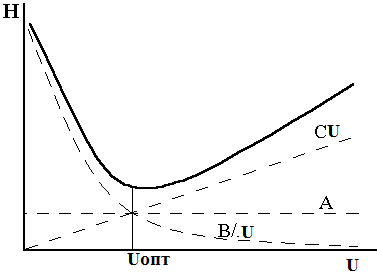
Кинетическая теория дает основу для оптимизации хроматографического процесса.
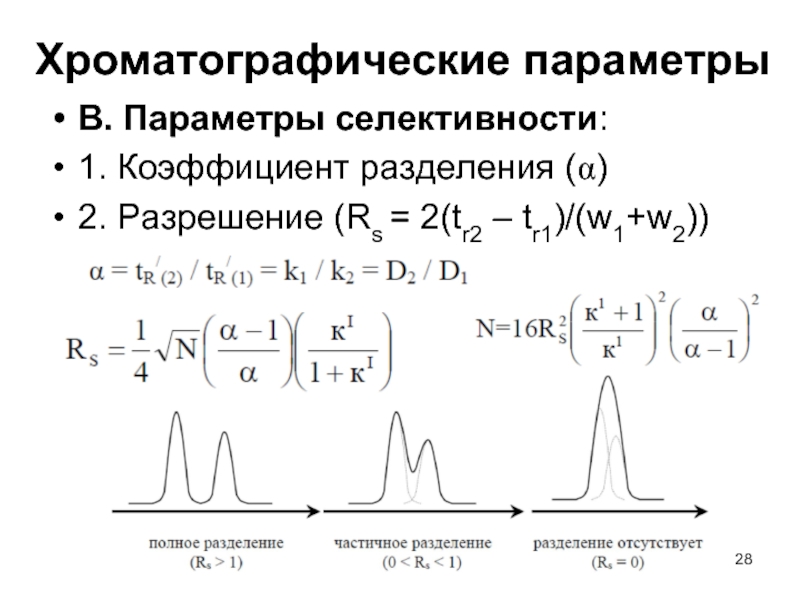
67. Критерии разделения в газовой хроматографии.
68. Газовая хроматография. Общая характеристика метода.
Газовая хроматография - хроматография, в которой подвижная фаза находится в состоянии газа или пара - инертный газ (газ-носитель). Неподвижной фазой (НЖФ) является высокомолекулярная жидкость, закрепленная на пористый носитель или на стенки длинной капиллярной трубки.
Газо-адсорбционная хроматография
Газотвердофазная хроматорафия В газоадсорбционной хроматографии (ГАХ) в качестве неподвижной фазы применяют различные адсорбенты – высокодисперсные искусственные или природные тела с высокой удельной поверхностью (10–1000 м2 /г), поглощающие газы или пары.
Адсорбция молекул из газовой фазы происходит за счет межмолекулярных взаимодействий, имеющих электростатическую природу; возможно образование водородной связи, но вклад этого взаимодействия уменьшается с ростом температуры.
Адсорбент должен обладать следующими основными свойствами: необходимой селективностью, отсутствием каталитической активности и химической инертностью к компонентам разделяемой смеси, достаточной механической прочностью. Основными адсорбентами, применяемыми в газо-адсорбционной хроматографии, являются активированные угли, силикагели, оксид алюминия. Неоднородность поверхности активных адсорбентов не дает возможности определять сильно адсорбирующиеся полярные молекулы, однако, в последнее время промышленностью выпускаются адсорбенты с достаточно однородной поверхностью, такие, как пористые стекла, пористые полимеры, синтетические цеолиты (молекулярные сита), макропористые силикагели (силохром, порасил, сферосил), позволяющие проводить анализ смесей сильнополярных веществ.
Метод ГАХ на колонках с пористыми полимерными сорбентами– удобный и быстрый способ определения воды в неорганических и органических материалах.
Газо-жидкостная хроматография
В аналитической практике чаще используют метод газожидкостной хроматографии (ГЖХ). Это связано с чрезвычайным разнообразием жидких неподвижных фаз. В газожидкостной хроматографии неподвижной фазой служит практически нелетучая при температуре колонки жидкость, нанесенная на твердый носитель. Количество жидкой фазы составляет 5-30% от массы твердого носителя.
К жидкой фазе предъявляется ряд жестких требований:
1) способность хорошо растворять компоненты смеси (если растворимость мала, компоненты выходят из колонки очень быстро);
2) инертность по отношению к компонентам смеси и твердому носителю;
3) малая летучесть (чтобы не испарялась при рабочей температуре колонки);
4) термическая устойчивость;
5) достаточно высокая селективность, т.е. способность разделять смесь компонентов;
6) небольшая вязкость (иначе замедляется процесс диффузии);
7) способность образовывать при нанесении на носитель равномерную пленку, прочно с ним связанную.
Природа жидкой фазы является тем основным фактором, который определяет последовательность выхода компонентов из колонки. В качестве жидких фаз применяются неполярные парафины (например, сквалан, вазелиновое масло, апиезоны), умеренно полярные (сложные эфиры, нитрилы и др.) и полярные (полиэтиленгликоли или карбоваксы, гидроксиламины и др.) Каждая жидкая фаза имеет температурные пределы применения. Нижний температурный предел – минимальная рабочая температура, соответствующая застыванию жидкой фазы. Обычно выбирают минимальную рабочую температуру колонки выше точки застывания жидкой фазы на 10-15 оС. Верхний температурный предел – максимальная допустимая рабочая температура (МДРТ) жидкой фазы, выше которой она начинает разрушаться, при этом образуются летучие соединения, уносимые из колонки. Практика использования жидких фаз для анализа показывает, что необходимо работать с ними при температурах на 20- 30 оС ниже МДРТ жидкой фазы. Наибольшим температурным диапазоном использования в газо-жидкостной хроматографии обладают кремнийорганические полимеры, например, метилсиликоны – жидкости при комнатной температуре, а МДРТ их достигает 300-350 оС. Наиболее термостабильными жидкими фазами являются карборан- 8 силоксановые полимеры, в которые входят атомы бора, кремния и углерода. МДРТ этих соединений достигает 400 оС.
Твердым носителем обычно служит практически инертное твердое вещество, на которое наносят неподвижную жидкость. Основное назначение твердого носителя в хроматографической колонке – удерживать жидкую фазу на своей поверхности в виде однородной пленки. В связи с этим твердый носитель должен иметь значительную удельную поверхность (0,5-10 м2 /г), причем она должна быть макропористой во избежание адсорбции компонентов пробы. Кроме того, твердый носитель должен обладать следующими качествами: отсутствием каталитической активности, достаточной механической прочностью, стабильностью при повышенных температурах, однородностью пор по размерам, максимальной однородностью размера зерен. Однако до настоящего времени не создано универсального носителя, удовлетворяющего всем перечисленным требованиям. В качестве твердых носителей в газо-жидкостной хроматографии используются диатомиты (кизельгур, инфузорная земля), синтетические кремнеземы (макропористые силикагели, широкопористые стекла, аэросилогели), полимерные носители на основе политетрафторэтилена и т.д. Часто используют модифицированные носители, ковалентно связанные с «жидкой» фазой. При этом стационарная жидкая фаза более прочно удерживается на поверхности даже при самых высоких температурах колонки. Химически связанная неподвижная фаза более эффективна.
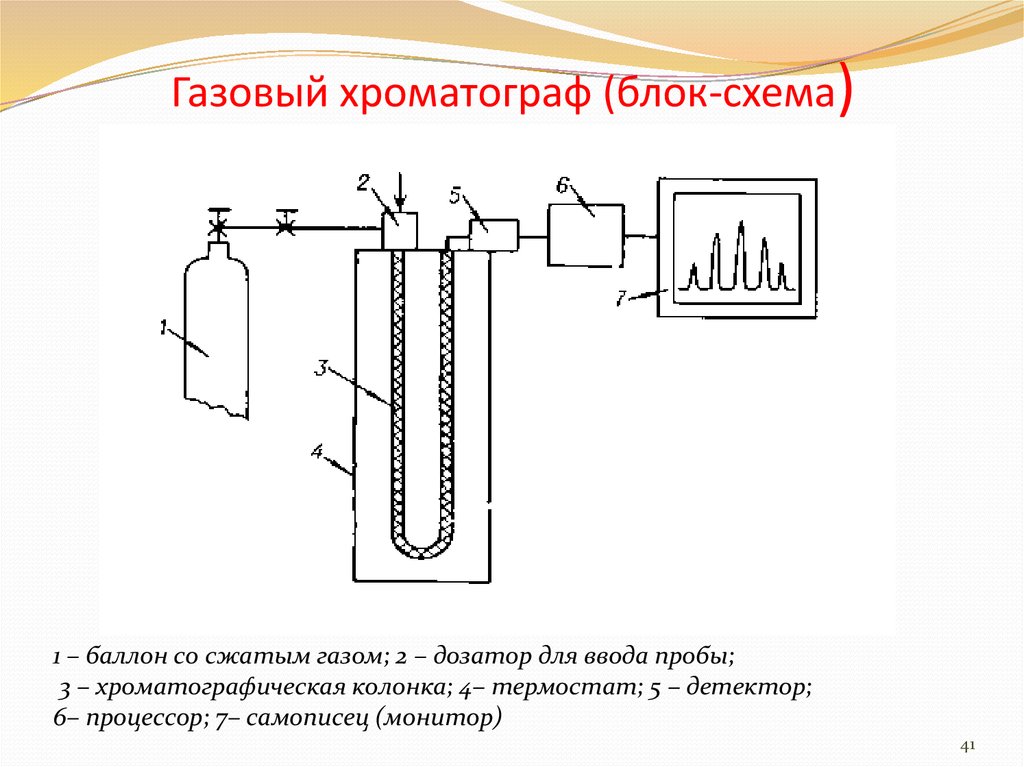
Трабования
Требования к газу-носителю:
- инертность по отношению к разделяемым веществам и
сорбенту
- взрывобезопасность
- чистота
