
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
63. Фронтальная, вытеснительная и элюентная хроматография.
Элюентная хроматография происходит от слова «элюент» - это подвижная фаза, которая переносит анализируемую смесь через неподвижную фазу. Элюат – это подвижная фаза, содержащая разделенные компоненты на выходе их колонки.
Элюент (растворитель) должен как можно меньше сорбироваться на поверхности неподвижной фазы. Пробу вводят в колонку или наносят на пластинку вместе с растворителем и дальше продолжают пропускать через колонку чистый растворитель. Компоненты анализируемой смеси перемещаются вдоль колонки (пластины) с разными скоростями в соответствии с их сорбируемостью. На выходе из колонки сначала появляется наименее сорбируемый компонент, затем следующий и т. д. В этом случае хроматограмма имеет вид (рис. 1). Этот вид хроматографии наиболее распространен.
Вытеснительная хроматография. При выполнении вытеснительной хроматографии сначала в колонку вводят раствор с разделяемыми компонентами, затем через колонку пропускаю растворитель с большой сорбируемостью (вытеснитель). В результате первым по колонке перемещается компонент с минимальной сорбируемостью, затем – с большей и т. д. Последним из колонки выходит вытеснитель. Примером вытеснительной хроматографии может быть ионообменная хроматография. В этом случае каждый компонент выделяется в чистом виде, но не количественно, так как зоны компонентов на хроматограмме не разделены участками чистого сорбента
Фронтальная хроматография осуществляется следующим образом. В колонку непрерывно подают раствор разделяемых компонентов, сорбируемость которых увеличивается в ряду А < В < С. Из колонки сначала выходит чистый растворитель, затем наименее сорбируемый компонент А, затем смесь компонентов А и В и т. д. При этом способе проведения хроматографии в чистом виде (но не количественно) можно выделить только один, наименее сорбируемый компонент.
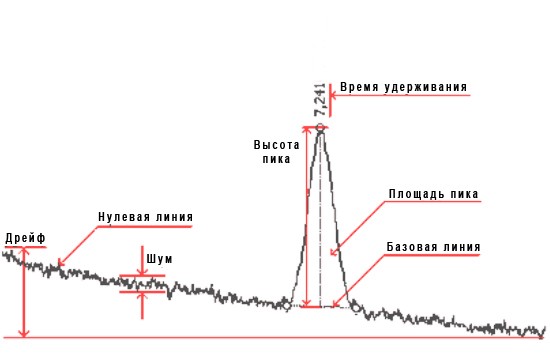
64. Основные характеристики хроматографического пика.
Основные параметры хромотографического пика.
· время удерживания — время от начала анализа до максимума пика;
· площадь — область, заключенная между пиком и ограничивающей его базовой линией;
· высота — расстояние между базовой линией и максимумом пика;
· ширина пика на половине его высоты.
- мертвое время – время удерживания инертного в-ва
- приведенное время удерживания = время удерживания компонента - время удерживания не сорбируемого в-ва
Полный объем удерживания – VR = tR*v0 (объемная скорость носителя)
Исправленный объем удерживания – Vm = VR-Vm
65. Эффективность хроматографической системы. Концепция теоретических тарелок.
Эффективность является мерой расширения пика вещества при его движении вдоль колонки и тесно связана с числом теоретических тарелок — воображаемых участков по длине колонки, в каждом из которых как бы достигается термодинамическое равновесие фаз. Кроме того, на неё влияют такие факторы, как вихревая диффузия, продольная молекулярная диффузия и сопротивление массопереносу. Как правило, число теоретических тарелок в современных капиллярных колонках очень велико — несколько десятков тысяч. Это позволяет, при правильном подборе селективности неподвижной фазы, в подавляющем большинстве случаев разделить все индивидуальные компоненты любой, даже самой сложной, смеси. Эффективность колонки тем выше, чем уже пик получается при том же времени удерживания. Эффективность колонки измеряется числом теоретических тарелок (ЧТТ) N: чем выше эффективность, тем больше ЧТТ, тем меньше расширение пика первоначально узкой полосы по мере прохождения ее через колонку, тем уже пик на выходе из колонки. ЧТТ характеризует число ступеней установления равновесия между подвижной и неподвижной фазами.
Теория теоретических тарелок.
Теория теоретических тарелок (введена Мартином и Сингом Нобелевские лауреаты 1952 г.) основана на допущениях:
1) колонка состоит из определенного числа теоретических тарелок;
2) на каждой тарелке мгновенно достигается равновесие (равновесное отношение доли сорбированного вещества к доле, оставшейся в подвижной фазе), причем до того, как подвижная фаза переместится на следующую тарелку;
3) вводимая проба должна быть малой и обеспечивать линейную изотерму сорбции;
4)все протекающие в колонке процессы рассматриваются как взаимозависимые.
Теоретическая тарелка – это гипотетическая зона, высота которой соответствует достижению равновесия между двумя фазами. Чем больше теоретических тарелок в колонке, чем большее число раз устанавливается равновесие , тем эффективнее колонка.
Количественной мерой эффективности колонки служат высота Н, эквивалентная теоретической тарелке, (ВЭТТ), и число теоретических тарелок N.
Эффективность колонки тем выше, чем меньше высота, эквивалентная теоретической тарелке, и больше число теоретических тарелок.
Значения ВЭТТ и числа тарелок сохраняют свое значение и в кинетической теории хроматографии, учитывающей скорость миграции вещества, диффузию и другие факторы.
ВЭТТ, связана со скоростью потока уравнением Ван-Деемтера:
![]()
где А, В, С –константы; U – скорость подвижной фазы.
Константа A связана с действием вихревой диффузии, которая зависит от размера частиц и плотности заполнения колонки.
Величина В связана с коэффициентом диффузии молекул в подвижной фазе, это слагаемое учитывает действие продольной диффузии.
Величина С характеризует кинетику процесса сорбция-десорбция, массопередачу и другие эффекты.
Влияние каждого слагаемого уравнения навеличину Н в зависимости от скорости подвижной фазы показано на рисунке:
-первое слагаемое дает постоянный вклад в Н;
-вклад второго слагаемого существен при небольшой скорости потока;
-с увеличением скорости подвижной фазы влияние третьего слагаемого возрастает, а доля второго уменьшается.
Суммарная кривая, характеризующая зависимость Н от скорости потока, представляет собой гиперболу.
