
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
61. Кулонометрия при постоянном потенциале и постоянной силе тока.
Различают: 1. Прямую кулонометрию (при постоянном потенциале)
Электролизу
подвергают определяемое вещество.
Измеряют его кол-во эл-ва, затраченное
на электролиз и по ур-ю рассчитывают
массу.
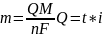
Е выбирают на основе поляризационной кривой, построенной в координатах i-E, обычно выбирвют Е в области предельного токадля определения в-ва и несколько превышающий его потенциал полуволны (на 0,05-0,2 В). При этом значении фоновый электролит не должен подвергаться гидролизу. В ячейке происходит восстановление/окисление в-ва, чаще всего – платиновый электрод (например, железа) + электрод сравнения (например, хлорсеребряный).
По мере уменьшения концентрации восстанавливающегося иона сила тока в цепи падает до 0 в конце процесса. Лабораторная работа- кулонометрическое определение меди 2. Кулонометрическое титрование (при постоянной силе тока) Титрант генерируется на электроде в количестве, точно эквивалентном содержанию анализируемого вещества. По количеству электричества, необходимого на генерацию титранта, можно рассчитать содержание вещества.
Вместо V измеряют t и i

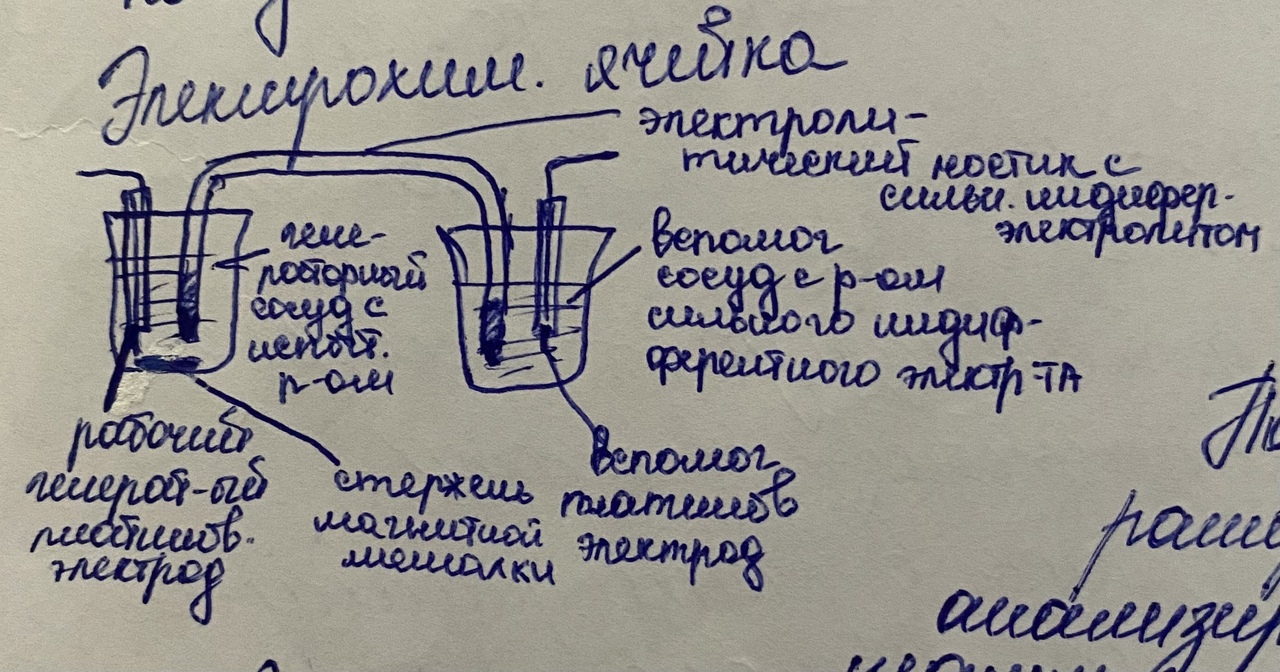 Лаб.работа-
Кулонометрическое титрование. Определение
тиосульфат-ионов.
Преимущества
метода:
-
рабочие растворы не стандартизируют
-
можно использовать малоустойчивые и
легколетучие вещества
- регулирую
силу тока, можно использовать небольшие
порции вещества.
Лаб.работа-
Кулонометрическое титрование. Определение
тиосульфат-ионов.
Преимущества
метода:
-
рабочие растворы не стандартизируют
-
можно использовать малоустойчивые и
легколетучие вещества
- регулирую
силу тока, можно использовать небольшие
порции вещества.
62. Классификация хроматографических методов анализа.
По агрегатному состоянию подвижной и неподвижной фаз:
1.газовая (подв.)
a. газо-жидкостная(подв. + жидк.) происходит растворение веществ в жидкой фазе.
b. газо-твердофазная или газо-адсорбционная (подв. + тв.) газы удерживаются поверхностью 2.жидкостная(подв.)
a. жидкостно-жидкостная или распределительная(подв. + жидк.) жидкости не смешиваются
b. жидкостно-твердофазная или жидкостно-адсорбционная (подв. + тв.) вещества удерживаются поверхностью
По механизму разделения:
В адсорбционной хроматографии разделение за счет адсорбции основано на различии адсобируемости компонентов смеси на данном адсорбенте.
В распределительной хроматографии разделение основано на различии в растворимости сорбатов в подвижной и неподвижной фазах или на различии в стабильности образующихся комплексов.
В ионообменной хроматографии разделение основано на различии констант ионообменного равновесия.
В осадочной хроматографии разделение основано на различной растворимости осадков в подвижной фазе.
Аффинная хроматография основана на биоспецифическом взаимодействии компонентов с аффинным лигандом.
В эксклюзионной хроматографии разделение основано на различии и проницаемости молекул разделяемых веществ в неподвижную фазу. Компоненты элюируются в порядке уменьшения их молекулярной массы.
По технике выполнения (характеру процесса) различают:
колоночную хроматографию (неподвижная фаза находится в колонке); плоскостную (планарную) — бумажную и тонкослойную (неподвижная фаза — лист бумаги или тонкий слой сорбента на стеклянной или металлической пластинке); капиллярную хроматографию (разделение происходит в пленке жидкости или слое сорбента, размещенном на внутренней стенке трубки); хроматографию в полях (электрических, магнитных, центробежных и других сил).
По цели хроматографирования:
Аналитическая хроматография предназначена для определения качественного и количественного состава исследуемой смеси.
Неаналитическая хроматография — метод исследования физико-химических характеристик веществ при использовании хроматографической аппаратуры и на основании параметров хроматографических зон.
Препаративная хроматография применяется для выделения небольших количеств чистых компонентов (или смесей) в лабораторных условиях.
Промышленная хроматография используется для получения чистых веществ в значительных количествах.
