
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
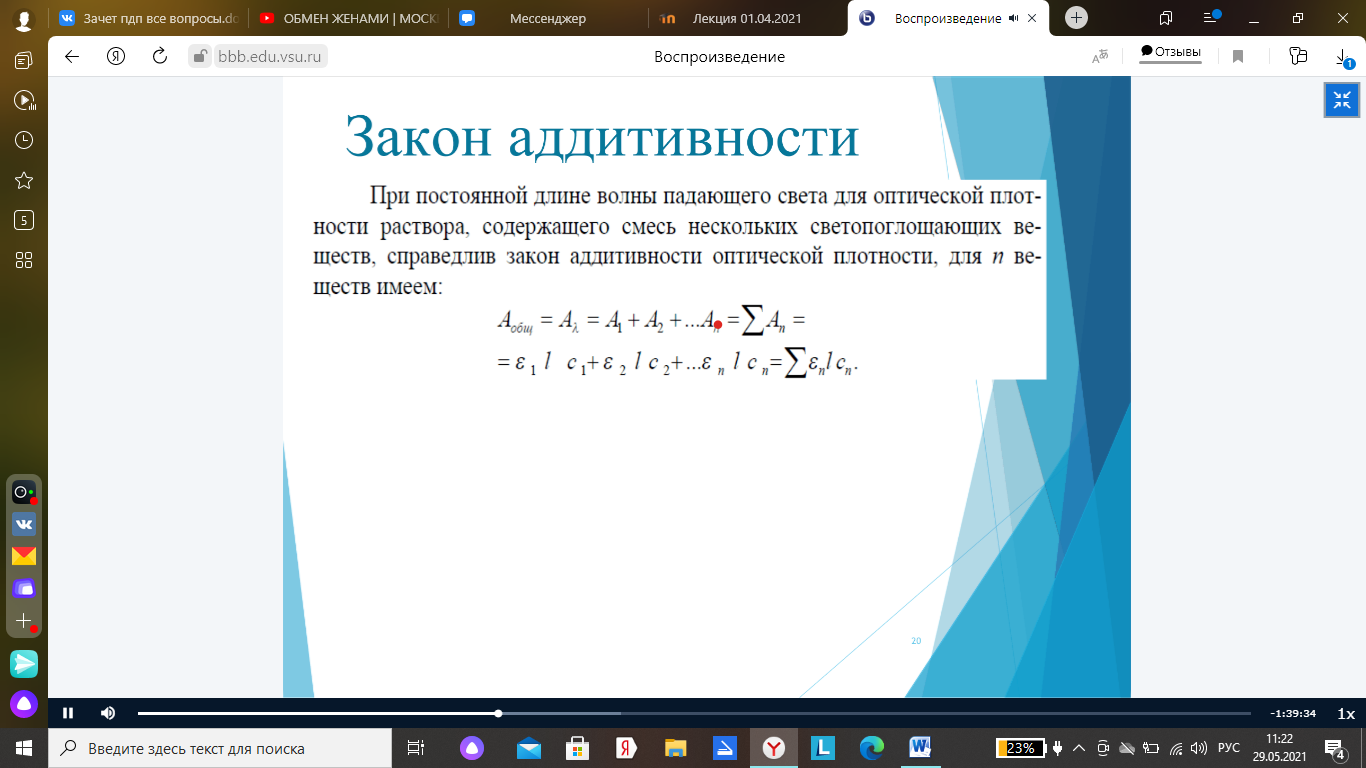
- •47. Аддитивность оптической плотности.
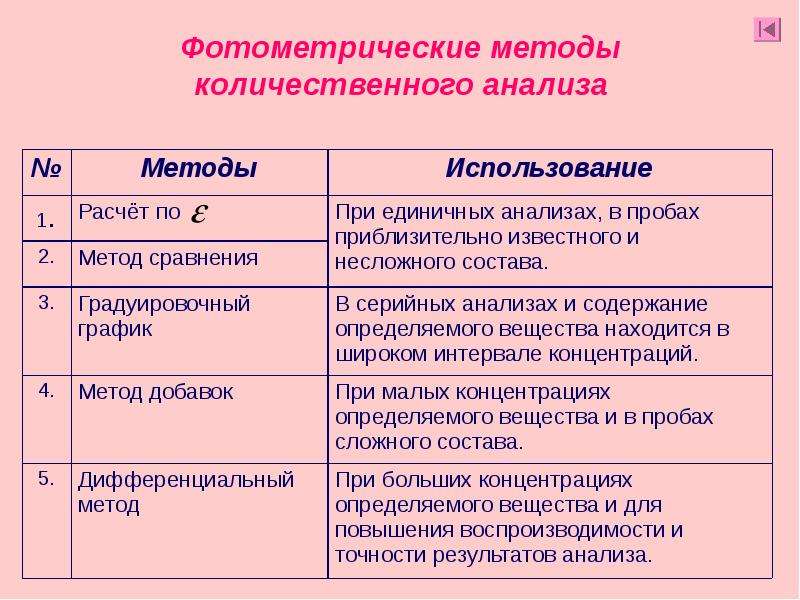
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
47. Аддитивность оптической плотности.
48. Приемы количественного фотометрического анализа.
49. Количественный фотометрический анализ смеси светопоглощающих веществ.
Для колич-ого анализа фотометрия используется широко. В большинстве случаев колич. фотометр. анализ основан на переводе определенного компонента в соединение, кот поглощает УФ или дневной свет. При этом измеряют оптич плотность или коэф-т пропускания(поглощ-ия) этого р-ра на длине волны, кот соответствуют мах поглощения (пропускания).
Так как оптич плотность Д анализ-го р-ра связана с его концентр-ей законом Бугера-Ламберта-Бера:
Д=ελ*с*l1 где ελ – молек-ый коэф-т поглощ-ия (л/моль*см), l- толщина слоя(кюветы) (см)
Таким обр располагая оптич плотностью Д, ελ, l легко определить конц-цию. Из выше формулы видно, что при постоянной толщине слоя р-ра (l) завис-ть между Д и с прямопропорц-а. Следует отметить, что в реальности с-мах это пропорц-сть не соблюдается, поэтому при проведении колич. анализа всегда проводят проверку соблюдения закона светопоглощения.
Приборы для фотометрического анализа
Для проведения фотометр. анализа применяют фотоэлектрокалориметры и спектрофотометры. Каждые из этих приборов состоят из:
1. Источника излучения 2. Устрой-ва для выделения необходимого интервала длин волн(монохроматоры у спектрофотометра и светофильтры у фотоэлектрометра) 3. Кюветного отделения 4. Детектора 5. Преобразователя сигнала 6. Индикатора сигнала(шкала либо цифровой счетчик).
В кач-ве 1 применяют: лампы накаливания с вольфрамовой нитью, гомогенокварцевая лампа. В фотометрии обычно измеряется не абсолютное значение оптич. плотности исследуемого р-ра, а разность оптич плотностей исследуемого р-ра и р-ра сравнения, оптич плотность кот-го принята за 0. Кювету в кот помещен исследуемый р-р назыв рабочей, а кювету, в кот помещен р-р сравнения – кюветой сравнения. Эти обе кюветы должны быть идентичны по светопоглощению. В кач-ве приемников излучения примен фотоэлементы или фотоумножители.
Применение фотометрии.
По своей применяемости в практике заводских, контролирующих и исследовательских лабораториях фотометрия явл-тся самым распространенным методом.
Достоинства метода: 1. Доступность, дешевизна, простота работы и обслуживания. 2. Точность анализа 1-2%. Экспрессность метода, не требует высокой квалификации персонала 3. Обладает высокой универсальностью и избирательностью.
Фотометрия используется для колич-го определения продуктов питания: белков, сахара, жиров, нитратов, нитритов и токсичных элементов.
50. Метод дифференциальной фотометрии.
Дифференциальные методы анализа применяют для определения высоких содержаний определяемых компонентов в пробах анализируемых веществ, для устранения мешающего влияния сопутствующих компонентов. Этот метод применяют еще и в тех случаях, когда из-за большой концентрации определяемого компонента нарушается закон Бугера - Ламберта - Бера, или когда значение оптической плотности выходит за границы шкалы прибора, а дальнейшее разбавление раствора нежелательно.
Метод дифференциальной фотометриииспользуется для снижения погрешности измерения в области больших и малых значений оптической плотности А (в области высокой инструментальной погрешности фотометров с фотоэлементом).
В этом методе, в отличии от фотометрии оптические плотности раствора анализируемого вещества и градуировочных растворов измеряют не по отношению к растворителю или раствору сравнения с нулевым поглощением, а по отношению к раствору с известной концентрацией определяемого компонента Со.
В зависимости от способов измерения относительной оптической плотности различают несколько вариантов метода.
1. Вариант высокого поглощения,то естьслучай, когда оптическая плотность растворов больше единицы. Готовят раствор сравнения, в котором концентрация определяемого компонента меньше, чем его концентрации в растворе анализируемого вещества (Со < Сх). Готовят серию градуировочных растворов определяемого компонента с концентрациями С1, С2 K Сn. Фотометрируют градуировочные раствора определяемого компонента и раствор анализируемого вещества по отношению к раствору сравнения с концентрацией Со. Значения относительной оптической плотности А¢представляют собой разность оптических плотностей анализируемого (градуировочного) раствора и раствора сравнения. Концентрацию определяемого компонента в растворе анализируемого вещества определяют расчетным способом или по градуировочному графику.
При расчетном способе находят значение СХ по формуле:
![]() (3)
(3)
2. Вариант низкого поглощения,то естьслучай, когда оптическая плотность растворов < 0,1. Готовят раствор сравнения, в котором концентрация определяемого компонента больше, чем его концентрации в растворе анализируемого вещества (Со > Сх). Готовят серию градуировочных растворов определяемого компонента с концентрациями С1, С2 K Сn. В этом случае применяют обратный порядок измерения: раствор анализируемого вещества и градуировочные растворы условно принимают за растворы сравнения и по отношению к ним измеряют оптическую плотность изначального раствора сравнения. Значение СХ находят по формуле (3), в которой перед вторым слагаемым стоит знак «-».
3. Способ двухстороннего дифференцирования(способ достижения предельной точности) сочетает в себе оба способа с прямым и обратным порядком измерения оптической плотности растворов. При работе этим способом готовят несколько градуировочных растворов с концентрациями определяемого компонента, меньшими, чем в растворе сравнения, и столько же градуировочных растворов с концентрациями определяемого компонента, большими, чем в растворе сравнения.
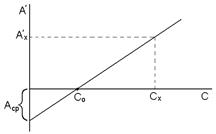
Рис. 9.8. Градуировочный график в способе двухсторонней дифференциальной фотометрии
Если С > Со, используют прямой порядок измерения, если С < Со –обратный, и значения относительных оптических плотностей берут со знаком минус. Градуировочный график при этом не проходит через начало координат, а пересекает ось абсцисс в точке, соответствующей концентрации раствора сравнения Со (рис.9.8).
Из графика видно, что при концентрации раствора сравнения Со = 0 дифференциальный метод превращается в метод прямой фотометрии.
Точность определения при использовании дифференциального метода повышается.
