
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
1.Предмет и задачи АХ. Этапы исторического развития. АХ — наука о способах идентификации химических соединений, о принципах и методах определения химического состава веществ и их химической структуры. Аналит. химия составляет научную основу хим. состава. Химический состав — элементный, молекулярный, фазовый, изотопный состав. Иногда можно отследить пространственное расположение атомов в молекуле. Химический анализ незаменим в медицинской диагностике, биотехнологии, фармации, добыче полезных ископаемых и т.д.
Задачи АХ: 1. Разработка методов анализа. 2. Разработка теоретических основ этих методов. 3. Установление границ применимости этих методов. 4. Оценка метрологических характеристик методов. Аналитическая служба — сервисная система методов, обеспечивающая конкретный анализ определенных объектов, но только с использованием тех методов, которые реализует АХ.
Функции АХ: 1. Решение общих вопросов анализа (развитие его метрологии). 2. Разработка аналитических методов. 3. Решение конкретных задач анализа (например, создание АМ для определения наркотических веществ). Наука может развиваться по-разному. Главная цель — польза и практичность.
Этапы развития АХ: I. Первое упоминание Р. Бойль 1661г. «Химический анализ» книга «Химик-скептик» До этого аналитические исследования проводились в древности. II. Химические методы анализа на научной основе 18- первая половина 19 вв. Работы Бермана, Телмара по качественному анализу. Гей-Люссака - по элементному анализу
Либих- объемный анализ
по газовому анализу — Бунзена. Ломоносов применяет аналитические весы. Публикует закон сохранения массы. Берцелиус — исследование реакций в растворе. III. Плодотворный период вторая половина 19 в. Появление физических и физико-химических методов анализа Бунзен, Кирхгоф (диаграмма состав-свойства) Чугаев — комплексные соединения (реактив Чугаева) 1869г — периодический закон Менделеева Учение Бутлерова о строении органических соединений. Первый учебник по АХ Меншуткина. IV. 20в. Методы, основанные на радиоактивности. Рентгеновские методы. Полярография. Хроматография. V. Послевоенные годы. Атомно-адсорбционный метод анализа. Газовая хроматография. Анализ минерального сырья, металлов, объектов окружающей среды, космических объектов. VI. Рубеж 20 и 21в. «Информационная эра» Накопление и анализ информации. Сенсорные и тестовые методы анализа.
2. Методы АХ и их классификация. Методы АХ и их классификация: 1.В зависимости от цели методы делятся на количественные и качественные. 2. В зависимости от средств и методов
- Методы разделения: экстракция, осаждение, соосаждение, хроматография, дистилляция, электродиализ
- Методы определения:
Химические: титриметрия, гравиметрия
Физико-химические: электро-химические, фотометрические, люминисцентные
Физические: ядерно-резонансные, спектроскопия 3. Классификация может основываться на V или m пробы: -макрометоды 0,1г и более
полумикрометоды 0,1-0,01г
микрометоды 0,01-10-3 г
ультрамикрометоды 10-6г
субмикрометоды 10-9г
4. По объектам анализа : органические и неорганические
5. Методы определения делятся на химические и инструментальные методы анализа.
6. По объектам анализа химический анализ подразделяют на:
• Технический (руды, металлы, техническое сырье)
• Сельскохозяйственный (корма, почва, удобрения)
• Пищевой (продукты питания)
• Биохимический (кровь, моча, желудочный сок, желчь)
• Токсикологический (растительные и животные объекты)
• Судебно-химический (выделения, органы людей)
• Санитарно-химический (воздух, вода, почва)
• Фармацевтический (лекарства, лекарственное сырье).
3. Общая схема аналитического определения 1. Усреднение пробы и взятие навески. Проба должна быть представительной, т.е. должна отражать средний состав анализируемого материала. Существуют специальные методики по равномерному отбору проб из всех зон по всему объему материала. Измельчение и отбор средней пробы методом квартования или с помощью автоматических пробоотборников. Пробу взвешивают на аналитических весах с точностью до 10-4. 2. Разложение (вскрытие) пробы Растворение или сплавление с особыми сплавами. Все компоненты пробы приводят в растворимое состояние и не допускают их потерь. 3. Разделение и концентрирование Метод разделения выбирают в зависимости от свойств определяемого соединения. 4. Количественное измерение определяют интенсивность аналитического сигнала — числовое значение свойства системы, связанного с содержанием анализируемого компонента. P=f(c) P — интенсивность аналитического сигнала с — концентрация. 5. Расчеты результатов измерения Включает также оценку погрешности анализа.
4. Активность, коэффициент активности, ионная сила раствора.
Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
 а
–активность; Y
– коэффициент активности; с – концентрация
а
–активность; Y
– коэффициент активности; с – концентрация
Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
В разбавленных растворах (I ≤ 10-2) коэффициент активности можно рассчитать по закону Дебая-Хюккеля:

Постоянная А зависит от температуры, свойств растворителя. Для водных растворов А=0,509.
При средних концентрациях раствора (I=0.5-0.8) коэффициент активности можно рассчитать по уравнению Дэвиса:

Экспериментально определяется лишь средний ионный коэффициент активности
( , - стехиометрические коэффициенты в формуле электролита)

Мерой электростатического взаимодействия ионов в растворе служит ионная сила раствора:
I 1/ 2Ci Z2i
5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
1.
Для химически обратимой реакции типа
aA
+ bB
↔ cC
+ dD
основной характеристикой равновесия
является термодинамическая
константа равновесия
(КТ)
 при Т, Р = const
КТ определяет
направление и глубину реакции.
КТ
применяют при условии, что поведение
веществ не осложнено электростатическими
взаимодействиями и конкурирующими
реакциями.
КТ не зависит от С, а
зависит только от Т и Р.
при Т, Р = const
КТ определяет
направление и глубину реакции.
КТ
применяют при условии, что поведение
веществ не осложнено электростатическими
взаимодействиями и конкурирующими
реакциями.
КТ не зависит от С, а
зависит только от Т и Р.
2.
Реальная (концентрационная) константа
равновесия.
Если отличия от идеального раствора
обусловлены только электростатическими
взаимодействиями, то равновесие
характеризуется реальной константой
равновесия,
которая выражается
через равновесные концентрации.
 при Т, Р = const.
Между активностью и
равновесной концентрацией есть
зависимость
аА = γА * [A]
Если в
реакции нет электростатических
взаимодействий, то
γА = 1, аА = [A] —
идеальные растворы или очень маленькие
С.
γi — коэффициент активности,
характеризующий степень отклонения
системы
от идеальной за счет
электростатических взаимодействий.
Величина γi зависит от заряда иона Zi и
ионной силы раствора (μ), создаваемой
всеми ионами
при Т, Р = const.
Между активностью и
равновесной концентрацией есть
зависимость
аА = γА * [A]
Если в
реакции нет электростатических
взаимодействий, то
γА = 1, аА = [A] —
идеальные растворы или очень маленькие
С.
γi — коэффициент активности,
характеризующий степень отклонения
системы
от идеальной за счет
электростатических взаимодействий.
Величина γi зависит от заряда иона Zi и
ионной силы раствора (μ), создаваемой
всеми ионами
 Коэффициент
активности рассчитывается по формулам
Дебая-Хюккеля.
Коэффициент
активности рассчитывается по формулам
Дебая-Хюккеля.
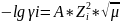 при μ < 10-2
при μ < 10-2
 при μ < 10-1
При больших концентрациях
ионы не могут рассматриваться как
точечные заряды.
Для водных растворах
А=0,509
при μ < 10-1
При больших концентрациях
ионы не могут рассматриваться как
точечные заряды.
Для водных растворах
А=0,509
 μ >10-1
Как правило определяют
усредненный коэффициент активности
μ >10-1
Как правило определяют
усредненный коэффициент активности
 при μ < 10-2
при μ < 10-2

3.
Условная константа равновесия
Применяется,
если в системе посторонние ионы способны
вступать в
конкурирующие реакции с
веществами с образованием малорастворимых
соединений.
 Выражается через общие аналитические
концентрации.
Равновесная концентрация
связана с общей аналитической
[A] = αA
* CA
Если конкурирующих реакций нет,
то
[A] = CA αA = 1
αA — коэффициент
пропорциональности (мольная доля).
Характеризует глубину протекания
конкурентной реакции.
Влияние Т на
константу равновесия выражается изобарой
химической реакции:
Выражается через общие аналитические
концентрации.
Равновесная концентрация
связана с общей аналитической
[A] = αA
* CA
Если конкурирующих реакций нет,
то
[A] = CA αA = 1
αA — коэффициент
пропорциональности (мольная доля).
Характеризует глубину протекания
конкурентной реакции.
Влияние Т на
константу равновесия выражается изобарой
химической реакции:
 при P = const
ΔH — тепловой эффект
реакции
Т — абсолютная температура
R
— универсальная газовая постоянная.
Уравнение
изобары показывает, что в зависимости
от знака теплового эффекта КР
может
увеличиваться, проходить через максимум
и снова уменьшаться.
при P = const
ΔH — тепловой эффект
реакции
Т — абсолютная температура
R
— универсальная газовая постоянная.
Уравнение
изобары показывает, что в зависимости
от знака теплового эффекта КР
может
увеличиваться, проходить через максимум
и снова уменьшаться.
