
- •Введение
- •1. Термодинамика
- •1.1. Молекулярно-кинетическая теория и термодинамика
- •1.2. Масса и размеры молекул
- •1.3. Состояние системы. Процесс
- •1.4. Внутренняя энергия системы
- •1.5. Первое начало термодинамики
- •1.6. Работа, совершаемая телом при изменении объема
- •1.7. Температура
- •1.8. Уравнение состояния идеального газа
- •1.9. Внутренняя энергия и теплоемкость идеального газа
- •1.10. Уравнение адиабаты идеального газа
- •1.11. Политропические процессы
- •1.12. Работа, совершаемая идеальным газом при различных процессах
- •1.13. Скорость звука в газах
- •1.15. Эффект Джоуля-Томсона
- •1.16. Равновесие жидкости и насыщенного пара
- •1.17. Критическое состояние
- •1.18. Пересыщенный пар и перегретая жидкость
- •1.19. Энтропия как функция состояния. Энтропия идеального газа
- •1.20. Макро- и микросостояния. Статистический вес
- •1.21. Связь энтропии со статистическим весом. Свойства энтропии
- •1.22. Основные законы термодинамики
- •1.23. Цикл Карно
- •1.24. Фазы в термодинамике
- •1.25. Уравнение Клапейрона—Клаузиуса
- •1.26. Тройная точка. Диаграмма состояния
- •1.27. Термодинамические потенциалы
- •1.28. Химический потенциал
- •1.29. Классификация фазовых переходов по Эренфесту
1.18. Пересыщенный пар и перегретая жидкость
В п. 1.14 приведено уравнение (1.68), предложенное Ван-дер-Ваальсом для описания состояния газов при больших плотностях. На рис. 1.14 изображены изотермы Ван-дер-Ваальса, т.е. кривые, описываемые уравнением (1.68), для нескольких температур.
Характерным
для изотерм является то, что для
температур, не превышающих значение
Ткр,
у кривых имеется S-образный
завиток, в области которого зад
Рис.1.14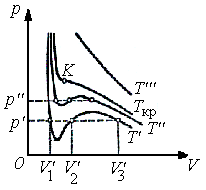
О
Рис.1.15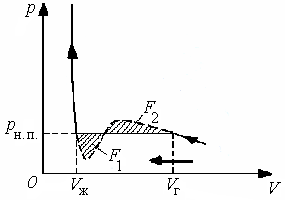
Расслоение
на 2 фазы объясняется неустойчивостью
однородных состояний, отвечающих завитку
1-2-3-4 (рис.1.16). Неустойчивость состояний
на участке 2-3 становится очевидной, если
учесть, что на этом участке производная
![]() положительна. Следовательно, вещество,
способное пройти последовательность
состояний 2-3, обладало бы совершенно
противоестественными свойствами:
увеличение объема газа сопровождалось
бы не уменьшением, а ростом давления.
положительна. Следовательно, вещество,
способное пройти последовательность
состояний 2-3, обладало бы совершенно
противоестественными свойствами:
увеличение объема газа сопровождалось
бы не уменьшением, а ростом давления.
На
участках 1-2, 3-4 производная
![]() отрицательна,
так что, казалось бы, эти участки могли
бы реализоваться. Действительно, при
известных условиях состояния,
соответствующие этим участкам, могут
осуществляться. Правда, они не вполне
устойчивы; достаточно, например, в
состоянииА
попадания в пар пылинки, чтобы всё
вещество распалось на две фазы и перешло
в состояние В.
Подобные не вполне устойчивые состояния
называются метастабильными.
Вещество в состояниях 1-2 называется
перегретой
жидкостью,
вещество в состояниях 3-4 называется
пересыщенным
паром.
При достаточно низких температурах
нижняя часть завитка изотермы
Ван-дер-Ваальса пересекает ось V
и переходит в область отрицательных
давлений. Вещество под отрицательным
давлением, очевидно, находится в состоянии
не сжатия, а растяжения. Такие состояния
также могут быть при известных условиях
реализованы. Таким образом, участок 5-6
на нижней изотерме соответствует
перегретой, а участок 6-7 – растянутой
жидкости.
отрицательна,
так что, казалось бы, эти участки могли
бы реализоваться. Действительно, при
известных условиях состояния,
соответствующие этим участкам, могут
осуществляться. Правда, они не вполне
устойчивы; достаточно, например, в
состоянииА
попадания в пар пылинки, чтобы всё
вещество распалось на две фазы и перешло
в состояние В.
Подобные не вполне устойчивые состояния
называются метастабильными.
Вещество в состояниях 1-2 называется
перегретой
жидкостью,
вещество в состояниях 3-4 называется
пересыщенным
паром.
При достаточно низких температурах
нижняя часть завитка изотермы
Ван-дер-Ваальса пересекает ось V
и переходит в область отрицательных
давлений. Вещество под отрицательным
давлением, очевидно, находится в состоянии
не сжатия, а растяжения. Такие состояния
также могут быть при известных условиях
реализованы. Таким образом, участок 5-6
на нижней изотерме соответствует
перегретой, а участок 6-7 – растянутой
жидкости.
Р ассмотрим
условия, при которых могут быть
осуществлены метастабильные состояния.
Начнем с пересыщенного пара. Если пар
совершенно не содержит посторонних
включений, конденсация его в жидкость
начаться не может. Для образования
капельки необходимо, чтобы большое
количество молекул одновременно
сблизились на расстояния того же порядка,
что и расстояние между молекулами в
жидкости, а это совершенно невероятно.
Для возникновения конденсации необходимо
наличие так называемых центров
конденсации, которые улавливают
подлетающие к ним молекулы и переводят
их в конденсированную фазу. Центрами
конденсации могут служить пылинки,
капельки жидкости и, особенно, заряженные
частицы (ионы).
ассмотрим
условия, при которых могут быть
осуществлены метастабильные состояния.
Начнем с пересыщенного пара. Если пар
совершенно не содержит посторонних
включений, конденсация его в жидкость
начаться не может. Для образования
капельки необходимо, чтобы большое
количество молекул одновременно
сблизились на расстояния того же порядка,
что и расстояние между молекулами в
жидкости, а это совершенно невероятно.
Для возникновения конденсации необходимо
наличие так называемых центров
конденсации, которые улавливают
подлетающие к ним молекулы и переводят
их в конденсированную фазу. Центрами
конденсации могут служить пылинки,
капельки жидкости и, особенно, заряженные
частицы (ионы).
Таким образом, если пар тщательно очистить от посторонних включений и ионов, то он может находиться при давлении, превышающем давление насыщенных паров при данной температуре. Такое состояние будет метастабильным: достаточно возникнуть хотя бы одному центру конденсации, как состояние пересыщенного пара будет нарушено и вещество перейдет в двухфазное состояние.
Практически пересыщенный пар можно получить, подвергнув непересыщенный пар резкому расширению. Быстрое расширение происходит без теплообмена с внешней средой и сопровождается охлаждением пара. Точка, изображающая состояние пара, перемещается при этом по адиабате. Адиабата, как было показано в п. 1.10, идет круче, чем изотерма, вследствие чего пар нестабильного состояния 1, соответствующего температуре Т1 (рис. 1.17), может перейти в метастабильное состояние 2, соответствующее более низкой температуре Т2. Такой процесс используется в камере Вильсона — приборе, предназначенном для наблюдения следов заряженных частиц (например, α-частиц). Содержащийся в камере Вильсона воздух, насыщенный парами воды или спирта, подвергается резкому расширению. В результате воздух охлаждается, и пары оказываются в состоянии пересыщения. Влетевшая в камеру частица вызывает ионизацию молекул на своем пути. Пересыщенный пар конденсируется на возникших ионах в мелкие капельки, образуя хорошо видимый след.
Рассмотрим условия получения перегретой жидкости. Процесс бурного парообразования (т. е. кипения) может, как и процесс конденсации, происходить на инородных включениях, например на песчинках или пузырьках газа, растворённого в жидкости. Если жидкость тщательно очистить от твердых включений и растворенных в ней газов, то путем нагревания ее можно перевести в состояние с давлением, меньшим рн.п при данной температуре, без того, чтобы жидкость вскипала. Это и будет состояние перегретой жидкости.
Состояние перегретой жидкости является метастабильным. Достаточно бросить в перегретую жидкость песчинку для того, чтобы жидкость вскипела, и вещество перешло в стабильное двухфазное состояние (см. переход С—D на рис. 1.16).
Растянутую жидкость, например ртуть, можно получить следующим образом. Если погрузить в ртуть запаянную с одного конца длинную стеклянную трубку и, повернув ее запаянным концом вверх, осторожно вытаскивать наружу, то в такой трубке можно получить столб ртути, значительно превышающий 760 мм. Следовательно, ртуть в трубке будет удерживаться не силой атмосферного давления, а имеющимся между молекулами сцеплением. Ртуть в трубке будет находиться в состоянии растяжения, т. е. под отрицательным давлением.
