
- •Модуль 2. Молекулярная физика Лекция 1
- •2.1. Статистический и термодинамический методы описания свойств
- •Макроскопических систем
- •2.2. Функции распределения
- •2.2.1. Общий подход
- •2.2.2. Функция распределения молекул идеального газа по модулю скорости молекул
- •2.2.3. График функции распределения молекул идеального газа по модулю скорости для двух температур
- •2.2.4. Функция распределения молекул идеального газа по кинетическим энергиям поступательного движения молекул
- •2.2.5. Средние характеристики молекул
- •Лекция 2
- •2.3. Основное уравнение мкт идеального газа для давления
- •2.4. Молекулярно-кинетический смысл температуры
- •2.5. Распределение Больцмана
- •2.5.1. Функция распределения Больцмана
- •2.5.2. Барометрическая формула
- •*2.7. Экспериментальная проверка распределения молекул по модулю скорости. Опыт Ламмерта
- •*2.8. Опыты Перрена по определению постоянной Авогадро
- •2.9. Основные понятия равновесной термодинамики
- •Лекция 3
- •2.10. Внутренняя энергия системы, работа, теплообмен
- •2.10.1. Внутренняя энергия системы
- •2.10.2. Работа
- •2.10.3. Теплообмен, теплоемкость системы
- •2.11. Первый закон (начало) термодинамики
- •2.12. Второе начало (закон) термодинамики. Термодинамические формулировки
- •2.13. Энтропия в термодинамике
- •Лекция 4
- •2.14. Качественный пример изменения энтропии при неравновесном процессе
- •2.15. Коэффициент полезного действия (кпд) идеального теплового двигателя
- •2.16. Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы. Теплоемкость идеального газа
- •2. Молекула, состоящая из двух атомов
- •2.17. Применение первого и второго закона термодинамики к изопроцессам в идеальном газе
- •Лекция 5 *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
- •2.19. Термодинамическая вероятность. Статистический смысл понятия энтропии.
- •2.20. Оценка термодинамической вероятности неравновесного и равновесного состояний.
- •Лекция 6
- •2.23. Основы физической кинетики
- •2.23.1. Уравнения для явлений переноса. Линейная неравновесная термодинамика
- •2.23.2. Формулы для коэффициентов переноса в случае идеального газа
- •2. Формулы для коэффициентов переноса
- •2.23.3. Зависимость коэффициентов переноса от параметров состояния идеального газа при протекании различных изопроцессов в идеальном газе
- •Лекция 7
- •2.24. Реальные газы. Уравнение Ван – дер - Ваальса
- •2.25. Экспериментальные и теоретические изотермы для реальных газов. Критическая точка
- •2.26. Внутренняя энергия реального газа
- •2.27. Жидкое состояние. Строение жидкости
2.17. Применение первого и второго закона термодинамики к изопроцессам в идеальном газе
Запишем, прежде всего, формулы, которые будут использоваться при рассмотрении изопроцессов в идеальном газе.
![]() ,
,
![]() ,
,![]() ,
,![]() ,
(2.57а)
,
(2.57а)
![]() ,
,
![]() ,
,![]() .
(2.57б)
.
(2.57б)
К этим формулам добавлено уравнение состояния идеального газа (2.37) - уравнение Менделеева – Клапейрона.
1.1.
Изотермический процесс
(![]() ).
Уравнение процесса:
).
Уравнение процесса:![]() .
.
![]() ,
,![]() ,
,![]() ,
,![]() ,
(2.58а)
,
(2.58а)
![]() ,
,
![]() .
(2.58б)
.
(2.58б)
Отметим, что молярная теплоемкость при этом процессе равна бесконечности, так как любой подвод тепла идет на совершение газом работы и при этом температура системы не изменяется.
1.2.
Изохорический процесс (![]() ).
Уравнение процесса:
).
Уравнение процесса:![]() .
.
![]() ,
,
![]() ,
,![]() ,
,![]() ,
(2.59а)
,
(2.59а)
![]() ,
(2.59б)
,
(2.59б)
![]() .
(2.59в)
.
(2.59в)
1.3.
Изобарический процесс (![]() ).
Уравнение процесса:
).
Уравнение процесса:![]() .
.
![]() ,
,
![]() ,
,![]() ,
(2.60а)
,
(2.60а)
![]() ,
(2.60б)
,
(2.60б)
![]() ,
(2.60в)
,
(2.60в)
![]() .
(2.60г)
.
(2.60г)
Отметим,
что разность теплоемкостей
![]() и
и![]()
![]() для идеального газа равна
для идеального газа равна
![]() .
(2.61)
.
(2.61)
Это уравнение (2.61) получило название уравнения Майера.
1.4.
Адиабатический процесс (изоэнтропийный
процесс,
![]() )
- это процесс, происходящий в системе
без теплообмена с внешними телами, или
это изоэнтропийный процесс, при его
протекании энтропия системы не изменяется.
)
- это процесс, происходящий в системе
без теплообмена с внешними телами, или
это изоэнтропийный процесс, при его
протекании энтропия системы не изменяется.
![]() ,
,
![]() ,
,![]() ,
,![]() ,
(2.62а)
,
(2.62а)
![]() ,
,
![]() .
(2.62б)
.
(2.62б)
Выведем формулу уравнения адиабатического процесса
![]()
![]()
![]()
Итак,
уравнение адиабаты в параметрах состояния
(![]() )
принимает вид:
)
принимает вид:
![]() ,
(2.63а)
,
(2.63а)
а для других параметров идеального газа запишется таким образом:
![]() .
(2.63б)
.
(2.63б)
При
выводе был введен коэффициент Пуассона
![]() ,
который равен отношению молярной
теплоемкости идеального газа при
постоянном давлении к молярной
теплоемкости газа при постоянном объеме
,
который равен отношению молярной
теплоемкости идеального газа при
постоянном давлении к молярной
теплоемкости газа при постоянном объеме
![]() ,
(2.64)
,
(2.64)
причем он выражается через число степеней свободы молекулы идеального газа.
В
координатах (![]() )
адиабата изменяется более резко, чем
изотерма, так как коэффициент Пуассона
)
адиабата изменяется более резко, чем
изотерма, так как коэффициент Пуассона![]() больше единицы (
больше единицы (![]() ,
рис. 2.13,а).
,
рис. 2.13,а).
Использование уравнения адиабаты помимо формулы (2.62,а) позволяет получить следующую формулу для работы идеального газа при адиабатическом процессе:
 .
(2.65)
.
(2.65)
Лекция 5 *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
Если
необходимо рассчитать изменение энтропии
произвольного н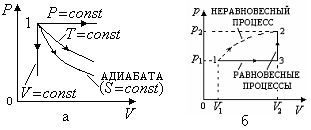 еравновесного
процесса перехода системы (идеальный
газ) из одного состояния (параметры
состояния
еравновесного
процесса перехода системы (идеальный
газ) из одного состояния (параметры
состояния![]() )
в другое (параметры состояния
)
в другое (параметры состояния![]() ),
необходимо использовать тот факт, что
энтропия является функцией состояния
системы, и рассчитать
),
необходимо использовать тот факт, что
энтропия является функцией состояния
системы, и рассчитать
Рис. 2.13 изменение энтропии для
равновесного
процесса перехода. Этот процесс наиболее
удобен, так как состоит из нескольких
изопроцессов (например, изобарический
1-3, и изохорический 3-2, рис. 2.13,б), что
позволяет использовать формулы,
приведенные в п. 2.2.4 пункт 1 (![]() ,)
,)
![]() .
(2.66)
.
(2.66)
Как видно, в расчетную формулу (2.66) входят только параметры начального и конечного состояний.
Если
в процессе теплообмена системы с внешними
телами происходит нагревание (охлаждение),
плавление (кристаллизация) вещества,
превращение жидкости в пар (или
конденсация), то необходимое для расчета
изменение энтропии
![]() и количество теплоты
и количество теплоты![]() рассчитываются по формулам (2.39), (2.40).
рассчитываются по формулам (2.39), (2.40).
В
качестве примера рассмотрим процесс,
происходящий в системе за счет теплообмена
с внешними телами, процесс нагревания
льда массы
![]() от температуры
от температуры![]() (
(![]() )
до температуры
)
до температуры![]() (
(![]() при
этой температуре лед превращается в
воду). Тогда для расчета изменения
энтропии системы мы используем равновесные
процессы и рассчитываем
при
этой температуре лед превращается в
воду). Тогда для расчета изменения
энтропии системы мы используем равновесные
процессы и рассчитываем![]() следующим образом:
следующим образом:
![]()
 .
(2.67)
.
(2.67)
