
- •Федеральное агенство по образованию Российской Федерации
- •Оглавление
- •1. Электронное строение атомов
- •1.1. Квантово-механическая модель электронного строения атома
- •1.2. Основные закономерности распределения электронов в атомах
- •1.3. Электронные формулы атомов. Периодическая система д.И.Менделеева
- •2. Классы неорганических соединений
- •2.1. Оксиды, гидроксиды, соли
- •2.2. Некоторые свойства неорганических соединений Свойства оксидов и гидроксидов
- •Свойства солей
- •3. Энергетика химических реакций
- •3.1. Основные понятия
- •3.2. Энтальпии химических реакций
- •3.3. Закон Гесса. Следствие закона Гесса
- •3.4. Энтропия
- •3.5. Возможность самопроизвольного прохождения химических реакций. Энергия Гиббса
- •4. Химическая кинетика. Химическое равновесие
- •4.1. Скорость химических реакций
- •4.2. Химическое равновесие
- •Выражение константы равновесия имеет вид
- •4.3. Принцип Ле Шателье
- •5. Растворы
- •5.1. Основные понятия
- •5.2. Растворы электролитов. Электролитическая диссоциация
- •5.3. Ионные реакции в растворах электролитов
- •5.4. Диссоциация воды. Водородный показатель
- •5.5. Гидролиз солей
- •Гидролиз солей слабых кислот и сильных оснований. Гидролиз NaNo2.
- •Гидролиз солей слабых оснований и сильных кислот.
- •Гидролиз солей слабых оснований и слабых кислот.
- •Совместный гидролиз солей.
- •6. Окислительно - восстановительные реакции
- •6.1. Основные понятия
- •6.2. Составление уравнений овр
- •6.3. Электродные потенциалы. Направление овр
- •6.4. Химические источники тока
4. Химическая кинетика. Химическое равновесие
4.1. Скорость химических реакций
Скорости и механизмы химических процессов, а также факторы, влияющие на них, изучает химическая кинетика.
Существуют гомогенные (однофазные) и гетерогенные (многофазные) системы, соответственно называют и реакции, происходящие в таких системах.
Скорость химической реакции - число элементарных актов реакции в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности фаз (для гетерогенных реакций). О скорости реакции можно судить по изменению количества реагирующих веществ или продуктов реакции.
Скорость химических реакций зависит от многих факторов: природы реагирующих веществ, концентрации, давления, степени дисперсности (измельчения) твёрдых веществ, температуры, присутствия катализатора.
Математическую зависимость скорости реакции от концентрации
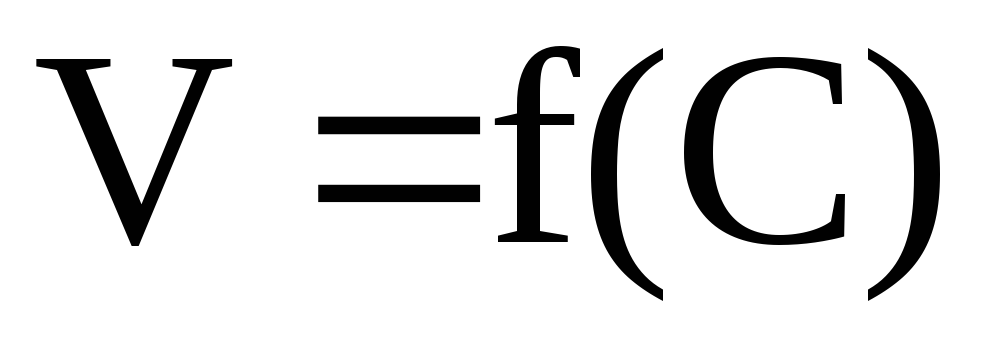 ,
называемуюкинетическим
уравнением,
устанавливают экспериментально.
,
называемуюкинетическим
уравнением,
устанавливают экспериментально.
Для немногочисленных реакций – элементарных, т.е. идущих в одну стадию, зависимость скорости элементарных химических реакций от концентрации подчиняется закону действующих масс:
скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведённых в степени, равные стехиометрическим коэффициентам.
Например,
элементарной реакции 2NO
+ O2
= 2NO2
cоответствует
кинетическое уравнение
![]() .
В этом уравнении
.
В этом уравнении![]() и
и![]() – молярные
концентрации веществ (см. с. 16),
– молярные
концентрации веществ (см. с. 16),
![]() - константа скорости химической реакции,
она численно равна скорости реакции
при условии, что концентрации реагирующих
веществ постоянны и равны единице.
- константа скорости химической реакции,
она численно равна скорости реакции
при условии, что концентрации реагирующих
веществ постоянны и равны единице.
Если в реакции участвуют газы, то вместо концентраций можно использовать их парциальные давления.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа:
при повышении температуры на каждые десять градусов скорость большинства химических реакций возрастает в 2 – 4 раза.
Математически правило выражают следующим образом:
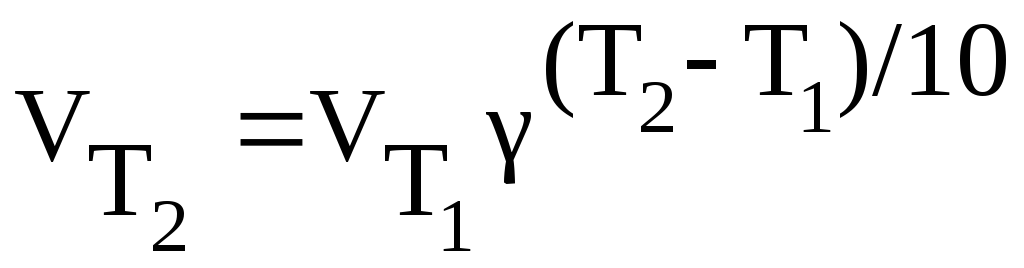 ,
,
где
![]() и
и![]() -
скорость реакции при температурах
-
скорость реакции при температурах![]() и
и![]() (
(![]() >
>![]() );
);
- температурный коэффициент скорости, принимающий для разных реакций значения от двух до четырех.
4.2. Химическое равновесие
В природе существуют реакции практически необратимые (идущие в одном направлении) и обратимые реакции (идущие в прямом и обратном направлениях). Пример необратимой реакции: 2KClO3 = 2KCl + 3O2, обратимой реакции: 2SO2 + O2 2SO3. Большинство реакций обратимы, в уравнениях таких реакций ставят знак обратимости (стрелки в двух направлениях ).
Если в какой-либо замкнутой системе может идти обратимая реакция, то наступит такой момент, когда скорости прямой и обратной реакций станут одинаковыми.
Состояние системы, характеризующееся равными скоростями прямой и обратной реакций, называют состоянием химического равновесия.
Химическое
равновесие имеет динамический характер.
Это означает, что количество любого
вещества, расходующегося в ходе прямой
реакции, равно его количеству, образующемуся
в результате обратной реакции. В условиях
химического равновесия концентрации
всех веществ в системе не изменяются
со временем, их называют равновесными
концентрациями.
Равновесные концентрации обозначают
символом вещества в квадратных скобках:
![]() .
.
Рассмотрим
состояние химического равновесия в
системе H2
+ I2
2HI
при 450 0С,
когда иод находится в парообразном
состоянии. Реакцию, идущую слева направо,
называют прямой, а справа налево -
обратной. При химическом равновесии
скорость прямой реакции равна скорости
обратной реакции:
![]() .
Кинетические уравнения для прямой и
обратной реакций в данной системе
согласуются с законом действующих масс,
следовательно,
.
Кинетические уравнения для прямой и
обратной реакций в данной системе
согласуются с законом действующих масс,
следовательно,
![]() .
.
После преобразования получим:
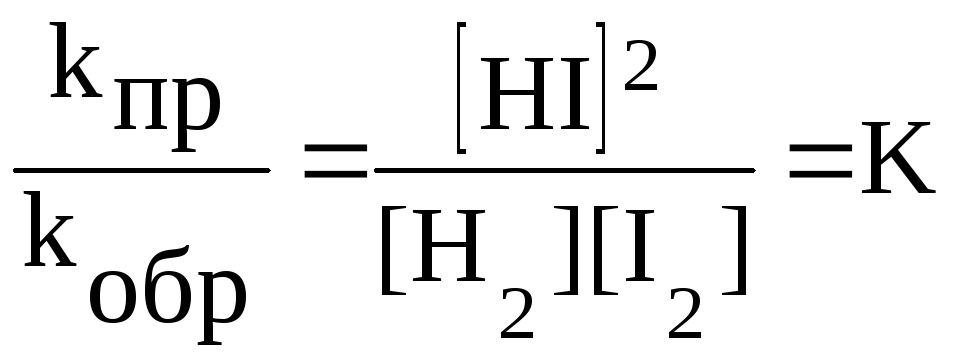 .
.
Постоянную
величину
![]() называют константой химического
равновесия. Она зависит от природы
реагирующих веществ и температуры, но
не зависит от концентраций веществ. В
общем виде для системы
называют константой химического
равновесия. Она зависит от природы
реагирующих веществ и температуры, но
не зависит от концентраций веществ. В
общем виде для системы
aA + bB cC + dD
