
- •Екатеринбург
- •Общие методические указания
- •Образец выполнения домашнего задания
- •1. Строение атома
- •Строение атома
- •Пример 2. Используя правила Клечковского, рассчитайте, какой подуровень раньше заполняется электронами 4р или 5s.
- •Задания к разделу 1
- •2. Закономерности химических процессов
- •2.1. Термодинамический метод рассмотрения химических процессов
- •Задания к подразделу 2.1
- •Влияние концентрации реагирующих веществ
- •Влияние температуры
- •Задания к подразделу 2.2
- •2.3. Химическое равновесие
- •Задания к подразделу 2.3
- •3.Растворы электролитов
- •3.1. Концентрация растворов
- •Примеры решения типичных задач
- •Задания к подразделу 3.1
- •3.2. Электролитическая диссоциация. Ионно-молекулярные уравнения
- •Сильные электролиты
- •Слабые электролиты
- •Задания к подразделу 3.2
- •3.3. Гидролиз солей
- •Задания к подразделу 3.3
- •4. Окислительно-восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Задания к подразделу 4.1
- •4.2. Взаимодействие металлов с кислотами, водой и растворами щелочей
- •Задание к подразделу 4.2
- •4.3. Гальванические элементы
- •Задания к подразделу 4.3
- •4.4. Электрохимическая коррозия металлов
- •Задание к подразделу 4.4
- •4.5. Электролиз растворов
- •Катодные процессы
- •Анодные процессы
- •Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:
- •Задание к подразделу 4.5
- •5. Дисперсные системы. Катализ и каталитические системы. Полимеры и олигомеры
- •Варианты заданий
- •Библиографический список
- •7. Приложения
- •Тема: « классы неорганических веществ»
- •3.1 Оксиды
- •3.1.1 Химические свойства основных оксидов
- •3.1.2 Химические свойства кислотных оксидов
- •3.1.3 Химические свойства амфотерных оксидов
- •3.2 Гидроксиды
- •3.2.1 Химические свойства оснований
- •3.2.2 Химические свойства кислот
- •3.2.3 Химические свойства амфотерных гидроксидов
- •3.3.1 Способы получения кислых солей
- •3.3.2 Способы получения основных солей
- •Названия некоторых кислот и их солей
- •Растворимость кислот, оснований и солей в воде
- •Водорода, кислорода и некоторых металлов в разных средах
- •620002, Екатеринбург, ул. Мира, 19
- •620002, Екатеринбург, ул. Мира, 19
4.3. Гальванические элементы
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.
Методика рассмотрения работы гальванических элементов:
Составляют схему гальванического элемента:
(–) Me1 / Me1n + // Me2 m+ / Me2 (+)
По уравнению Нернста находят потенциалы электродов.
Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом.
Записывают уравнения электродных процессов, определяют характер этих процессов.
Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе.
Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов.
Пример 1. Гальванический элемент с водородным электродом.
Схема Zn / ZnSO4 // H2SO4 , Н2 / Pt.
![]() 1
моль/л,
1
моль/л,
![]() 1
моль/л, Т
= 298 К, P
= 101,3 кПa
.
1
моль/л, Т
= 298 К, P
= 101,3 кПa
.
Электродные потенциалы
![]() =
0 В ,
=
0 В ,
![]() =
-
0,76 В (при
=
-
0,76 В (при
![]() 1
моль/л).
1
моль/л).
Направление движения электронов во внутренней цепи - от цинкового электрода к водородному, так как потенциал цинкового электрода меньше.
ē

(–) Zn / ZnSO 4 // H2SO4 , Н2 / Pt (+)


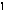

SO42 -
Уравнения электродных процессов:
Zn (-): Zn - 2 ē = Zn 2+ - процесс окисления;
Pt (+): 2Н ++ 2 ē = Н 2 - процесс восстановления.
Суммарное уравнение:
Zn + 2Н + = Zn 2+ + Н 2 Zn + H2SO4 = ZnSO4 + Н 2
Расчет величины ЭДС:
ЭДС = Е0Ox - Е0Red = 0 – (- 0,76) = 0,76 В.
Пример 2. Концентрационный гальванический элемент
Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации.
Схема гальванического элемента:
Ni
/ NiSO 4(![]() = 10-4
моль/л)// NiSO
4 (
= 10-4
моль/л)// NiSO
4 (![]() =1моль/л)
/ Ni
=1моль/л)
/ Ni
Стандартный
электродный потенциал
![]() =
-
0,25 В.
=
-
0,25 В.
Вычисление электродных потенциалов по уравнению Нернста:
![]() =
=
![]() +
+
![]() ·
lg
·
lg
![]() =
- 0,25
+
=
- 0,25
+
![]() ·lg
10 -4
= - 0,309
B.
·lg
10 -4
= - 0,309
B.
![]() =
=
![]() =
-
0,25 B.
=
-
0,25 B.
Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как
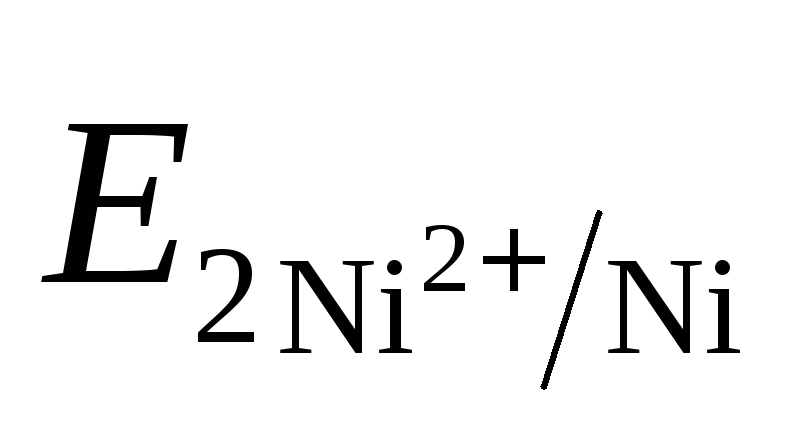 >
>
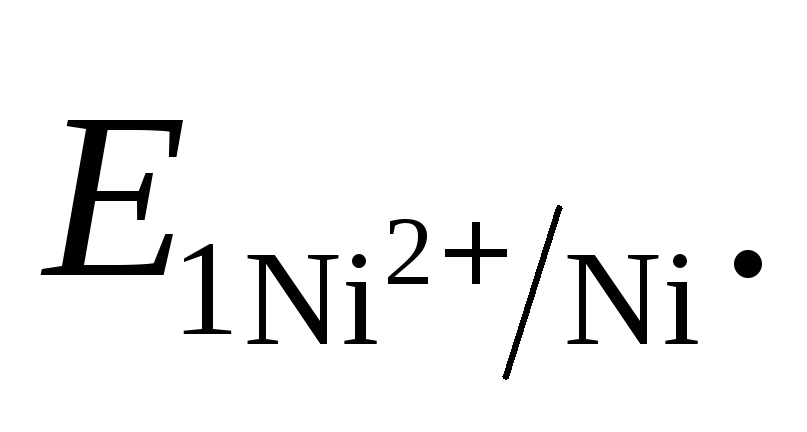
ē

(-) Ni1 / NiSO4 (10-4 М) // NiSO4 (1 М) / Ni 2 (+)





SO42–
Уравнения электродных полуреакций:
Ni1 (-): Ni - 2 ē = Ni 2+ - процесс окисления;
Ni2 (+): Ni2+ + 2 ē = Ni - процесс восстановления.
Расчет величины ЭДС:
ЭДС
=
![]() -
-
![]() =
-
0,25 -
(-
0,309) = 0,059 В.
=
-
0,25 -
(-
0,309) = 0,059 В.
Задания к подразделу 4.3
Для предложенных гальванических элементов рассчитайте электродные потенциалы и ЭДС. Если концентрация раствора не указана, потенциал примите стандартным (табл.П.6). Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, составьте схему и укажите направления движения электронов и ионов.
Al / Al2(SO4)3, 0,005 M // NiSO4, 0,01 М / Ni
Ni / NiSO4, 0,1 M // H2SO4 / H2 (Pt)
Sn / SnSO4 // Cr2(SO4)3, 0,05 M / Cr
(Pt) H2 / H2SO4 // Al2(SO4)3, 0,005 M / Al
Cu / CuSO4, 0,1 M // H2SO4 / H2 (Pt)
Ag / AgNO3, 0,01 M // H2SO4 / H2 (Pt)
Co / CoSO4, 0,01 M // CoSO4 / Co
Zn / ZnSO4, 0,1 M // FeSO4, 0,01 M / Fe
Ag / AgNO3, 0,01 M // Zn(NO3)2 / Zn
(Pt) H2 / H2SO4 // ZnSO4, 0,01 M / Zn
Cd / Cd(NO3)2, 0,1 M // Cd(NO3)2, 0,001 M / Cd
Ni / NiSO4, 0,001 M // NiSO4 / Ni
Fe / FeCl2 // FeCl2, 0,01 M / Fe
Cr / Cr2(SO4)3, 0,005 M // ZnSO4 / Zn
Zn / Zn(NO3)2, 0,001 M // Zn(NO3)2 / Zn
Ag / AgNO3 // Cr(NO3)3, 0,005 M / Cr
Cd / CdCl2, 0,1 M // CuCl2, 0,1 M / Cu
Ti / Ti2(SO4)3, 0,5 M // CuSO4 / Cu
Sn / SnSO4, 0,01 M // Fe2(SO4)3 / Fe
Ag / AgNO3, 0,0001 M // Pb(NO3)2 , 0,1 M / Pb
