
- •Лекция № 23 Галогенопроизводные со связью с(sp3)-галоген.
- •Лекция № 24 Галогенопроизводные со связью с(sp3)-галоген.
- •Реакции элиминирования (отщепления)
- •Е2 Элиминирование
- •Е2 Элиминирование
- •Некоторые общие закономерности реакций нуклеофильного замещения и элиминирования:
- •Галогенопроизводные со связью с(sp2)-галоген. Галогеналкены
- •Лекция № 25
- •Галогенопроизводные со связью с(sp2)-галоген. Галогенарены (ароматические галогенопроизводные)
- •Реакции нуклеофильного замещения галогена в ароматическом ряду
- •Механизм присоединения-отщепления
- •Ариновый механизм нуклеофильного замещения
- •Лекция № 26 Металлорганические соединения.
- •Гидроксилсодержащие производные углеводородов и простые эфиры
- •Металлорганические соединения
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты).
- •Лекция № 27 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты). Химические свойства
- •Дегидратация спиртов (получение алкенов)
- •Нулеофильное замещение он-группы (получение галогеноалканов)
- •Получение сложных эфиров
- •Получение простых эфиров
- •Окисление
- •Многоатомные спирты
- •Лекция № 28 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp2)-oh
- •Получение
- •Химические свойства
- •Образование простых эфиров фенолов
- •Образование сложных эфиров
- •Гидрирование и окисление фенолов
- •Реакции ароматического электрофильного замещения
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Карбоксилирование (реакция Кольбе-Шмитта)
- •Формилирование (реакция Раймера-Тимана)
- •Лекция № 29 Простые эфиры.
- •Простые эфиры
- •Получение
- •Химические свойства
- •Тиолы и сульфиды
- •Получение
- •Химические свойства
- •Реакции с электрофилами
- •Окисление и восстановление
- •Лекция № 30 Карбонильные соединения
- •Получение карбонильных соединений
- •Химические свойства альдегидов и кетонов
- •Лекция № 31 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Присоединение воды
- •Присоединение спиртов
- •Присоединение тиолов
- •Присоединение синильной кислоты
- •Бисульфитная реакция
- •Реакции присоединения-отщепления
- •Реакции присоединения и отщепления с первичными аминами
- •Конденсация Кневенагеля
- •Полимеризация альдегидов
- •Лекция № 32 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Хлорирование
- •Окисление
- •Восстановление
- •Реакция Канниццаро (диспропорционирование)
- •Галогенирование
- •Галоформная реакция
- •Альдольная конденсация (реакция а.П. Бородина)
- •Кротоновая конденсация
- •Конденсация кетонов
- •Перекрестная альдольная и кротоновая конденсации
- •Конденсация Перкина
- •Конденсация Кляйзена-Тищенко
- •Лекция № 33 Карбонильные соединения
Химические свойства
Старое название фенола – карболовая кислота, указывает на выраженные кислотные свойства. Фенолы более сильные кислоты, чем спирты (pKa фен= 10,pKa МеОН= 16). Причина таких свойств – повышенная, по сравнению с алкоксид-, стабильность фенолят аниона за счет сопряжения.

Образование фенолятов возможно в реакциях с водными щелочами. Обратная реакция протекает под действием любой минеральной кислоты.

Заместители в бензольном цикле заметно влияют на кислотность. Наличие в положениях 2 или/и 4 или/и 6 электроноакцепторных групп увеличивает кислотность. Причем, чем больше акцепторов в указанных положения, тем легче проходит замещение галогена.
Если в положениях 2 или/и 4 или/и 6 расположены электронодонорные группы, кислотность уменьшается. Причем, чем больше доноров в указанных положения, тем труднее происходит замещение галогена.
Если акцепторные или донорные группы расположены в положениях 3 или/и 5 их активирующее или дезактивирующее действие выражено очень слабо.
Для объяснения изменений кислотности фенолов надо рассмотривать стабильность образующегося аниона. Логика анализа феноксид-аниона по устойчивости граничных структур аналогична рассмотрению стабильности -комплекса, в реакциях нуклеофильного замещения галогена в ароматическом ряду (см. лекцию 25).
Образование простых эфиров фенолов
Простые эфиры фенолов получают реакцией фенолят-аниона с алкилгалогенидом.

Алкилфениловые эфиры термодинамически очень устойчивы. Только в одном из простых эфиров фенолов – метилфениловом эфире – удается провести расщепление эфирной связи с образованием исходных соединений. Эта реакция часто используется для защиты гидроксигруппы.

Аллилфениловые эфиры фенолов термодинамически неустойчивы и при нагревании изомеризуются в устойчивые орто-аллилфенолы (перегруппировка Кляйзена).

Образование сложных эфиров
Образование сложных эфиров фенолов возможно только в реакциях с ангидридами или хлорангидридами карбоновых кислот, но не с сами кислотами.

Сложные эфиры фенолов соединения термодинамически неустойчивые. В присутствии кислот Льюиса они вступают в перегруппировку Фриса. При температуре более 100оацильная группа мигрирует ворто-, а при комнатной – впара-положение.

Гидрирование и окисление фенолов
Каталитическое восстановление фенола приводят к циклогексанолу – важному исходному соединению в синтезе искусственных волокон.
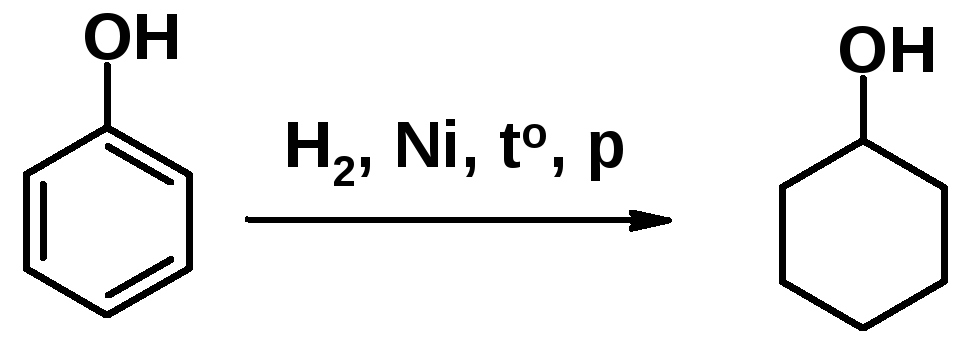
Фенолы окисляются уже при стоянии на воздухе, что объясняется повышенной, по сравнению с бензолом, электронной плотностью в цикле. Окисление фенола приводит к орто- ипара-хинонам, причем тщательным подбором условий удается провести селективное окисление. Значительно легче вступают в окисление с образованием соответствующих хинонов двухатомные фенолы.

Реакции ароматического электрофильного замещения
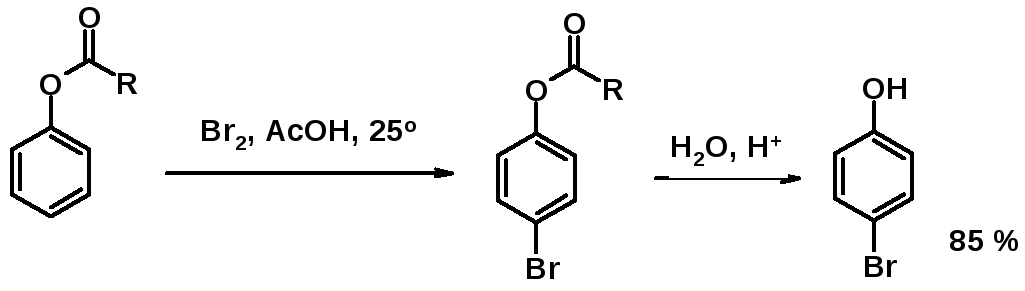
ОН-Группа – активирующий заместитель, орто-пара-ориентант. Активирующие свойства гидроксигруппы столь велики, что для получения монобромпроизводного исходным соединением является не фенол, а сложный эфир фенола. После бромирования ацильную группу гидролизуют.
Реакция фенола с трехкратным избытком бромной воды останавливается только тогда, когда электрофил занимает все положения кольца, которые может атаковать.
В большем избытке бромной воды результатом реакции становится «тетрабромфенол». Таким образом, активирующее действие ОН-группы столь велико, что возможно протекание реакций с нарушением ароматической системы.

Нитрование фенола легко протекает при комнатной температуре разбавленной азотной кислотой. Образуется смесь орто- ипара-нитрофенолов, которую легко разделить перегонкой с водяным паром (более летучийорто-изомер перегоняется с водяным паром).

Строение продуктов сульфирования фенола сильно зависит от температуры и времени проведения реакции. Сульфирование при комнатной температуре приводит к кинетически контролируемому орто-изомеру, реакция при 100окпара-изомеру - продукту термодинамического контроля. Обратимость сульфирования позволяет нагреванием превратитьорто-изомер в продуктпара-замещения.

