
- •Лекция № 23 Галогенопроизводные со связью с(sp3)-галоген.
- •Лекция № 24 Галогенопроизводные со связью с(sp3)-галоген.
- •Реакции элиминирования (отщепления)
- •Е2 Элиминирование
- •Е2 Элиминирование
- •Некоторые общие закономерности реакций нуклеофильного замещения и элиминирования:
- •Галогенопроизводные со связью с(sp2)-галоген. Галогеналкены
- •Лекция № 25
- •Галогенопроизводные со связью с(sp2)-галоген. Галогенарены (ароматические галогенопроизводные)
- •Реакции нуклеофильного замещения галогена в ароматическом ряду
- •Механизм присоединения-отщепления
- •Ариновый механизм нуклеофильного замещения
- •Лекция № 26 Металлорганические соединения.
- •Гидроксилсодержащие производные углеводородов и простые эфиры
- •Металлорганические соединения
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты).
- •Лекция № 27 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты). Химические свойства
- •Дегидратация спиртов (получение алкенов)
- •Нулеофильное замещение он-группы (получение галогеноалканов)
- •Получение сложных эфиров
- •Получение простых эфиров
- •Окисление
- •Многоатомные спирты
- •Лекция № 28 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp2)-oh
- •Получение
- •Химические свойства
- •Образование простых эфиров фенолов
- •Образование сложных эфиров
- •Гидрирование и окисление фенолов
- •Реакции ароматического электрофильного замещения
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Карбоксилирование (реакция Кольбе-Шмитта)
- •Формилирование (реакция Раймера-Тимана)
- •Лекция № 29 Простые эфиры.
- •Простые эфиры
- •Получение
- •Химические свойства
- •Тиолы и сульфиды
- •Получение
- •Химические свойства
- •Реакции с электрофилами
- •Окисление и восстановление
- •Лекция № 30 Карбонильные соединения
- •Получение карбонильных соединений
- •Химические свойства альдегидов и кетонов
- •Лекция № 31 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Присоединение воды
- •Присоединение спиртов
- •Присоединение тиолов
- •Присоединение синильной кислоты
- •Бисульфитная реакция
- •Реакции присоединения-отщепления
- •Реакции присоединения и отщепления с первичными аминами
- •Конденсация Кневенагеля
- •Полимеризация альдегидов
- •Лекция № 32 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Хлорирование
- •Окисление
- •Восстановление
- •Реакция Канниццаро (диспропорционирование)
- •Галогенирование
- •Галоформная реакция
- •Альдольная конденсация (реакция а.П. Бородина)
- •Кротоновая конденсация
- •Конденсация кетонов
- •Перекрестная альдольная и кротоновая конденсации
- •Конденсация Перкина
- •Конденсация Кляйзена-Тищенко
- •Лекция № 33 Карбонильные соединения
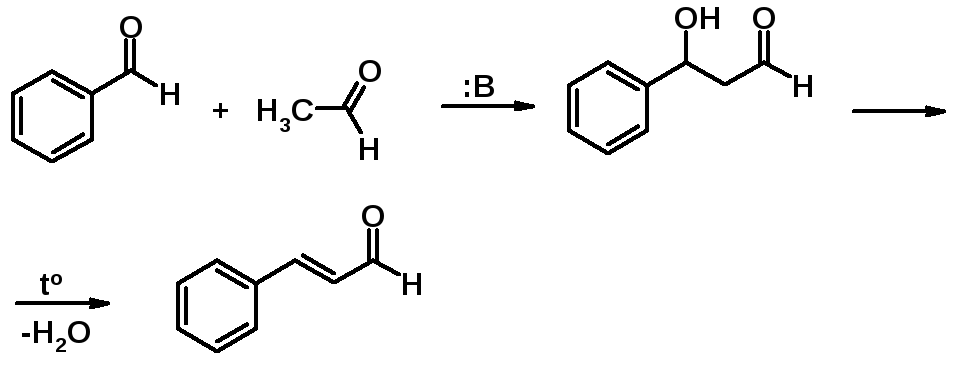
Альдольная конденсация (реакция а.П. Бородина)
В реакцию вступают альдегиды у которых в -положении к карбонильной группе есть хотя бы один атом водорода. Альдольная конденсация катализируется основаниями, причем чаще всего довольно слабыми, например,Ba(OH)2. Использование едких щелочей возможно только в некоторых случаях при проведении реакции при пониженной температуре.
Реакция начинается с атаки основанием на подвижный атом водорода в -положении карбонильного соединения. Образуется резонансностабилизированный енолят-анион, который проявляет выраженные нуклеофильные свойства и атакует карбонильный углерод молекулы альдегида, не вступившей во взаимодействие с основанием. Образующийся алкоксид-анион протонируется, превращаясь в конечный продукт – альдоль.
Кетоны в этих условиях в реакцию не вступают.

Кротоновая конденсация
Альдоль может быть выделен из реакционной смеси в свободном виде. Однако реакция может протекать глубже. При незначительном нагревании (около 60о) альдоли легко отщепляют воду, превращаясь в непредельные альдегиды.

Поскольку простейший из альдегидов, способных вступать в альдольную конденсацию с последующей дегидратацией, образует в результате кротоновый альдегид – вся последовательность реакций получила название кротоновой конденсации. Последнюю стадию (дегидратацию) часто называют кротонизацией.
В условия кислого катализа остановить реакцию на стадии альдоля не удается. В присутствии кислоты может быть проведена только реакция кротоновой конденсации.

Конденсация кетонов
Кетоны вступают в реакцию конденсации с большим трудом, только в жестких условиях. Удовлетворительные результаты могут быть получены только при проведении реакции в кислой среде, т.е. только в условиях кротоновой конденсации. Следует помнить, что, поскольку у кетонов есть два -углеродных атома, реакция может протекать по обоим реакционноспособным положениям.

Перекрестная альдольная и кротоновая конденсации
Перекрестныя конденсации – реакции, в которых участвуют различные карбонильные соединения. Не имеет препаративного смысла проводить перекрестные реакции с двумя альдегидами, содержащими -водороды. В этом случае образуются четыре продукта реакции.
Обычно, перекрестную альдольную или кротоновую конденсации проводят с участием одного альдегида, имеющего водороды в -положении, и другого, у которого они отсутствуют. Причем первый берут в недостатке, а второй в избытке.
Альдегид, содержащий -водороды, служит источником енолят-аниона.
Известно много конденсаций по своему механизму близких к альдольной (Прекина, Кляйзена и др.). Все эти реакции включают стадию атаки карбаниона по углероду карбонильной группы. Карбанион образуется в результате отрыва основанием протона от -углеродного по отношению к карбонильной группе атома альдегида, кетона, сложного эфира, ангидрида карбоновой кислоты и др. Хотя в этих конденсациях участвуют соединения разных классов, химия процессов в общем одинакова. Глубоко понимая механизм альдольной конденсации, легко разобраться и в остальных реакциях.
Конденсация Перкина
Реакция ароматических альдегидов с ангидридами карбоновых кислот, содержащих -водород, приводит к непредельным карбоновым кислотам.

