
- •Лекция № 23 Галогенопроизводные со связью с(sp3)-галоген.
- •Лекция № 24 Галогенопроизводные со связью с(sp3)-галоген.
- •Реакции элиминирования (отщепления)
- •Е2 Элиминирование
- •Е2 Элиминирование
- •Некоторые общие закономерности реакций нуклеофильного замещения и элиминирования:
- •Галогенопроизводные со связью с(sp2)-галоген. Галогеналкены
- •Лекция № 25
- •Галогенопроизводные со связью с(sp2)-галоген. Галогенарены (ароматические галогенопроизводные)
- •Реакции нуклеофильного замещения галогена в ароматическом ряду
- •Механизм присоединения-отщепления
- •Ариновый механизм нуклеофильного замещения
- •Лекция № 26 Металлорганические соединения.
- •Гидроксилсодержащие производные углеводородов и простые эфиры
- •Металлорганические соединения
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты).
- •Лекция № 27 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты). Химические свойства
- •Дегидратация спиртов (получение алкенов)
- •Нулеофильное замещение он-группы (получение галогеноалканов)
- •Получение сложных эфиров
- •Получение простых эфиров
- •Окисление
- •Многоатомные спирты
- •Лекция № 28 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp2)-oh
- •Получение
- •Химические свойства
- •Образование простых эфиров фенолов
- •Образование сложных эфиров
- •Гидрирование и окисление фенолов
- •Реакции ароматического электрофильного замещения
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Карбоксилирование (реакция Кольбе-Шмитта)
- •Формилирование (реакция Раймера-Тимана)
- •Лекция № 29 Простые эфиры.
- •Простые эфиры
- •Получение
- •Химические свойства
- •Тиолы и сульфиды
- •Получение
- •Химические свойства
- •Реакции с электрофилами
- •Окисление и восстановление
- •Лекция № 30 Карбонильные соединения
- •Получение карбонильных соединений
- •Химические свойства альдегидов и кетонов
- •Лекция № 31 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Присоединение воды
- •Присоединение спиртов
- •Присоединение тиолов
- •Присоединение синильной кислоты
- •Бисульфитная реакция
- •Реакции присоединения-отщепления
- •Реакции присоединения и отщепления с первичными аминами
- •Конденсация Кневенагеля
- •Полимеризация альдегидов
- •Лекция № 32 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Хлорирование
- •Окисление
- •Восстановление
- •Реакция Канниццаро (диспропорционирование)
- •Галогенирование
- •Галоформная реакция
- •Альдольная конденсация (реакция а.П. Бородина)
- •Кротоновая конденсация
- •Конденсация кетонов
- •Перекрестная альдольная и кротоновая конденсации
- •Конденсация Перкина
- •Конденсация Кляйзена-Тищенко
- •Лекция № 33 Карбонильные соединения
Альдегиды и кетоны Химические свойства альдегидов и кетонов Присоединение воды
Альдегиды и, в меньшей степени кетоны, в воде существуют в виде гем-диола. Например, формальдегид в водном растворе полностью находится в виде ковалентного гидрата.

Гем-диольная форма существует только в воде. Попытки выделить ее в индивидуальном виде приводят к полному сдвигу равновесии влево. Наличие в -положении к карбонильной группе акцепторных заместителей сдвигает равновесии вправо и придает устойчивость диольной форме. Например, трихлорацетальдегид, присоединяя воду, образует устойчивую форму – хлоральгидрат. Отщепление воды от хлоральгидрата возможно только действием концентрированнойH2SO4.
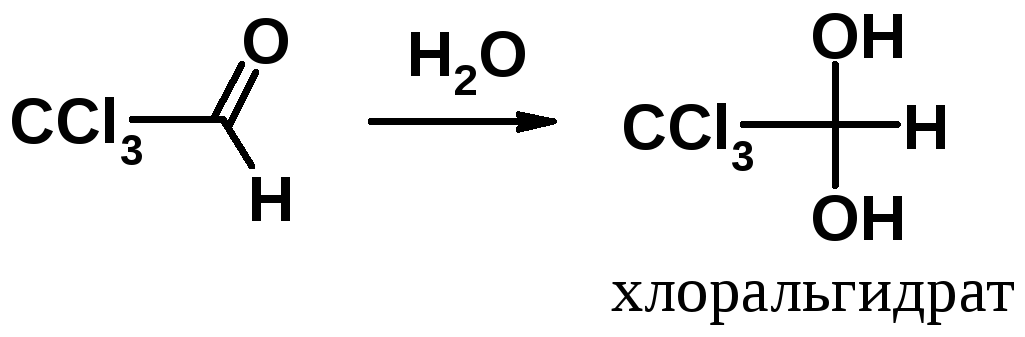
Присоединение спиртов
В присутствии катализатора спирты присоединяются к альдегидам с образованием полуацеталей и ацеталей («полных ацеталей»).

Реакции с кетонами идут намного труднее.
Образование полуацеталей может катализироваться кислотами и основаниями.
Кислотный катализ:

Основной катализ:

В кислой среде катализатор активирует карбонильное соединение, превращая его в катион, и увеличивает склонность к взаимодействию с нуклеофилом (спиртом). В присутствие основания происходит обратимое образование алкоксид-аниона, обладающего более выраженными нуклеофильными свойствами, чем спирт.
Образование ацеталя катализируется только кислотами, но не основаниями. В молекуле полуацеталя отсутствует выраженный электрофилный центр, поэтому активация нуклеофила не приводит к желаемому результату. Кислотный катализатор, протонируя молекулу полуацеталя, генерирует электрофильный центр, способный реагировать со спиртом (нуклеофилом).

Как видно из механизма – реакция обратима на всех стадиях. Обратная реакция – гидролиз, причем гидролиз ацеталя может быть проведен только в кислой среде, полуацеталя – в кислой и щелочной.
Обратимость получения ацеталей часто используют для защиты карбонильной группы. Например, восстановление нитро- или сложноэфирной группы в альдегиде или кетоне может привести и к восстановлению карбонильной группы. Превращение карбонильной группы в ацеталь, последующее восстановление и гидролиз ацеталя, позволяет провести восстановление и сохранить карбонильную группу.
Присоединение тиолов
В кислой среде, но не в основной, тиолы присоединяются к карбонильным соединениям с образованием дитиоацеталей.

Гидролиз дитиоацеталей проходит в значительно более жестких условиях, чем в случае ацеталей.
Присоединение синильной кислоты
Синильная (циановодородная) кислот присоединяется к альдегидам и кетонам с образованием циангидринов (гидроксинитрилов), что позволяет увеличить углеродную цепь молекулы на один атом. Поскольку сама синильная кислота малодиссоциирована, реакцию проводят в присутствии каталитических количеств ее соли или основания, генерирующих в реакционной массе нуклеофильные цианид-анионы. Примечательно, что эта реакция – одно из первых превращений, механизм которых был достоверно установлен (Лануорт, 1902 г.)

Циангидрины ценные промежуточные соединения в синтезе гидроксилсодержащих карбоновых кислот, амидов и др. Кроме того, дегидратацией гидроксинитрилов можно получать непредельные соединения, некоторые из которых являются ценными мономерами, например, метилметакрилат.
