
- •Лекция № 23 Галогенопроизводные со связью с(sp3)-галоген.
- •Лекция № 24 Галогенопроизводные со связью с(sp3)-галоген.
- •Реакции элиминирования (отщепления)
- •Е2 Элиминирование
- •Е2 Элиминирование
- •Некоторые общие закономерности реакций нуклеофильного замещения и элиминирования:
- •Галогенопроизводные со связью с(sp2)-галоген. Галогеналкены
- •Лекция № 25
- •Галогенопроизводные со связью с(sp2)-галоген. Галогенарены (ароматические галогенопроизводные)
- •Реакции нуклеофильного замещения галогена в ароматическом ряду
- •Механизм присоединения-отщепления
- •Ариновый механизм нуклеофильного замещения
- •Лекция № 26 Металлорганические соединения.
- •Гидроксилсодержащие производные углеводородов и простые эфиры
- •Металлорганические соединения
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты).
- •Лекция № 27 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты). Химические свойства
- •Дегидратация спиртов (получение алкенов)
- •Нулеофильное замещение он-группы (получение галогеноалканов)
- •Получение сложных эфиров
- •Получение простых эфиров
- •Окисление
- •Многоатомные спирты
- •Лекция № 28 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp2)-oh
- •Получение
- •Химические свойства
- •Образование простых эфиров фенолов
- •Образование сложных эфиров
- •Гидрирование и окисление фенолов
- •Реакции ароматического электрофильного замещения
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Карбоксилирование (реакция Кольбе-Шмитта)
- •Формилирование (реакция Раймера-Тимана)
- •Лекция № 29 Простые эфиры.
- •Простые эфиры
- •Получение
- •Химические свойства
- •Тиолы и сульфиды
- •Получение
- •Химические свойства
- •Реакции с электрофилами
- •Окисление и восстановление
- •Лекция № 30 Карбонильные соединения
- •Получение карбонильных соединений
- •Химические свойства альдегидов и кетонов
- •Лекция № 31 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Присоединение воды
- •Присоединение спиртов
- •Присоединение тиолов
- •Присоединение синильной кислоты
- •Бисульфитная реакция
- •Реакции присоединения-отщепления
- •Реакции присоединения и отщепления с первичными аминами
- •Конденсация Кневенагеля
- •Полимеризация альдегидов
- •Лекция № 32 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Хлорирование
- •Окисление
- •Восстановление
- •Реакция Канниццаро (диспропорционирование)
- •Галогенирование
- •Галоформная реакция
- •Альдольная конденсация (реакция а.П. Бородина)
- •Кротоновая конденсация
- •Конденсация кетонов
- •Перекрестная альдольная и кротоновая конденсации
- •Конденсация Перкина
- •Конденсация Кляйзена-Тищенко
- •Лекция № 33 Карбонильные соединения
Химические свойства
Алкиловые простые эфиры вступают в весьма ограниченный круг реакций. Чаще всего их используют в качестве растворителей (см. например получение реактивов Гриньяра). Наиболее препаративно важная реакция алкиловых эфиров – расщепление (ацидолиз), который обычно проводят действием йодистовдородной кислоты.
![]()
Если оба заместителя первичные – галоген оказывается у меньшего по размеру (SN2), если один из заместителей первичный, а второй третичный, галоген – у третичного (SN1).
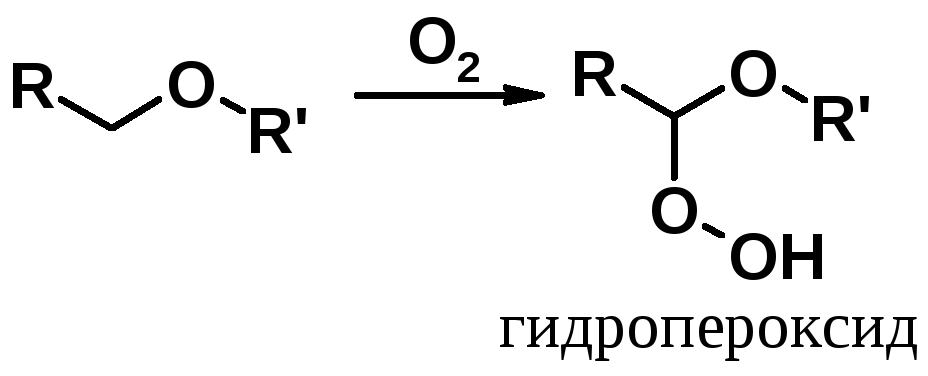
Неприятное свойство эфиров – способность к окислению под действием кислорода воздуха при комнатной температуре. Образующиеся в результате окисления гидропероксиды очень взрывоопасны. Перегонка простых эфиров требует скрупулезного выполнения правил техники безопасности.
Очень широки синтетические возможности оксиранов, которые легко вступают в реакции с нуклеофилами с раскрытием цикла.

Тиолы и сульфиды
Кислород и сера находятся рядом в периодической системе элементов и имеют много общего. Серусодержащие органические соединения играют важную роль в процессах жизнедеятельности. Они входят в состав белков, ферментов, многих лекарств, красителей и др.
Тиолы (меркаптаны, тиоспирты) – соединения, в которых SH-группа связана с насыщенным атомом углерода (Alk-SH).
Тиофенолы - соединения, в которых SH-группа связана с ароматическом циклом (Ar-SH).
Сульфиды (тиоэфиры) – соединения, которых два углеводородных радикала связаны через атом серы (R-S-R’).
Получение
Первичные тиолы чаще всего получают нуклеофильным замещением галогена в соответствующих производных.
![]()
Вторичные галогенопроизводные реагируют с низким выходом, третичные в этих условиях образуют алкены.
Похожая реакция возможна среди галогеноаренов, при условии, что в кольце находятся активирующие атом галогена к реакции с нуклеофилами заместители.

Получение тиолов реакцией алкилгалогенида с гидросульфидом натрия возможно только в присутствии большого избытка NaSH. Если в избытке органическое соединение результат – сульфид.

Наиболее общий способ получения сульфидов – реакция тиолов с галогенопроизводными.
![]()
Химические свойства
Тиолы проявляют кислые свойства. pKaАлкантиолов – 10-11, тиофенолов – 6-8, что на пяти порядков вышем чем у соответствующих спиртов и фенолов. Повышенная кислотность тиопроизводных обусловлена тем, что тиоксидный анион (RS-) вследствии высокой поляризуемости атома серы более стабилен, чем алкоксидный (RO-).
В реакциях со щелочами тиолы образуют тиоляты, которые в водной среде заметно гидролизованы.

С тяжелыми металлами тиолы образуют нерастворимые ковалентные соли.

Это свойство используется при острых отравления тиоловыми ядами – веществами способными взаимодействовать с SH-группой (ртуть, хром, мышьяк и др.).
Реакции с электрофилами
Тиолы, в особенности тиолят-анионы, и сульфиды проявляют выраженные нуклеофильные свойства. Реакции с электрофилами часто проходят в очень мягких условиях.
Тиолы и тиофенолы в присутствии оснований легко вступают в реакции алкилирования и арилирования с образованием сульфидов.

В щелочной среде тиолы реагируют с ангидридами и хлорангидридами карбоновых кислот с образованием эфиров тиокислот – аналогов сложных эфиров.

