
- •Лекция № 23 Галогенопроизводные со связью с(sp3)-галоген.
- •Лекция № 24 Галогенопроизводные со связью с(sp3)-галоген.
- •Реакции элиминирования (отщепления)
- •Е2 Элиминирование
- •Е2 Элиминирование
- •Некоторые общие закономерности реакций нуклеофильного замещения и элиминирования:
- •Галогенопроизводные со связью с(sp2)-галоген. Галогеналкены
- •Лекция № 25
- •Галогенопроизводные со связью с(sp2)-галоген. Галогенарены (ароматические галогенопроизводные)
- •Реакции нуклеофильного замещения галогена в ароматическом ряду
- •Механизм присоединения-отщепления
- •Ариновый механизм нуклеофильного замещения
- •Лекция № 26 Металлорганические соединения.
- •Гидроксилсодержащие производные углеводородов и простые эфиры
- •Металлорганические соединения
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты).
- •Лекция № 27 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp3)-oh (спирты). Химические свойства
- •Дегидратация спиртов (получение алкенов)
- •Нулеофильное замещение он-группы (получение галогеноалканов)
- •Получение сложных эфиров
- •Получение простых эфиров
- •Окисление
- •Многоатомные спирты
- •Лекция № 28 Гидроксилсодержащие производные углеводородов и простые эфиры
- •Гидроксилсодержащие производные углеводородов Гидроксилпроизводные со связью с(sp2)-oh
- •Получение
- •Химические свойства
- •Образование простых эфиров фенолов
- •Образование сложных эфиров
- •Гидрирование и окисление фенолов
- •Реакции ароматического электрофильного замещения
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Карбоксилирование (реакция Кольбе-Шмитта)
- •Формилирование (реакция Раймера-Тимана)
- •Лекция № 29 Простые эфиры.
- •Простые эфиры
- •Получение
- •Химические свойства
- •Тиолы и сульфиды
- •Получение
- •Химические свойства
- •Реакции с электрофилами
- •Окисление и восстановление
- •Лекция № 30 Карбонильные соединения
- •Получение карбонильных соединений
- •Химические свойства альдегидов и кетонов
- •Лекция № 31 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Присоединение воды
- •Присоединение спиртов
- •Присоединение тиолов
- •Присоединение синильной кислоты
- •Бисульфитная реакция
- •Реакции присоединения-отщепления
- •Реакции присоединения и отщепления с первичными аминами
- •Конденсация Кневенагеля
- •Полимеризация альдегидов
- •Лекция № 32 Карбонильные соединения
- •Альдегиды и кетоны Химические свойства альдегидов и кетонов Хлорирование
- •Окисление
- •Восстановление
- •Реакция Канниццаро (диспропорционирование)
- •Галогенирование
- •Галоформная реакция
- •Альдольная конденсация (реакция а.П. Бородина)
- •Кротоновая конденсация
- •Конденсация кетонов
- •Перекрестная альдольная и кротоновая конденсации
- •Конденсация Перкина
- •Конденсация Кляйзена-Тищенко
- •Лекция № 33 Карбонильные соединения
Алкилирование и ацилирование по Фриделю-Крафтсу
В фенольном ряду эти реакции имеют некоторые особенности, связанные с тем, что фенолы образуют комплексы с кислотами Льюиса и дальнейшая реакция алкилирования не происходит.

Поэтому сначала проводят О-алкилирование фенола, затем С-алкилирование или ацилирование по Фриделю-Крафтсу, после чего регенерируют ОН-группу.
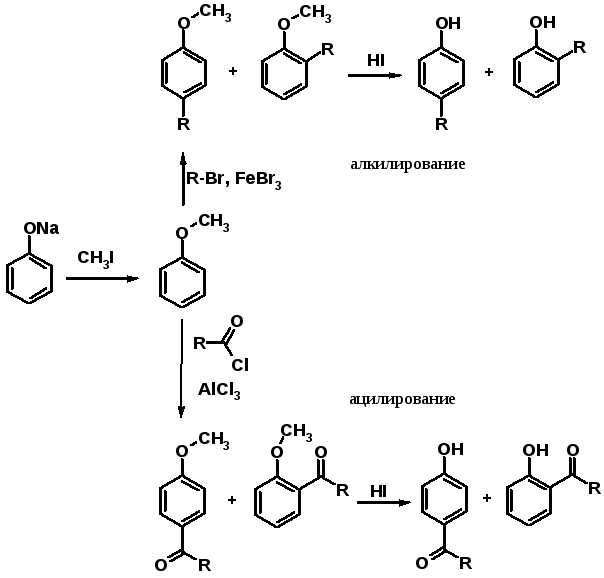
Известный индикатор – фенолфталеин – продукт ацилирования фенола фталевым ангидридом.

Активирующие свойства гидроксильной группы в фенолах столь велики, что позволяют осуществлять превращения, невозможные в бензольном ряду.
Карбоксилирование (реакция Кольбе-Шмитта)
Фенолят-анионы способны вступать в реакцию ароматического электрофильного замещения со столь слабым электрофилом как оксид углерода IV(углекислый газ).
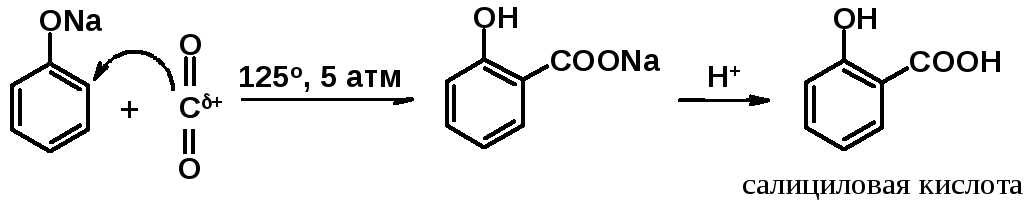
Реакция Кольбе-Шмитта промышленный метод получения салициловой кислоты, предшественника широко распространенного лекарства – ацетилсалициловой кислоты (аспирина).
Формилирование (реакция Раймера-Тимана)
Нагревание фенола с хлороформом в присутствии щелочи приводит к введению в орто-положение бензольного кольца альдегидной группы. Электрофилом в этой реакции является дихлоркарбен (:ССl2), образующийся при взаимодействии хлороформа со щелочью. Далее проходит обычная реакцияSEAr. В условиях реакции дихлорбензильное производное гидролизуется, затем отщепляет молекулу воды, превращаясь в альдегид.

Лекция № 29 Простые эфиры.
Диалкиловые эфиры. Классификация, изомерия, номенклатура. Физические свойства. Химические свойства: образование оксониевых солей, расщепление кислотами, автоокисление. Получение межмолекулярной дегидратацией спиртов и действием алкилгалогенидов на алкоголяты. Получение и применение в синтезе краун-эфиров. Виниловые эфиры. Получение, гидролиз и причины легкости его протекания, полимеризация.
Простые циклические эфиры. Эпоксисоединения: получение, реакции с водой, спиртами, галогеноводородами, аммиаком и аминами, реактивами Гриньяра. Тетрагидрофуран, диоксан.
Токсикологические свойства и техника безопасности при работе с простыми эфирами.
Тиоаналоги спиртов, фенолов и эфиров.
Общая характеристика, номенклатура. Получение алкилтиолов реакцией алкилирования сероводорода и его солей. Получение арентиолов восстановлением аренсульфонилхлоридов. Физические свойства тиолов, полярность связи S-H. Кислотные свойства тиолов, реакции алкилирования и окисления. Диметилсульфоксид. Тиоэфиры (сульфиды), их получение, физические свойства. Реакции алкилирования и окисления тиоэфиров. Токсичность бис(2-хлорэтил)сульфида. Техника безопасности при работе с органическими соединениями серы. Антидоты.
Простые эфиры
Простыми эфирами называют соединения общей формулы R-O-R’, гдеRиR’ углеводородные радикалы. Простые эфиры бывают алифатическими, ароматическими, смешанными, симметричными и несимметричными, а также циклическими.

Получение
Некоторые способы получения эфиров: межмолекулярной дегидратацией спиртов, синтезом Вильямсона в спиртах и фенолах и присоединением спиртов к алкинам были рассмотрены ранее.
Часто используют методы, которые можно назвать «модифицированными синтезами Вильямсона», заключающиеся во взаимодействии алкоксид аниона с алкилирующими агентами. К наиболее распространенным алкилирующим агентам относятся диметилсульфат и эфиры пара-толуолсульфокислоты.

Эфиры могут быть получены также получены присоединением спиртов к алкенам в присутствии кислот Льюиса при нагревании и повышенном давлении.

Получение оксиранов см. раздел «Алкены». Пяти- и шестичленные циклы с эфирным кислородом получают внутримолекулярной дегидратацией 1,4- или 1,5-диолов, соответственно.

Свойства простых эфиров весьма ограничены. Их очень часто используют в качестве растворителей (например, при получении реактивов Гриньяра). Избыток электронной плотности на эфирном кислороде приводит к появлению нуклеофильных и основных свойств. Основность простых эфиров очень мала, оксониевые соли образуются исключительно в безводной среде и устойчивы только при пониженных температурах.

Алкиловые эфиры образуют устойчивые комплексы с кислотами Льюиса. Комплексы с трифторидом бора используют для получения борфторида триэтилоксония – очень мощного алкилирующего агента. С его помощью алкилируют соединения с самой низкой реакционной способностью.

Основность эфиров проявляется в способности избирательно образовывать комплексы с металлами. С этой целью используют макроциклические полиэфиры – краун-эфиры (англ. crown– корона).

Использование краун-эфиров позволяет растворять в неполярных органических растворителях высокополярные неорганические вещества и проводить невозможные в других условиях реакции.
