
4 курс / Фак. Педиатрия, эндокринология / Кафедра №1 / Статья про АтД
.pdf
Обзор литературы |
Review |
Клиническая дерматология и венерология |
Russian Journal of Clinical Dermatology and Venereology = |
2019, т. 18, № 3, с. 259-367 |
Klinicheskaya dermatologiya i venerologiya 2019, vol. 18, no 3, pp. 259-367 |
https://doi.org/10.17116/klinderma201918031259 |
https://doi.org/10.17116/klinderma201918031259 |
Современные аспекты патогенеза и терапии атопического дерматита
© Н.Н. ПОТЕКАЕВ, Д.Н. СЕРОВ, И.А. МИХАЙЛОВА, Л.С. АНОХИНА, К.Ю. ФЕДОТОВА, Н.Г. ГЕОРГАДЗЕ
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы,
Москва, Россия
РЕЗЮМЕ
Атопический дерматит (АтД) — широко распространенный хронический дерматоз мультифакториальной природы с превалирующей
долей генетического компонента и сложным патогенезом. Манифестация АтД обычно начинается в младенчестве или раннем дет-
стве; заболевание может поражать 15—25% всех детей, но с возрастом значительная часть пациентов достигают ремиссии. Во взрос-
лой популяции АтД подвержены порядка 7—10% пациентов. Это заболевание характеризуется сильным зудом, рецидивирующими
экзематозными поражениями и интермиттирующим течением. Несколько патофизиологических механизмов вносят вклад в клинические проявления АтД. Например, нарушение эпидермальной барьерной функции вследствие дефицита структурного белка
филаггрина, может способствовать воспалению и инфильтрации Т-клетками. При АтД наблюдается поляризация иммунного ответа
по Th2-пути, и это в свою очередь может способствовать дисфункции эпидермального барьера. Другие факторы, способствующие
возникновению АтД, включают дисбиоз микробиоты кожи (в частности, избыточную колонизацию золотистого стафилококка), си-
стемные иммунные реакции (включая сенсибилизацию, опосредованную иммуноглобулином Е). С течением времени концепция патогенеза этого заболевания претерпевала значительные изменения. В настоящей статье приведен актуальный обзор исторических и
современных представлений о патогенезе и методах лечения атопического дерматита.
Ключевые слова: атопический дерматит, аллергия, патогенез, цитокины, кожа, Т-клетки, дупилумаб, омализумаб.
Потекаев Н.Н. — https://orcid.org/0000-0002-9578-5490 Серов Д.Н. — https://orcid.org/0000-0001-7760-1363 Михайлова И.А. — https://orcid.org/0000-0002-4254-4036 Анохина Л.С. — https://orcid.org/0000-0001-9004-9761 Федотова К.Ю. — https://orcid.org/0000-0003-3170-6033 Георгадзе Н.Г. — https://orcid.org/0000-0003-2758-4002
КАК ЦИТИРОВАТЬ:
Потекаев Н.Н., Серов Д.Н., Михайлова И.А., Анохина Л.С., Федотова К.Ю., Георгадзе Н.Г. Современные аспекты патогенеза и терапии атопического дерматита. Клиническая дерматология и венерология. 2019;18(3):259-263. https://doi.org/10.17116/klinderma201918031259
Current aspects of pathogenesis and treatment of atopic dermatitis
© N.N. POTEKAEV, D.N. SEROV, I.A. MIKHAILOVA, L.S. ANOKHINA, K.YU. FEDOTOVA, N.G. GEORGADZE
Moscow Research and Practical Center for Dermatovenereology and Cosmetology, Department of Healthcare, Moscow, Russia
ABSTRACT
Atopic dermatitis (AtD) is a common chronic dermatosis of multifactorial nature with prevalence of genetic component and complex pathogenesis. AtD manifestation usually starts from an infancy or early childhood; it may affect 15—25% of all children, but a considerable amount of patients resolves with age. 7—10% of adult population are susceptible to AtD. This disease is characterized by a severe itch, recurring eczematous lesions and intermittent course. Several pathophysiological mechanisms contribute to AtD clinical manifestations. For example, an impairment of epidermal barrier function, due to the deficiency of the structural protein filaggrin, can promote inflammation and T-cell infiltration. There is a polarization of an immune response in case of AtD in Th2-way, thus may lead to an epidermal barrier disruption. Other contributing factors to AtD onset include dysbiosis of the skin microbiota (in particular overgrowth of Staphylococcus aureus), systemic immune responses (including immunoglobulin E — mediated sensitization). Over time, the pathogenesis concept of this disease has undergone significant changes. This article provides an up-to-date overview of historical and current view of the pathogenesis and treatment options of atopic dermatitis.
Keywords: atopic dermatitis, allergy, pathogenesis, cytokines, skin, T-cells, dupilumab, omalizumab.
Potekaev N.N. — https://orcid.org/0000-0002-9578-5490
Serov D.N. — https://orcid.org/0000-0001-7760-1363
Mikhailova I.A. — https://orcid.org/0000-0002-4254-4036
Anokhina L.S. — https://orcid.org/0000-0001-9004-9761
Fedotova K.Yu. — https://orcid.org/0000-0003-3170-6033
Georgadze N.G. — https://orcid.org/0000-0003-2758-4002
TO CITE THIS ARTICLE:
Potekaev NN, Serov DN, Mikhailova IA, Anokhina LS, Fedotova KYu, Georgadze NG. Current aspects of pathogenesis and treatment of atopic dermatitis. Russian Journal of Clinical Dermatology and Venereology = Klinicheskaya dermatologiya i venerologiya. 2019;18(3):259-263. (In Russ.). https://doi.org/10.17116/klinderma201918031259
Автор, ответственный за переписку: Серов Д.Н. — |
Corresponding author: Serov D.N. — e-mail: prurigo@mail.ru |
e-mail: prurigo@mail.ru |
|
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
259 |
Обзор литературы |
Review |
|
|
|
|
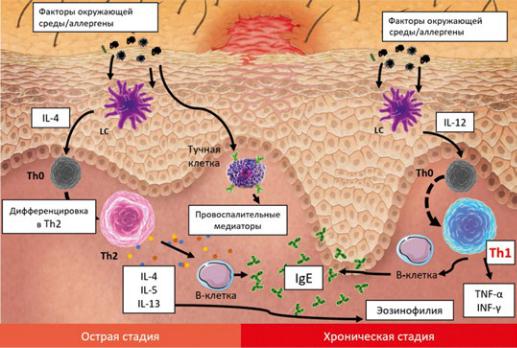
Рис. 1. Раннее представление о патогенезе АтД [7, 9, 10].
Примечание. LC — клетка Лангерганса; IL — интерлейкин; Th — Т-хелпер; TNF-α — фактор некроза опухоли α; INF-γ — интерферон γ; IgE — иммуноглобулин Е.
Fig. 1. Earlier view of pathogenesis of atopic dermatitis.
Атопический дерматит (АтД) — мультифактори- |
барьерной функции кожи, сенсибилизацией к ал- |
альное воспалительное заболевание кожи, характе- |
лергенам и рецидивирующими кожными инфекци- |
ризующееся зудом, хроническим рецидивирующим |
ями [4]. Следует отметить, что данный дерматоз яв- |
течением и возрастными особенностями локализа- |
ляется гетерогенным заболеванием, обусловленным |
ции и морфологии очагов поражения. |
действием факторов окружающей среды у генетиче- |
АтД — заболевание, известное человечеству со |
ски восприимчивых лиц [5]. Дисбактериоз микро- |
времен Гиппократа, является значимой медико-со- |
биоты кожи также может играть роль в патогенезе |
циальной проблемой настоящего времени [1]. Из |
АтД [3]. На основании множества наблюдений бы- |
учение патогенеза, концепций и подходов к лечению |
ло установлено, что АтД является кожным проявле- |
сохраняет актуальность. |
нием системного расстройства и часто проявляется |
Продолжительное время заболевание имело |
как первый шаг в так называемом атопическом мар- |
более ста обозначений, но в 1923 г. Coca и Cooke |
ше, который включает бронхиальную астму, пище- |
предложили термин «atopia» (греч.: странность, не- |
вую аллергию и аллергический ринит [7]. |
обычность, без места) для определения состояния |
Патогенез атопического дерматита |
гиперчувствительности при поллинозе, астме, «ато- |
|
пической экземе», а позже, в 1933 г., благодаря Wize |
Патогенез АтД — многофакторный, с ведущей |
и Sulzberger, заболевание получило современное на- |
ролью иммунных нарушений [8]. Известно, что не- |
звание «атопический дерматит» [1, 2]. |
атопические реципиенты, получающие трансплан- |
Манифестация симптомов заболевания происхо- |
тацию костного мозга от атопических доноров, не- |
дит под воздействием разнообразных экзогенных и |
медленно получают положительные кожные пробы |
эндогенных факторов, преимущественно у детей |
и атопические симптомы. Эти данные свидетель- |
первых лет жизни. Течение АтД имеет рецидивиру- |
ствуют, что проявления АтД опосредуются клет- |
ющий характер, что может обусловить психологиче- |
ками, происходящими из костного мозга [9]. Ши- |
ский дисбаланс при формировании личности и сни- |
роко известно, что кожа пациентов с АтД является |
жение качества жизни в более зрелом возрасте [3]. |
гистологически аномальной и демонстрирует уме- |
Клинические проявления характеризуются эри- |
ренный гиперкератоз и редкий периваскулярный |
тематозными, экссудативными и лихеноидными вы- |
клеточный инфильтрат, состоящий в основном из |
сыпаниями, сопровождающимися интенсивным зу- |
T-лимфоцитов. Острые поражения характеризуют- |
дом [3—6]. АтД часто ассоциирован с аномалиями |
ся выраженным межклеточным отеком (спонгиоз) |
260 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |
Обзор литературы |
Review |
|
|
|
|
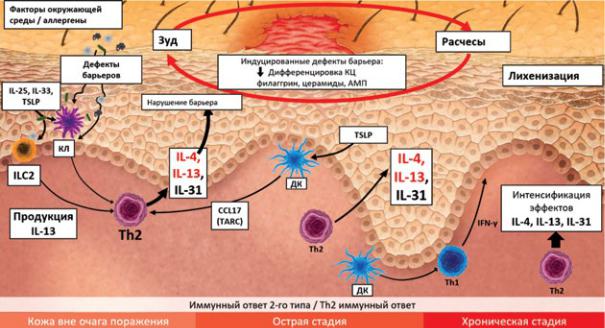
Рис. 2. Современное представление о патогенезе АтД [16—18].
Примечание. ДК — дендритная клетка; ILC2 — врожденная лимфоидная клетка 2-го типа; TSLP — тимусный стромальный лимфопоэтин; АМП — антимикробные пептиды; TARC — тимус-ассоциированный регуляторный хемокин; КЛ — клетка-лейкоцит.
Fig. 2. Current view of pathogenesis of atopic dermatitis.
эпидермиса и редким эпидермальным инфильтратом, состоящим преимущественно из Т-лимфоцитов. В дерме имеется выраженный инфильтрат воспалительных клеток, состоящий преимущественно из Т-лимфоцитов и редких моноцит-макрофагов [9].
Ранее считали, что в основе патогенеза данного заболевания лежит функциональный иммунодефицит, который проявляется изменением соотношения лимфоцитов Th1/Th2 в сторону Th2-хелперов, эозинофилией, дисбалансом продукции сывороточных иммуноглобулинов, приводящим к стимуляции В-лимфоцитов с гиперпродукцией IgE и снижению IgA и IgG, т.е. увеличение IL-4, IL-5 и IL-13 с сопутствующим снижением экспрессии IFN-γ (рис. 1) [5, 9].
Согласно современной схематической концепции, установленной причиной нарушения эпидермального барьера кожи также является унаследованный дефицит белка филаггрина, что приводит к повышению экспрессии провоспалительных цитокинов
(рис. 2) [11].
Дисфункция эпидермального барьера, наблюдаемая у пациентов с АтД, может выражаться через первичные (мутации FLG) и/или вторичные механизмы (пониженная экспрессия эпидермальных структурных белков или липидов) [12]. В ответ на действие иммунных цитокинов типа 2 (IL-4, IL-13 и IL-33) наблюдается несколько эпидермальных изменений как в пораженной, так и здоровой коже пациентов с АтД [13—15]:
—повышение рН;
—снижение содержания воды;
—легкая раздражительность;
—повышенная проницаемость для химических веществ с низкой молекулярной массой;
—повышенная восприимчивость к инфекциям. Также были выявлены как минимум две формы
АтД.
«Внешняя» форма связана с сенсибилизацией, опосредованной IgE (у 70—80% пациентов). При внешней форме Т-клетки памяти продуцируют повышенное количество цитокинов Th2. К ним относятся IL-4 и IL-13, которые, как известно, вызывают переключение изотипа на синтез IgE, а также IL-5, который играет важную роль в развитии и выживании эозинофилов. Эти T-клетки также продуцируют аномально низкие уровни IFN-γ, цитокина Th1, который ингибирует функцию клеток Th2.
«Внутренняя» форма без опосредованной IgE сенсибилизации (20—30% пациентов) связана с меньшей выработкой IL-4 и IL-13, чем внешняя [7].
Обе формы связаны с эозинофилией. Следовательно, клетки Th2 играют важную роль в развитии атопического кожного процесса на ранних стадиях. Способность клеток Th0 развиваться в пути Th1 или Th2 зависит от ряда детерминант, включая среду цитокинов, в которой происходит развитие Т-клеток, генетический фон хозяина, фармакологические факторы и ко-стимуляторные сигналы, используемые во время активации Т-клеток. К цитокиновым факто-
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
261 |
Обзор литературы |
Review |
рам относятся цитокины, присутствующие во время воздействия антигена и являющиеся одной из основных детерминант, направляющих Th-клетки к фенотипу Th1 или Th2. IL-4 способствует развитию клеток Th2, тогда как IL-12, продуцируемый макрофагами или дендритными клетками, индуцирует клетки Th1.
Одно из главных мест в теории патогенеза АтД отдано генетическим факторам. Известно, что более 20 генов могут участвовать в развитии аллергических заболеваний. Особый интерес вызывает потенциальная роль хромосомы 5q31—33, содержащая кластерное семейство генов цитокинов: IL-3, IL-4, IL-5, IL-13 и GM-CSF, которые экспрессируются клетка-
ми Th2.
Фармакологические факторы: лейкоциты от пациентов с АтД имеют повышенную активность фермента цАМФ-фосфодиэстеразы. По-видимому, эта клеточная аномалия способствует увеличению синтеза IgE B-клетками и продукции IL-4 T-клетками, так как продукция IgE и IL-4 может быть уменьшена ингибитором фосфодиэстеразы [9].
Следует отметить, что повышенная концентрация цАМФ-фосфодиэстеразы в атопических моноцитах способствует секреции повышенных уровней IL-10 и простагландина E2 [19]. ИЛ-10, полученный из моноцитов, и простагландин E2 ингибируют продукцию IFN-γ Т-клетками и, следовательно, могут способствовать снижению продукции IFN-γ. Костимуляторные факторы (активация покоящихся Т-клеток) требуют ко-стимулирующих сигналов, не зависящих от вовлечения рецепторов Т-клеток с комплексом МНС плюс пептид на антиген-презен- тирующих клетках [8]. Несколько исследований на мышах показали, что образование клеток Th2 зависит главным образом от взаимодействия CD28 с B7. Экспрессия В7 на В-клетках пациентов с АтД была значительно выше, чем у нормальных субъектов и пациентов с псориазом [9].
Принципы терапии атопического дерматита
Успешная терапия АтД требует системного подхода и включает следующие мероприятия.
—Элиминационные — предотвращение контакта с раздражителями, в том числе продуктами питания и бытовыми аллергенами.
—Вне зависимости от тяжести течения заболевания при необходимости лечение дополняют антигистаминными препаратами, антибактериальными, противовирусными и антимикотическими средствами.
—Назначение смягчающих и увлажняющих средств для восстановления нарушенной функции барьера кожи. В настоящее время известно, что добавление «церамид-доминантного» смягчающего средства к стандартной терапии приводит как к клиническому улучшению, так и уменьшению трансэпидермальной потери воды и улучшению целостности
рогового слоя. Данные средства также эффективно использовать в качестве поддерживающей терапии
впериод ремиссии.
—Топические глюкокортикоиды являются основой противовоспалительного лечения, показывают высокую эффективность в борьбе с острым и хроническим воспалением кожи при ограниченных поражениях. Из-за опасений по поводу возможных побочных эффектов, связанных с постоянным применением, данные препараты не использовались для поддерживающей терапии.
—Ингибиторы кальциневрина в отличие от топических глюкокортикоидов абсолютно безопасны при поражении кожи лица и век. В нескольких исследованиях крема пимекролимус также выявлено, что начало применения препарата при самых ранних признаках клинического заболевания приводит к значительно меньшей потребности в «спасательной» терапии глюкокортикоидами.
—При течении средней тяжести актуально использование фототерапии.
—При тяжелом течении АтД, кроме топических средств, лечение включает системные глюкокортикоиды короткими курсами и циклоспорин. В 55% случаев его применения положительный эффект наступает после 6—8 нед. Непрерывная терапия не рекомендована более 1 года—2 лет, так как циклоспорин обладает потенциальной токсичностью.
—Биологическая терапия в лечении АтД. Дупилумаб — антитело, блокирующее действие
IL-4 и IL-13 путем воздействия на α-субъединицу рецептора IL-4 (IL-4Rα). Этот рецептор взаимодействует с двумя цитокинами: IL-4 и IL-13, которые играют важную роль в иммунном ответе с участием Т-хелперов 2-го типа при АтД. При этом эффекты, достигнутые при применении терапии, направленной на ингибирование IL-4Rα, IL-4 и IL-13, были воспроизведены в серии крупных клинических исследований, в которых были продемонстрированы высокая эффективность терапии и благоприятный профиль безопасности. Действие дупилумаба основано на ингибировании α-субъединицы IL-4Rα [20, 21].
Также недавно было выявлено, что омализумаб является наиболее эффективным препаратом в лечении атопической бронхиальной астмы. Таким образом, он может потенциально нейтрализовать действие IgE при АтД [7]. Пациенты, получавшие рекомбинантный гуманизированный моноклональный IgG1 (омализумаб) в течение 16 нед, не испытывали улучшений в конечных точках заболевания. Кроме того, у пролеченых пациентов отмечалось незначительное ухудшение показателей зуда [20].
В многочисленных клинических исследованиях показано, что воздействие на ключевой центральный путь может оказать существенное терапевтическое воздействие на аллергические заболевания, характе-
262 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |

Обзор литературы Review
ризующиеся различными специфическими клини- |
лечения АтД. Таким образом, очень важно глубже |
ческими проявлениями. При АтД снижение уровней |
охарактеризовать ключевые моменты иммунных |
свободного сывороточного IgE недостаточно для до- |
путей, включая идентификацию генов восприим- |
стижения хорошего клинического ответа. Таким об- |
чивости, которые приводят к различным формам |
разом, роль, которую играют определенные клетки и |
АтД, а также определить относительную роль им- |
цитокины, создает возможности для развития таргет- |
мунных нарушений и структурных дефектов кож- |
ной терапии АтД. |
ного барьера, лежащих в основе АтД. Новые пара- |
|
дигмы лечения необходимы для предотвращения |
Заключение |
прогрессирования заболевания до более тяжелых |
|
форм и прекращения развития «атопического мар- |
Нашей главной целью в будущем станет разра- |
ша», который в свою очередь приводит к бронхи- |
ботка более эффективных и безопасных методов |
альной астме [7]. |
Авторы заявляют об отсутствии конфликта интересов. |
The authors declare no conflicts of ineterest. |
ЛИТЕРАТУРА/REFERENCES
1.Bhattacharya T, Strom MA, Lio PA. Historical Perspectives on Atopic Dermatitis: Eczema Through the Ages. Pediatr Dermatol. 2016;33(4):375379.
https://doi.org/10.1111/pde.12853
2.Kramer ON, Strom MA, Ladizinski B, Lio PA. The history of atopic dermatitis. Clin Dermatol. 2017;35(4):344-348. https://doi.org/10.1016/j.clindermatol.2017.03.005
3.Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Prim. 2018;4(1):1. https://doi.org/10.1038/s41572-018-0001-z
4.Fitzpatrick’s Dermatology in General Medicine Ninth Edition. McGraw-Hill. 2017.
https://doi.org/10.1017/CBO9781107415324.004
5.Кожные и венерические болезни: Учебник. Под ред. Иванова О.Л. 2-е изд., Стереотипное. М. 2010.
Kozhnye i venericheskie bolezni: Uchebnik. Pod red. Ivanova OL. 2-e izd. Stereotipnoe. M. 2010. (In Russ.).
6.Hanifin JM, Rajka G. Diagnostic Features of Atopic Dermatitis. Acta Dermatovener. 1980.
7.Leung DYM, Boguniewicz M, Howell MD, Nomura I, Hamid QA. New insights into atopic dermatitis. J Clin Invest. 2004;113(5):651-657. https://doi.org/10.1172/JCI200421060
8.Novak N, Kraft S, Bieber T. Unraveling the mission of FcepsilonRI on an- tigen-presenting cells. J Allergy Clin Immunol. 2003;111(1):38-44. Accessed April 2, 2019
http://www.ncbi.nlm.nih.gov/pubmed/12532094
9.Leung D. Pathogenesis of atopic dermatitis. J Allergy Clin Immunol. 1999; 104(3):S99-S108.
https://doi.org/10.1016/S0091-6749(99)70051-5
10.Laske N, Niggemann B. Does the severity of atopic dermatitis correlate with serum IgE levels? Pediatr Allergy Immunol. 2004;15(1):86-88. Accessed April 2, 2019
http://www.ncbi.nlm.nih.gov/pubmed/14998387
11.Boguniewicz M, Leung DYM. Atopic dermatitis: a disease of altered skin barrier and immune dysregulation. Immunol Rev. 2011;242(1):233-246. https://doi.org/10.1111/j.1600-065X.2011.01027.x
12.Toda M, Leung DYM, Molet S, et al. Polarized in vivo expression of IL-11 and IL-17 between acute and chronic skin lesions. J Allergy Clin Immunol. 2003;111(4):875-881. Accessed April 2, 2019. http://www.ncbi.nlm.nih.gov/pubmed/12704372
13.Akdis M, Trautmann A, Klunker S, et al. T helper (Th) 2 predominance in atopic diseases is due to preferential apoptosis of circulating memory/effector Th1 cells. FASEB J. 2003;17(9):1026-1035. https://doi.org/10.1096/fj.02-1070com
14.Brandt BE. Th2 Cytokines and Atopic Dermatitis. J Clin Cell Immunol. 2011;02(03):1-25.
https://doi.org/10.4172/2155-9899.1000110
15.Gittler JK, Shemer A, Suárez-Fariñas M, et al. Progressive activation of TH2/TH22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol. 2012;130(6):13441354.
https://doi.org/10.1016/j.jaci.2012.07.012
16.Noda S, Krueger JG, Guttman-Yassky E. The translational revolution and use of biologics in patients with inflammatory skin diseases. J Allergy Clin Immunol. 2015;135(2):324-336.
https://doi.org/10.1016/j.jaci.2014.11.015
17.Gandhi NA, Bennett BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
https://doi.org/10.1038/nrd4624
18.Wynn TA. Type 2 cytokines: mechanisms and therapeutic strategies. Nat Rev Immunol. 2015;15(5):271-282.
https://doi.org/10.1038/nri3831
19.Nomura I, Gao B, Boguniewicz M, Darst MA, Travers JB, Leung DYM. Distinct patterns of gene expression in the skin lesions of atopic dermatitis and psoriasis. J Allergy Clin Immunol. 2003;112(6):1195-1202. https://doi.org/10.1016/j.jaci.2003.08.049
20.Simpson EL, Bieber T, Guttman-Yassky E, et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24): 2335-2348.
https://doi.org/10.1056/NEJMoa1610020
21.Blauvelt A, de Bruin-Weller M, Gooderham M, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017; 389(10086):2287-2303.
https://doi.org/10.1016/S0140-6736(17)31191-1
Поступила в редакцию 02.04.19 Received 02.04.19 Принята к печати 30.04.19 Accepted 30.04.19
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
263 |
