- •Лабораторная работа №1 инструкция по технике безопасности, для работающих в лабораториях физики общие положения
- •Основные положения.
- •Надзор.
- •Меры оказания первой помощи при несчастных случаях
- •Введение в теорию измерений физических величин
- •Лабораторная работа №2 определение породы древесины по плотности
- •Теоретическое введение
- •Контрольные вопросы:
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы:
- •Лабораторная работа №4
- •Введение
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 5 определение коэффициента внутреннего трения жидкости по методу стокса
- •Введение
- •Контрольные вопросы
- •Лабораторная работа №6 определение отношения молярных теплоемкостей воздуха методом клемана – дезорма
- •Введение
- •Контрольные вопросы
- •Лабораторная работа №7
- •Контрольные вопросы
- •Лабораторная работа №8 определение коэффициента поверхностного натяжения жидкости
- •Контрольные вопросы
- •Лабораторная работа№ 9 определение изменения энтропии
- •Теоретическое введение
- •Лабораторная работа №10 изучение электроизмерительных приборов
- •Чувствительность и цена деления электроизмерительного прибора
- •Погрешности приборов
- •Классификация приборов по принципу действия магнитоэлектричекская система
- •Электромагнитная система
- •Электродинамическая система
- •Вибрационная система
- •Многопредельные приборы
- •Правила пользования многопредельными приборами
- •Условные обозначения систем электроизмерительных приборов
- •Условные графические обозначения
- •Лабораторная работа №11 определение сопротивления проводников с помощью моста уитстона
- •Введение
- •1) Для ветви acb
- •2) Для ветви adb
- •Порядок выполнения работы
- •Лабораторная работа №12 изучение зависимости мощности и к. П. Д. Источника тока от напряжения на нагрузке.
- •Введение
- •Последовательность выполнения работы.
- •Контрольные вопросы:
- •Лабораторная работа №13 определение числа фарадея и заряда электрона
- •Введение
- •Порядок выполнения работы
- •Контрольные вопросы
- •Описание лабораторной установки
- •Порядок измерений.
- •Контрольные вопросы.
- •Лабораторная работа №15 определение емкости конденсатора с помощью переменного тока.
- •Порядок выполнения расчетов.
- •Контрольные вопросы:
- •Лабораторная работа №16 определение горизонтальной составляющей индукции магнитного поля земли
- •Введение
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №17 эффект холла
- •Теоретическое введение.
- •Порядок работы
- •Контрольные вопросы
- •Лабораторная работа №18 изучение гармонических колебаний
- •Введение
- •Определить ускорение силы тяжести
- •Контрольные вопросы
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №20 изучение рефрактометра и определение показателя преломления прозрачных веществ
- •Введение
- •Описание прибора и методика измерения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №21 измерение радиуса кривизны линзы и длин световых волн при помощи интерференционных колец ньютона
- •Введение
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №22 изучение явления дифракции и определение длины волны света при помощи дифракционной решетки
- •Введение
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №23
- •Введение
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №24
- •Введение
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №25 изучение линейчатых спектров. Градуировка спектроскопа и определение постоянной ридберга по спектру гелия
- •Введение
- •Порядок выполнения работы
- •Контрольные вопросы
- •Содержание:
Контрольные вопросы
1. Что называется коэффициентом внутреннего трения?
2. Какова единица измерения коэффициента вязкости в системе СИ?
3. В чем сущность метода Стокса определения коэффициента вязкости?
4. Влияет ли температура жидкости на коэффициент вязкости?
5. Зависит ли от размера шарика коэффициент вязкости жидкости?
Лабораторная работа №6 определение отношения молярных теплоемкостей воздуха методом клемана – дезорма
Цель
работы: определить
![]() для
воздуха.
для
воздуха.
Приборы и принадлежности: прибор Клемана - Дезорма, насос, манометр.
Введение
Для характеристики тепловых свойств тел в термодинамике широко используют понятие теплоемкости. Теплоемкостью тела называют отношение количества сообщенной ему теплоты Q к соответствующему изменению температуры тела Т. Эксперименты и расчеты показывают, что теплоемкость тела зависит от его химического состава, массы и термодинамического состояния, а также от вида процесса изменения состояния тела при сообщении ему теплоты.
Для однородных тел удобно пользоваться удельной и молярной теплоемкостями. Удельной теплоемкостью называют физическую величину С, численно равную количеству теплоты, которое необходимо сообщить единице массы вещества для изменения его температуры на 1К, в рассматриваемом термодинамическом процессе.
![]() (1)
(1)
Удельная теплоемкость вещества не зависит от массы вещества, содержащегося в теле. В системе СИ удельная теплоемкость измеряется в джоулях деленных на килограмм – кельвин, что обозначается сокращенно Дж/кгК.
Молярной теплоемкостью называют физическую величину С , численно равную количеству теплоты, которую необходимо сообщить одному молю вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе. Очевидно, что
![]() (2)
(2)
где - молярная масса вещества,
С – удельная теплоемкость
Для газов надо учитывать, при каких условиях они нагреваются. Различают теплоемкость газов при постоянном давлении и при постоянном объеме. Нагревание газа при постоянном объеме (изохорический процесс) приводи к тому, что все тепло идет на увеличение внутренней энергии газа. В этом случае работа не совершается. Из первого закона термодинамики следует что,
U=Q (3)
Учитывая, что внутренняя энергия одного моля газа равна
![]() (4)
(4)
и используя уравнение (2), получим после преобразования
![]() (5)
(5)
где I – число свободы молекул газа,
R – универсальная газовая постоянная, R=8,31Дж/(мольК)
При нагревании газа при постоянном давлении (изобарический процесс) газ расширяется; сообщаемое ему извне тепло идет не только на увеличение запаса его внутренней энергии U, но и на совершение работы против внешних сил А. Таким образом, теплоемкость при постоянном давлении СР больше теплоемкости при постоянном объеме СV, на ту работу А, которую совершает один моль газа при расширении вследствие нагревания его на 1 К при Р=const. Известно, что при этих условиях А=R, отсюда
![]() (6)
(6)
подставив в (6) уравнение (5), получим
![]() (7)
(7)
Пользуясь соотношением (2) между удельными и молярными теплоемкостями, находим для удельных теплоемкостей
![]() и
и
![]()
Отношение удельных и молярных теплоемкостей при постоянном давлении и постоянном объеме обозначают (показатель адиабаты).
![]() (8)
(8)
Это отношение зависит только от числа степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного i=5, для трехатомного и многоатомного i=6.
Отношение теплоемкостей в термодинамике имеет большое значение. Оно входит в уравнение Пуассона, которое описывает адиабатическое расширение газа.
![]() (9)
(9)
Одним из основных простых методов определения является методом адиабатического расширения. (метод Клемана – Дезорма). В работе определяется для воздуха (двухатомный газ).
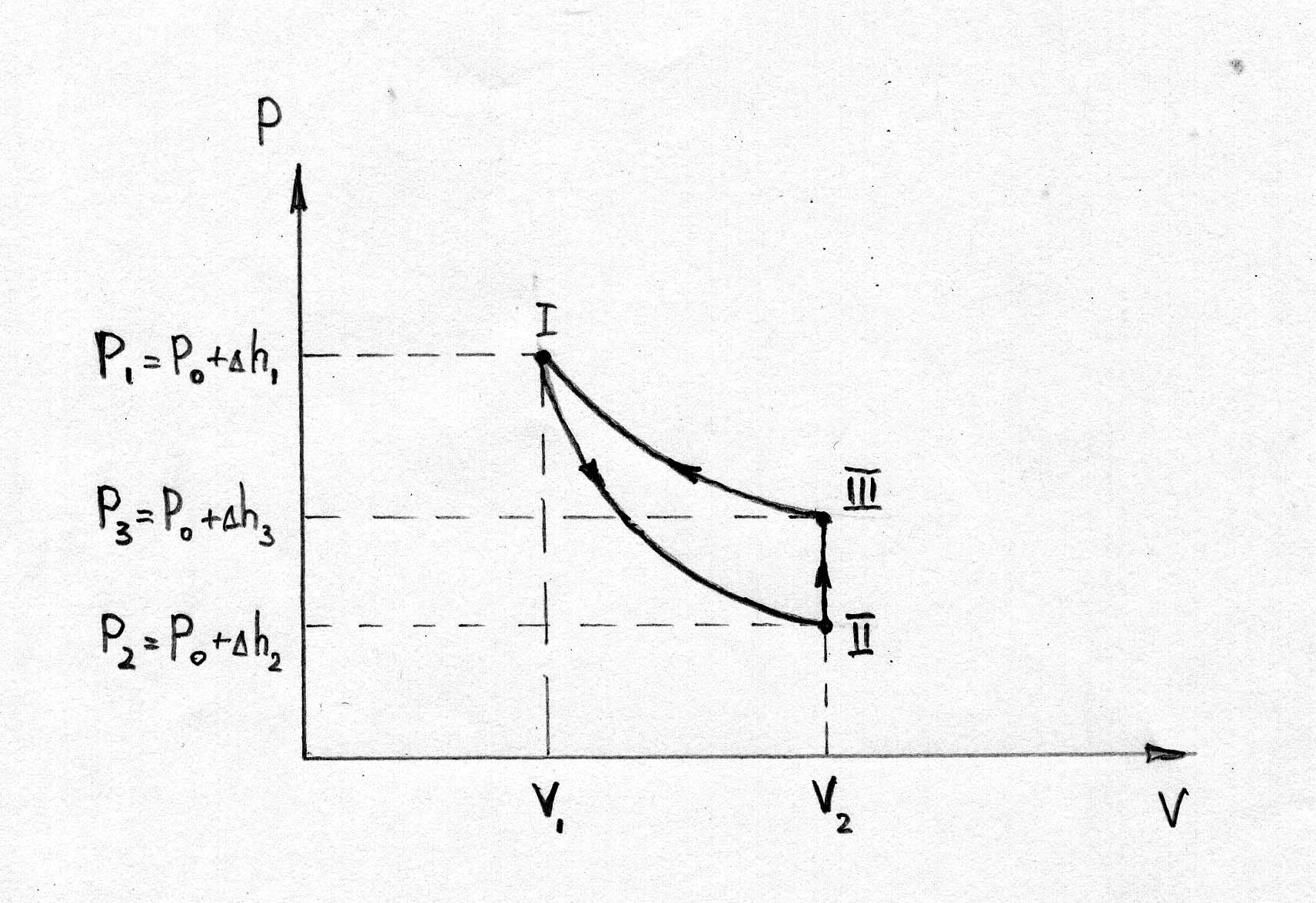
Рисунок 2.
Если от какого – то состояния I (рис. 2.), при котором температура газа в сосуде равна температуре окружающего воздуха Т1 (3-5 минут давления в сосуде не изменилось), увеличить (или уменьшить объем газа V, то давление, которое было Р1=Р0+h1 станет Р2=Р0+h2. Если изменение объема происходит достаточно быстро (за 1-2 с.), то теплообмен между газом в сосуде и окружающей средой не успевает произойти и расширение (сжатие) происходит адиабатически, т.е. параметры газа в I и II состояниях связаны уравнением Пуассона:
Р1V1
= Р2V2
или
 (10)
(10)
Вследствии теплообмена с окружающей средой температура газа с сосуде ставшая Т1, а давление станет Р3.
Параметры газа в состояниях с одинаковыми температуры связаны уравнением Бойля – Мариотта (см. рис. 8.2.) кривая III и II – изотерма.
![]() т.е.
т.е.
![]()
Возведя обе части в степень получим
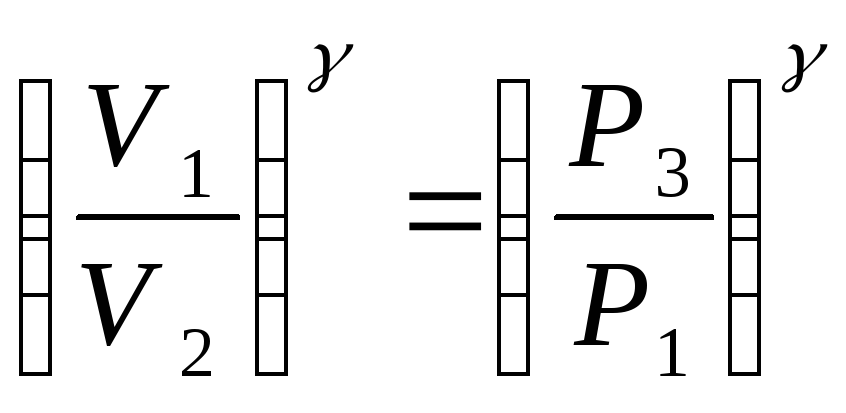 (11)
(11)
Из
(10) и (11) получаем

Логарифмируя и решая относительно получим
![]()
Учитывая, что Р1, Р2 и Р3 мало отличаются друг от друга, можно записать
![]()
Или, учитывая, что
![]() ;
;
![]() ;
;![]()
можем
записать
![]()
Таким образом, измеряя h1, h2 и h3 – разность уровней воды в манометре, соответствующие начальному состоянию - h1, быстрому расширению - h2 (сжатию) и спустя 3-5 минут после расширения - h3 (сжатия), можно рассчитать значение .
ОПИСАНИЕ УСТАНОВКИ И МЕТОДИКА ВЫПОЛНЕНИЯ РАБОТЫ
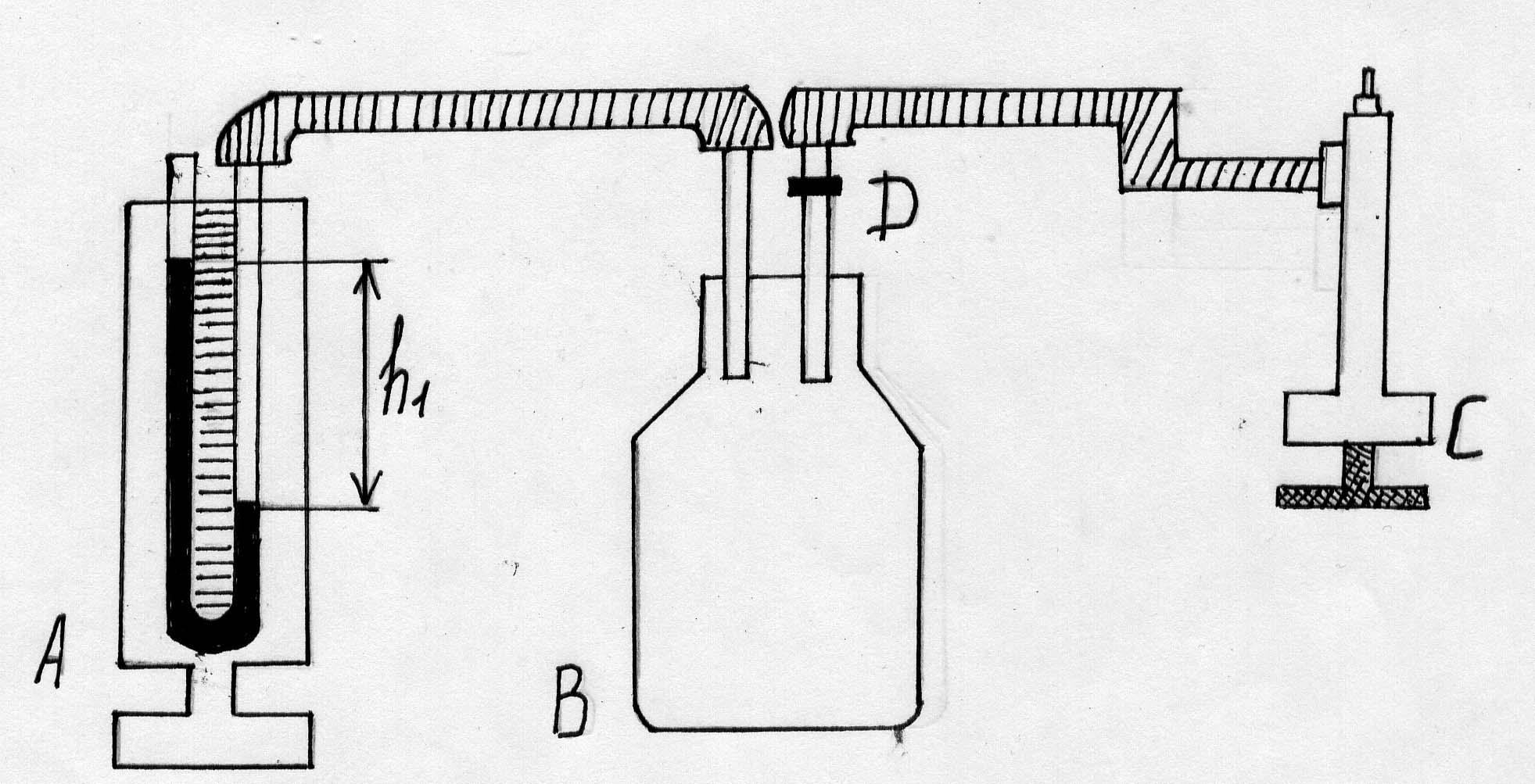
Рисунок 3.
Описание эксперимента
При помощи насоса С в стеклянный баллон В (кран открыт – положение вертикально) накачивают воздух. Давление и температура воздуха внутри баллона повышается. Нагнетание воздуха осуществляется до давления в водяном манометре А до уровня 20-30 см. Кран Д закрывают (положение горизонтальное). Через некоторое время (30-60 секунд) вследствие теплообмена температура в баллоне понизится до температуры окружающей среды. В этот момент определяют давление по манометру А (h1).
Кран Д открывают (вынимают его из трубки). В этот момент происходит адиабатическое расширение воздуха в баллоне В. Давление воздуха понижается и становится равным атмосферному. Уровни жидкости в манометре сравнивают.
Кран Д вставляют в трубку в горизонтальном положении. Так как произошло адиабатическое расширение воздух, то температура в баллоне понизилась. После закрытия крана Д происходит теплообмен воздуха в баллоне и в окружающей среде. Температура воздуха в баллоне повышается, при этом повышается его давление. Уровни жидкости в манометре расходятся и через 2-3 минуты достигают максимума, определяют разность уровней, т.е. давление (h2).
Коэффициент определяют из соотношения
![]()
Опыт повторяют пять раз. Результаты заносят в таблицу.
|
№ п/п |
h1 |
h2 |
|
ср |
|
ср |
|
т |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
i – число степеней свободы воздуха.
![]()
![]()
![]()
![]()
ДОПОЛНИТЕЛЬНОЕ ЗАДАНИЕ
Исследуйте влияние времени выдержки после адиабатического расширения на получаемый результат.
Определите минимально необходимое время выдержки и проанализируйте полученный результат.
Выскажите соображения по улучшению конструкции экспериментальной установки.
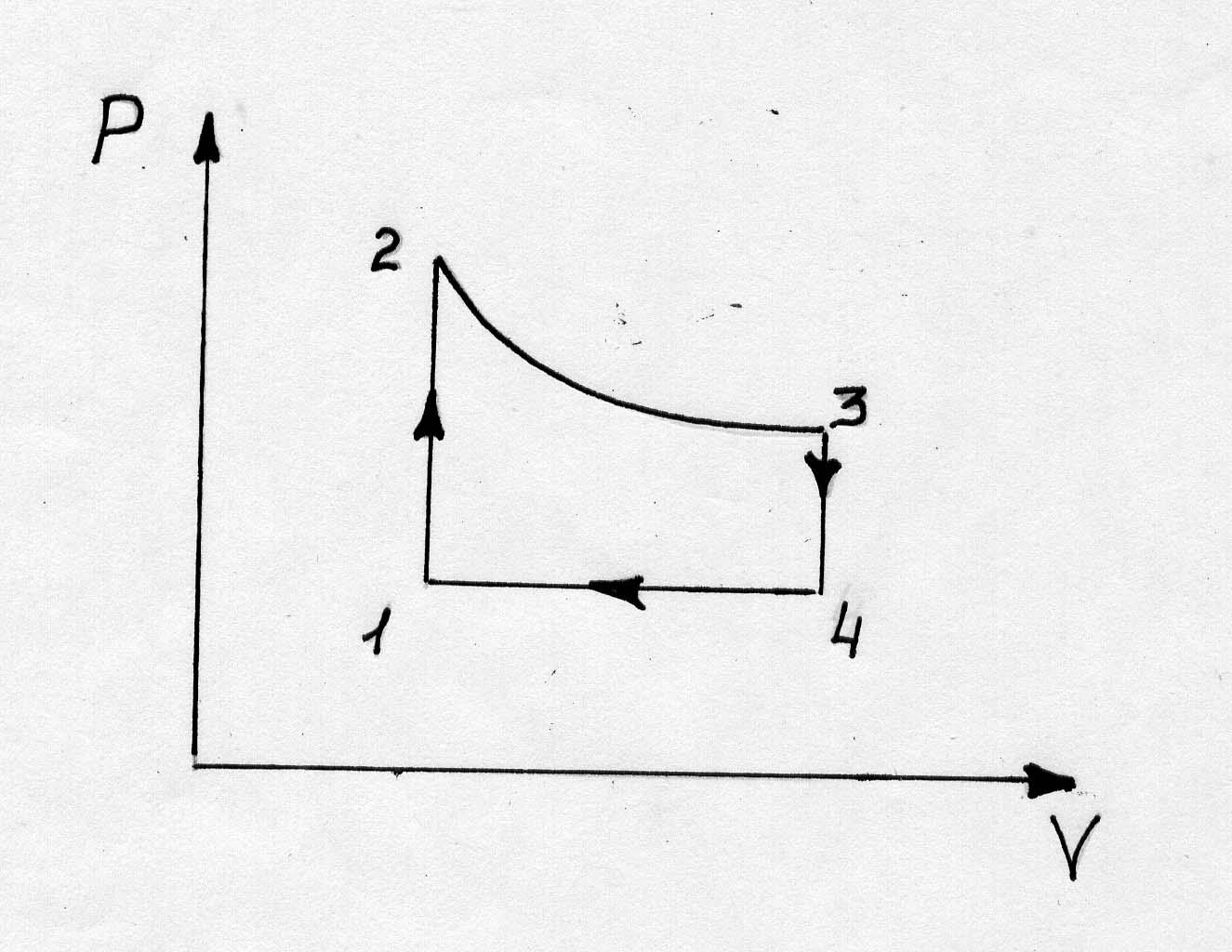
Дан замкнутый процесс
Постройте его в диаграммах V-T и P-T