
№2 Термохимия, первое начало термодинамики
.pdf
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.
Химическое превращение, химическая реакция есть качественный скачок, при котором расходуются одни вещества и образуются другие. Происходящая при этом перегруппировка атомов всегда сопровождается изменением энергии. Раздел химии, посвященный количественному изучению энергетических эффектов химических реакций, получил название термохимии. Результаты термохимических расчетов используются для определения энергии межатомных и межмолекулярных связей, для выяснения теплот фазовых переходов, растворения (тепловой эффект гидратации), в сочетании с данными о строении веществ позволяют оценивать реакционную способность (термодинамическую устойчивость) однотипных соединений.
Термохимия, в качестве составной части, входит в более общий раздел химии - химическую термодинамику, которая изучает закономерности превращений химической энергии в теплоту, работу и другие формы энергии. Химическая термодинамика, химическая кинетика вместе с учением о строении вещества образуют теоретический фундамент современной химии. Этот раздел химии позволяет определять возможность и полноту протекания химических реакций, оценивать наиболее оптимальные условия для их осуществления, выполнять расчеты тепловых балансов технологических процессов и т.п.
Суть термодинамического подхода применительно к химическим процессам состоит в анализе начального и конечного состояния веществ (реагентов, продуктов реакции) без учета пути по которому развивается процесс, в том числе скорости и механизма реакции.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ.
Основным понятием химической термодинамики является система. Системой принято называть совокупность тел и предметов, которые являются объектом нашего наблюдения или исследования. Система может быть ограничена либо реальными физическими границами (раствор в колбе ограничен стенками сосуда и поверхностью жидкости; аудитория ограничена ее стенами; фарфоровый тигель, содержащий, например, карбонат кальция ограничен стенками тигля и верхней кромкой порошкообразного CaCO3), либо мысленными границами (открытая аудитория; те же самые колба и тигель, если нас интересует и газовая фаза, контактирующая с раствором и CaCO3).
Система, состоящая из нескольких фаз, называется гетерогенной, однофазная система гомогенной. В свою очередь, под фазой мы будем понимать однородную, гомогенную часть системы, в любой своей точке имеющую одинаковые физические и химические свойства (разные крупинки поваренной соли NaCl не есть разные фазы!).
1 |
2 |
3 |
4 |
|
Рис1. Примеры некоторых систем: |
|
|
1 - Тигель с карбонатом кальция - гетерогенная |
однофазная открытая |
система (контакт с компонентами |
|
воздуха принципиального значения не имеет); 2 - Тот же тигель с плотно прилегающей крышкой, прогреваемый в пламени спиртовки – гетерогенная
трехфазная (кроме CaCO3 в системе появится кристаллический оксид кальция CaО и углекислый газ СО2) закрытая система;
3 - Колба с водой или с раствором NaCl может рассматриваться, как открытая гомогенная однофазная система. Но, если в колбе находится раствор сульфата железа (II) FeSO4, то в состав компонентов системы следует включить и газовую фазу над раствором, т.к. ионы Fe2+ обязательно будут постепенно окисляться кислородом воздуха – в этом случае система является открытой гетерогенной и двухфазной;
4 - Сосуд Дьюара с водой, в котором поддерживается температура 0° С (при этой температуре в равновесии находятся вода жидкая и лед) – изолированная двухфазная гетерогенная система.
Та часть материального мира, которая находится вне системы, называется окружением (окружающей средой). Окружение представляет собой огромный неизменный резервуар теплоты и работы. Когда теплота переходит от системы в окружающую среду, температура последней не увеличивается. Когда поршень выдвигается из системы, это не влияет на объем окружающей cреды. Окружение слишком обширно, чтобы реагировать на небольшие изменения, происходящие с системой. Конечно, на короткое время ближайшее окружение реакционного сосуда может стать горячим, но, если теплоте позволить распределиться по всей вселенной и вселенная придет в тепловое равновесие, то температура окружающей среды будет такой же, как и до эксперимента.
Если между системой и окружающей внешней средой отсутствует массо- и теплообмен, то такая система называется изолированной. Если отсутствует массообмен, но возможен теплообмен, то система называется закрытой. Если же между системой и окружающей средой возможен и массо- и теплообмен, то система открытая (не изолированная).
Состояние системы определяется совокупностью всех ее физических и химических свойств. Независимые свойства системы называются термодинамическими параметрами состояния. К числу основных параметров относятся температура (Т), давление (Р), объем (V). Изменение хотя бы одного параметра называется процессом и влечет за собой изменение состояния системы. Некоторые виды процессов:
1)изотермический (Т=const);
2)изобарный (P=const);
3)изохорный (V=const);
4)адиабатический (нет обмена теплотой междусистемой и внешней средой);
5)изобарно-изотермический (P=const, T=const).
1
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)
Состояние системы характеризуется совокупностью ее свойств: температура, давление, объем, концентрация; реже представляют интерес такие свойства как спектральные, электропроводность, теплоемкость, магнитная восприимчивость или диэлектрическая проницаемость и др. Зачастую свойства связаны между собой аналитическими соотношениями (уравнениямисостояния). В этом случае только часть из них могут иметь произвольные значения (параметры состояния), а остальные от них зависят (функции состояния). Например,простейшимуравнениемсостоянияявляетсяуравнениеМенделеева-Клапейрона(уравнениесостоянияидеальногогаза):
∙ = ∙ ∙ или = ∙ ∙ .
Простейшими функциями состояния являются, например, выражения типа f1 = p∙V или f2 = V/T. Функциями состояния их называют по двум причинам:
во-первых, значения соответствующих функций зависит только от параметров состояния вне зависимости от того, как система пришла в данное состояние (в состояние, характеризующееся данными параметрами), иными словами сумма (интеграл) элементарных изменений функции состояния при переходе из состояния 1 в состояние 2 определяется только этими состояниями:
|
|
|
|
|
|
|
; |
|
|
|
|
|
во-вторых, в матанализе показывается, что |
малое приращение функций состояния является полным дифференциалом, |
|||||||||||
|
|
∫ |
Ф = Ф − Ф |
|
|
|
|
|
|
|||
|
т.е. |
|
|
|
; |
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|||
Поскольку для большинства |
реальных систем уравнение состояния в явном виде неизвестно, для их термодинамического |
|||||||||||
= · |
+ |
· |
|
= · |
− |
|
|
|||||
описания пользуются функциями состояния: энергия (Е), энтальпия (Н), энтропия (S) и др. (например, упоминавшиеся ранее выражения типа PV или V/T). Значения этих величин определяются только состоянием системы, и не зависят от того, каким способом, по какомупути система была переведена из первоначального состояния в анализируемое. Тепловой эффект реакции
(Q) также, как и работа (А), совершаемая системой в процессе перехода, зависят не только от начального и конечного состояния системы, но и от способа перехода, т.е. они являются функциями пути. При обсуждении законов термохимии будет показано, что при определенных условиях выполнения химического превращения тепловой эффект реакции приобретает свойства функции состояния и перестает зависеть от особенностей перехода от реагентов к продуктам.
Одна из важнейших функций состояния полная энергия Еполн. Она представляет собой сумму кинетической энергии движущейся системы Екин., потенциальной энергии Епот., которая обусловлена воздействием на систему внешних силовых полей (гравитационного, электромагнитного и др.) и внутренней энергии системы U:
Е = Екин. + Епот. + U
При термодинамическом описании в большинстве случаев можно считать, что система находится в относительном покое (Екин. = 0) и воздействие внешних полей пренебрежимо мало (Епот.= 0). Тогда полная энергия системы определяется запасом ее внутренней энергии (Еполн.= U). Последняя складывается из кинетической энергии поступательного и вращательного движения молекул, энергии их притяжения и отталкивания, энергии электронного возбуждения, энергии межъядерного и внутриядерного взаимодействия и т. п. Количественный учет всех составляющих внутренней энергии невозможен, но для термодинамического анализа систем в этом нет необходимости, т. к. достаточно знать лишь изменение внутренней энергии при переходе из одного состояния в другое, а не ее абсолютные величины в этих состояниях. А найти U и изменение других функций состояния можно
не толькопоразности типа U= Uкон Uнач., но и, используя соответствующие законытермодинамики.
ЗАКОНЫ (НАЧАЛА) ТЕРМОДИНАМИКИ
Термодинамика основана на трех основных постулатах, которые нельзя вывести из более общих законов. Однако их можно считать твердо установленными фундаментальными законами природы, поскольку многовековой житейский, производственный и научный опыт человечества показал, что процессы, противоречащие этим постулатам никогда не наблюдаются.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ЭНТАЛЬПИЯ.
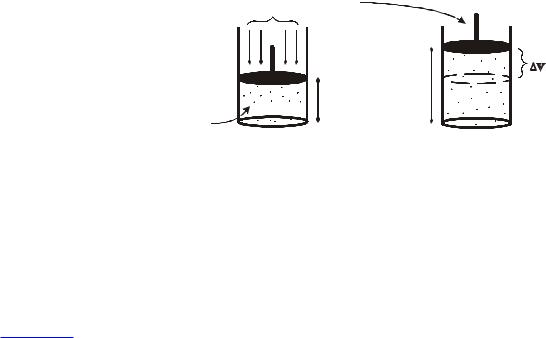
Первый закон термодинамики гласит, что в случае закрытой системы, сообщенная теплота (Q) расходуется на приращение внутренней энергии ( U) и на совершение работы (А) против внешних сил:
Q = U + A |
|
силы окружающей среды (F), |
то же |
создающее давление (Рвнеш) |
|
h2
Q 





 h1
h1
Состояние I |
Состояние II |
газовой системы |
газовой системы |
характеризуется |
характеризуется |
параметрами состояния: |
параметрами состояния: |
Рнач, Vнач, Тнач; |
Рнач, Vнач, Тнач; |
а также внутренней энергией |
а также внутренней энергией |
(функцией состояния) Uнач |
(функцией состояния) Uкон |
При сообщении системе в состоянии I некоторого количества тепла Qр,Т в ней произошел эндотермический |
|
процесс в изобарно-изотермических |
условиях (Р = Рвнеш = const, T = const). |
2
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Для наглядного представления физического смысла работы против внешних сил рассмотрим систему, представляющую собой газ, заключенный в цилиндр, который отделен от внешней среды перемещающимся без трения поршнем. На поршень оказывают воздействие силы окружающей среды и создают давление Рвнеш. Пока давление газа в цилиндре равно внешнему (атмосферному), поршень находится в равновесии, неподвижен. Если подвести к системе некоторое количество теплоты (это означает, что в системе пройдет эндотермический процесс, тепловой эффект в этом случае отрицателен: Q), то газ, расширяясь, совершит работу по поднятию поршня в новое положение, когда внешнее и внутреннее давления вновь выравнятся. Поскольку давление в системе в начальный и конечный момент совпадают (равны Рвнеш), - в системе прошел эндотермический процесс в изобарных условиях.
Тогда выражение для I-го начала термодинамики можно записать следующим образом:
QP,Т = U + А.
Для работы по перемещению поршня имеем:
A = F· h = P·S (hкон-hнач),
где F сила, действующая на поршень; (hкон - hнач) высота перемещения поршня; Р давление; S площадь поршня. Т. к.
S·(hкон - hнач) = V изменение объема, то A = P· V = P·(Vкон Vнач)
Если через Uнач и Uкон обозначить запас внутренней энергии системы в исходном и конечном состояниях, то
|
QP,Т = Uкон Uнач + P·(Vкон Vнач.) |
U = Uкон Uнач. |
Тогда |
или QP,ТЬ = ( Uкон + P·Vкон) ( Uнач + P·Vнач) |
Введем новую функцию состояния U + P·V H энтальпия системы. Таким образом, при условии постоянства давления (что выполняется для большинства химических реакций) подводимая к закрытой системе (условие закрытости — тоже, за исключением массообмена через газовую фазу) теплота QP,Т идет на увеличение энтальпии системы Н:
QP,Т = Hкон Hнач = H
Здесь рассмотрен пример совершения системой механической работы (работа расширения газа), но возможны превращения подводимого тепла в световую, электрическую и другие виды энергии. Заметим здесь же, что если поршень закреплен неподвижно (V = const), то совершение работы расширения невозможно (А = 0) и сообщенная системе теплота идет полностью на увеличение внутренней энергии:
QV,Т = U
Энтальпия как функция состояния эквивалентна внутренней энергии при термодинамическом описании изобарных процессов.
Важные выводы:
1. Как видно из полученных формул, найти изменение функций состояния, например H или ΔU, можно и, не зная абсолютных значений энтальпии системы (Hкон, Hнач). Достаточно выполнить переход между этими состояниями в изобарноизотермических или изохорно-изотермических условиях и экспериментально определить его тепловой эффект. Как будет показано ниже определить Hреакции можно и расчетным путем, с использованием законов термохимии.
2.Из полученных выражений следует, что тепловой эффект химической реакции, выполненной в указанных условиях приобретает свойства функции состояния и не зависит от пути, от способа выполнения перехода междуразными состояниями.
3.Долгое время термодинамические законы независимо разрабатывались применительно к физическим и химическим системам (процессам) и, так уж получилось, что при этом были выбраны разные системы знаков для обозначения экзо- и
эндотермических процессов. В термохимии теплоты экзотермических процессов принято считать положительными (Q > 0). При этом подразумевается, что наблюдатель "находится вне системы, в окружающей среде" и отмечает, что запас энергии в ней увеличивается за счет поступления дополнительной энергии из системы. В термодинамике наблюдатель "находится в самой системе". И, если в ней проходит экзотермическая энергия, то запас энергии в системе уменьшается, поэтому для экзотермических процессов принято, что Н(ΔU) < 0. Мы будем пользоваться термодинамическими обозначениями и термодинамической системой знаков.
ТЕПЛОВЫЕ ЭФФЕКТЫ РЕАКЦИЙ. ЗАКОНЫ ТЕРМОХИМИИ.
Вернемся к химическим реакциям. Энергетические изменения, сопровождающие их, имеют большое практическое значение. Иногда они даже важнее, чем происходящее в ходе данной реакции образование новых веществ. В качестве примера достаточно вспомнить реакции горения топлива. Эти процессы регулярно выполняются, например, в бытовых условиях и при этом мало кто задумывается о теории этого явления, о том каков знак и абсолютное значение теплового эффекта соответствующей реакции.
Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате реакции (соответствует определенным количествам веществ, указанным в уравнении реакции) при соблюдении следующих условий:
объем или давление постоянны (Р = const или V = const);температура исходных веществ и продуктов одинакова.
По тепловому эффекту химические реакции подразделяют на экзотермические (идущие с выделением тепла из системы в окружающую среду) и эндотермические (система затрачивает внутреннюю энергию для протекания реакции, температура реакционной смеси понижается).
Еще до открытия первого закона термодинамики Г.И.Гесс экспериментальным (эмпирическим) путем установил основной закон термохимии (закон Гесса):
Тепловой эффект химической реакции, выполненной в изобарно-изотермических или изохорно-изотермических условиях, не зависит от пути процесса (числа промежуточных стадий, скорости, способа активации реагентов и т.п.), а
определяется только природой и состоянием реагентов и продуктов (т.е. от начального и конечного состояния системы). Как видно из формулировки, в законе Гесса по сути делается утверждение, которое было обосновано в выводе №2 (см. выше).
3
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Аналитическое выражение закона Гесса может быть записано следующим образом:
Если какое-либо химическое превращение может быть выполнено или формально представлено как одностадийное, двухстадийное или многостадийное превращение, то
Q = Q1 + Q2 = Q3 + Q4 + Q5 + … .
Закон Гесса позволяет, оперируя химическими (термохимическими) уравнениями как алгебраическими, рассчитывать тепловые эффекты реакций при условии, если их трудно измерить экспериментально, в том числе, если саму реакцию невозможно выполнить.
Рассмотрим в качестве примера тепловые эффекты двух вариантов превращения из начального состояния (смесь веществ А, В, С и D) в конечное (смесь веществ АВ, С и D). Обозначим тепловой эффект одностадийного перехода как QP (ΔНР),
тепловые эффекты отдельных стадий как Q1, Q2 |
и Q3. |
|
вещества |
|
вещества |
А, B, C, D; |
|
AB, C, D; |
начальное |
А+В=АВ |
конечное |
состояние |
|
состояние |
А + C =  А
А  C
C
|
|
|
|
|
B |
+ |
D |
|
|
|
|
А |
|
||
|
|
|
= |
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
D |
+ |
B |
|
|
|
|
А |
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
АC+D=АD+C |
AC,B,D |
AD,B,C |
П-I |
П-II |
ПРОМЕЖУТОЧНЫЕ СОСТОЯНИЯ Схема, иллюстрирующая смысл закона Гесса
Докажем, что Qр = Q1 + Q2 + Q3. Пусть эти реакции проходят в изобарно-изотермических условиях. Тогда Q = Н. Выразим тепловые эффекты через энтальпии отдельных состояний:
с одной стороны, энтальпия перехода из начального состояния в конечное равна Нр = Нкон – Ннач; с другой стороны, в случае трехстадийного перехода
Нр = (НП-I – Ннач) + (НП-II – НП-I) + (Нкон – НП-II) = Нкон – Ннач .
Таким образом, энтальпии переходов совпадают. Это неудивительно, т.к., если сложить все уравнения трехстадийного перехода, то получим искомое уравнение одностадийного превращения из начального состояния в конечное:
А + С → АС; АС + D → AD + C; AD + B → AB+ D или,
последовательно складывая левые и правые части этих уравнений, получаем:
A + C + AC + D + AD + B→ AC + AD + C + AB+ D.
После сокращения одинаковых формул имеем:
А + В → АВ.
Термохимические расчеты и соответствующие справочные данные, как правило, приводятся для так называемого стандартного состояния (с указанием надстрочного индекса «°»):
Стандартное состояние для индивидуального вещества предполагает его количество 1 моль при давлении 1атм в том агрегатном состоянии, которое стабильно при данных условиях. Температура вещества не стандартизируется, но большинство справочных данных приводится для Т = 298К.
Стандартное состояние для вещества в растворе предполагает молярную концентрацию 1моль/л. Для трудно растворимых веществ стандартным состоянием считается его насыщенный при данной (как правило, 298К) температуре раствор.
В качестве конкретного примера можно разобрать образование водного раствора хлорида аммония, имея в качестве начального состояния избыток жидкой воды и газообразные аммиак NH3 и хлороводород HCl.
Начальное состояние: NH3 (г), HCl(г), Н2О(ж).  Конечное состояние: NH4Cl(р-р)
Конечное состояние: NH4Cl(р-р)
Этот переход можно, в частности, выполнить двумя следующими способами:
NH3 (г) + HCl(г) = NH4Cl(г) |
Н°1 |
= -10 кДж/моль |
NH3 (г) + вода = NH3 (р-р) |
Н°3 = -2 кДж/моль |
||
HCl(г) + вода = HCl(р-р) |
Н°4 = -4.13 кДж/моль |
|||||
NH4Cl(г) + вода = NH4Cl(р-р) |
Н°2 = 0.94 кДж/моль |
|||||
NH3 (р-р) + HCl(р-р) = NH4Cl(р-р) |
Н°5 = -2.93 кДж/моль |
|||||
В итоге: Н°перехода = Н°1 |
+ Н°2 |
= -9.06 кДж/моль |
Н°перехода = Н°3 + Н°4 |
+ Н°5 = -9.06 кДж/моль |
||
|
|
|
|
|||
|
|
|
|
|
|
|
Если тепловой эффект включен непосредственно в уравнение реакции, такие уравнения называются термохимическими.
Следствием из закона Гесса можно считать утверждение, порой называемое законом Лавуазье-Лапласа: тепловые эффекты прямой и обратной реакции равны по абсолютной величине и противоположны по знаку. Этот закон был установлен экспериментально, но после открытия закона Гесса данное утверждение выглядит очевидным, особенно, если вспомнить термодинамическую терминологию (первый закон термодинамики был открыт позднее закона Гесса) – в соответствие с выводом №2 (см. стр. 3), если система в результате цепочки превращений возвращается в исходное состояние, то значения всех функций состояния, например, запас ее внутренней энергии, энтальпии, воспроизводятся. Таким образом важным следствием из закона Гесса является следующее утверждение: тепловой эффект циклического процесса равен нулю.
4
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Часто это следствие формулируют в более конкретном виде и при этом интересующую реакцию встраивают в цикл совместно с некоторыми важными типами термохимических процессов: реакциями атомизации, реакциями образования, реакциями сгорания, реакциями растворения веществ и т.п.
Реакциями атомизации называют такие, в которых в ходе которых один моль данного вещества переводится в смесь газообразных атомов.
Н2(г) → 2Н(г) |
Н°ат(Н2) = 430 |
кДж/моль |
|
NaCl(крист) → Na(г) + Cl(г) |
Н°ат(NaCl) = 641.99 |
кДж/моль |
|
Na2SO4(крист) → 2Na(г) + S(г) + 4О(г) |
Н°ат(Na2SO4) = 2877.52 |
кДж/моль |
|
CH2ClCOOH(крист) → 2С(г) + Cl(г) + 3Н(г) + 2О(г) Н°ат(хлоруксусной кислоты) = 3199.35 |
кДж/моль |
||
CH2ClCOONH4(крист) → 2С(г) + Cl(г) + 6Н(г) + 2О(г) |
Н°ат(хлорацетата аммония) = |
??? |
|
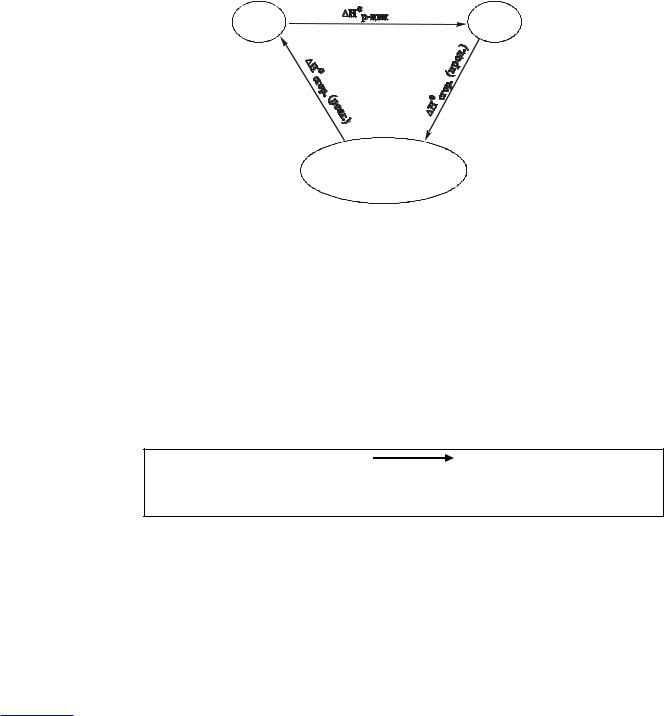
Реагенты и продукты одной и той же реакции состоят из одних и тех же атомов, поэтому эти три состояния могут составить единый цикл:
реагенты |
продукты |
|
- |
атомы, входящие
всостав реагентов
ипродуктов
Применяя закон Гесса к этомуциклическомупроцессу, получаем: |
Н°р-ции + ΣΔН°ат. (прод.) – ΣΔН°ат. (реаг.) = 0. |
Н°р-ции = ΣΔН°ат. (реаг.) – ΣΔН°ат. (прод.),
Суммы энтальпий атомизации должны находиться с учетом стехиометрических коэффициентов в уравнении реакции.
Например, для реакции
2NH3 + 3N2O → 4N2 + 3H2O
Н°р-ции = [2ΔН°ат.(NH3) + 3ΔН°ат.(N2O)] – [4ΔН°ат.(N2) + 3ΔН°ат.(Н2O)].
Реакциями образования сложных соединений называют такие, в ходе которых из необходимых количеств простых веществ
встабильных модификациях получается один моль данного сложного соединения. Энтальпии таких реакций и называются энтальпиями образования сложного соединения. Например, термохимическая реакция образования воды – это взаимодействие водорода икислорода, а реакцией образования сернойкислотыявляетсявзаимодействиеводорода, серыикислорода:
H2 + 1/2O2 → H2O(ж) |
Н°обр(Н2О)(ж) = -285.83 |
кДж/моль |
1/8H2 + 1/8S8 + 1/4O2 → H2SO4 |
fН°(Н2SО)(ж) = -814.2 |
кДж/моль |
Причем, первая величина, в принципе, может быть определена и экспериментально, а вторая – только расчетным путем с применением закона Гесса или следствий из него, поскольку прямым путем, одностадийно такой переход выполнить не удается.
Энтальпии образования простых веществ в стабильных или легче и воспроизводимо получаемых модификациях приняты равными нулю:
Н°обр(Сграфит) = 0, Н°обр(Салмаз) = 1.83 кДж/моль
Н°обр(Р4) = 0, Н°обр(Ркрасный) = -17.4 кДж/моль, Н°обр(Рчерный) = -38.9 кДж/моль Вещества с положительными энтальпиями образования называют эндотермическими, а с отрицательными –
экзотермическими. По величинам Н°обр однотипных сложных соединений можно судить об их термодинамической устойчивости к распадуна простые вещества:
|
H2O(г) ‒ H2S(г) ‒ H2Se(г) ‒ H2Te(г) |
|
Н°обр, кДж/моль: |
-241.8 -21.0 33.0 |
99.7 |
В рядуводородных соединений халькогенов стабильность падает.
Если составить циклическое превращение, отдельными состояниями которого будут реагенты, продукты и простые вещества, состоящие из тех же атомов, что и реагенты и продукты, то в соответствие с законом Гесса:
Н°р-ции - ΣΔН°обр. (прод.) + ΣΔН°обр. (реаг.) = 0 или |
Н°р-ции = ΣΔН°обр. (прод.) - ΣΔН°обр. (реаг.) . |
реагенты |
продукты |
-
5
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)
Тогда для той же реакции
2NH3 + 3N2O → 4N2 + 3H2O
Н°р-ции = [4ΔН°обр.(N2) + 3ΔН°обр.(Н2O)] – [2ΔН°обр.(NH3) + 3ΔН°обр.(N2O)],
где Н°обр.(N2) = 0, остальные величины нужно найти в справочной литературе.
Реакциями сгорания называют такие, в которых один моль данного соединения взаимодействует с необходимым
количеством кислорода с образованием высших оксидов входящих в его состав элементов. |
|
|
С2Н5ОН(ж) + 3О2 → 2СО2 +3Н2О(ж) |
Н°сгор = -1312.79 |
кДж/моль |
Na2SO3(крист)) + 1/2O2 → Na2SO4 Na2O(крсит) + SO3(крист) |
Н°сгор = 225.01 |
кДж/моль |
Причем, первая величина, в принципе, может быть определена и экспериментально, а вторая – только расчетным путем с применением закона Гесса или следствий из него, поскольку прямым путем, одностадийно такой переход выполнить не удается.
Такого рода реакция невозможна, если рассматриваемое соединение является кислородным и все элементы, кроме кислорода находятся в высших положительных степенях окисления: H2O, KNO3, Ba(OH)2 и т.п. Энтальпия сгорания таких веществ принята равной нулю.
Данное понятие и соответствующее ему уравнение чаще всего применяют для расчета тепловых эффектов реакций с участием органических соединений. Это объясняется двумя причинами. Во-первых, горение в кислороде является общей реакцией для любых органических соединений, идущей при соблюдении определенных условий до конца и, как правило, однозначно. Во-вторых, техника сожжения органических веществ и при постоянном давлении, и при постоянном объеме достигла высокого совершенства и позволяет определять теплоты сгорания экспериментально с точностью до ~0.02%.
Если составить циклическое превращение, отдельными состояниями которого будут реагенты, продукты и высшие оксиды элементов, входящих в состав реагентов и продуктов, то в соответствие с законом Гесса:
Н°р-ции + ΣΔН°сгор. (прод.) - ΣΔН°сгор. (реаг.) = 0 или |
Н°р-ции = ΣΔН°сгор. (прод.) - ΣΔН°сгор. (реаг.) . |
реагенты |
продукты |
- |
|
Тогда для той же реакции
2NH3 + 3N2O → 4N2 + 3H2O
Н°р-ции = [2ΔН°сгор.(NH3) + 3ΔН°сгор.(N2O)] – [4ΔН°сгор.(N2) + 3ΔН°сгор.(Н2O)],
где Н°сгор.(Н2О) = 0, остальные величины нужно найти в справочной литературе.
ПРЕДСКАЗАНИЕ ЗНАКА ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ
По закону Гесса (и по I-му началу термодинамики) тепловой эффект химической реакции определяется только природой реагентов и продуктов. После того как были сформулированы современная теория строения атомов, а на ее основе и теории химического строения веществ, стало понятно, что тепловой эффект реакций определяется прочностью (энергией) химических связей, которые разрываются в составе регентов и образуются в составе продуктов.
Любая реакция представляет собой превращение одних веществ в другие. Это происходит за счет перегруппировки части (может всех) атомов, входящих в состав реагентов. Для этого необходим распад связей в их структурах, на что требуются вполне определенные затраты энергии. Распад связей – эндотермический этап реакции. В то же время при образовании новых связей в продуктах будет выделяться энергия, равная энергиям этих связей (экзотермический этап реакции).
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
разрыв связей |
образование новых связей |
затраты энергии |
выделение энергии |
(эндотермический этап реакции) |
(экзотермический этап реакции) |
Тепловой эффект, в частности его знак будет определяться соотношением тепловых эффектов этапа распада старых и образования новых связей. Реакция в целом оказывается экзотермической, если в продуктах образуются более прочные связи, чем те, которые были разорваны в исходных веществах. И наоборот, если за счет образования связей в продуктах выделяется мало энергии, то для протекания реакции будет расходоваться часть внутренней энергии системы реакция окажется эндотермической.
6
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Таблица 1.
|
энергия |
энергия |
энтальпия Нº |
|
формула |
хим. связи |
хим. связи |
|
реакции |
|
Э —Э |
Н — Г |
Н2(г) |
+ Г2(г) = 2НГ(г) |
|
кДж/моль |
кДж/моль |
|
кДж/моль |
Н2 |
432 |
|
|
|
F2 |
155 |
566 |
Н = 432 |
+ 155 - 2·566 = -545 |
Cl2 |
243 |
432 |
Н = 432 |
+ 243 - 2·432 = -189 |
Br2 |
191 |
363 |
Н = 432 |
+ 191 - 2·363 = -103 |
I2 |
149 |
298 |
Н = 432 + 149 - 2·298 = -15 |
|
В частности, в реакции нейтрализации сильных кислот сильными основаниями в явном виде не распадаются никакие связи. Дело в том, что соответствующие электролиты (например, HCl, HNO3, с одной стороны, и, например, КОН или NaOH, с другой) полностью диссоциированы в растворах. Полностью диссоциированы и растворимые соли. Поэтомув реакциях типа
NaОН + HNO3 → Н2О + NaNO3 или КОН + HCl → Н2О + KCl
только вода находится в растворе в виде связанных молекул. В полном ионном виде уравнения этих реакций нужно записать следующим образом:
Na+ + ОН– + Н+ + NO3– → Н2О + Na+ + NO3– К+ + ОН– + Н+ + Cl– → Н2О + К+ + Cl–
После сокращения формул не участвующих в реакции ионов, получаем одинаковое ионное уравнение:
ОН– + Н+ → Н2О.
В соответствие с полученным ионным уравнением реакцией нейтрализации сильной кислоты сильным основанием называется взаимодействие протонов и гидроксид-ионов в растворе, которое завершается образованием 1-го моль
жидкой воды. Без расчетов можно понять, что эта реакция должна быть экзотермичной за счет выделения энергии при образовании дополнительной связи Н–О в составе молекулы Н2О (кроме той, что была в составе иона OH-):
ОН– + Н+ → Н2О Н° ≈ –55.9кДж/моль.
Если заменить сильную кислоту на слабую (например, уксусную СН3СООН), реакция ее нейтрализации окажется менее экзотермичной, посколькув ходе нее предстоит разрывать связь (какую?) в молекуле кислоты:
ОН– + СН3СООН → Н2О + СН3СОО– .
В свою очередь, легко догадаться, что реакции атомизации обязательно должны быть эндотермичными (почему?). Зачастую эндотермичны и большинство реакций разложения, но все же это, как раз таки не обязательно (почему?). Слабо экзотермичны или эндотермичны реакции с участием азота. Это объясняется необходимостью распада тройной связи в молекуле N2. Необходимые для этого затраты энергии окупаются далеко не всегда:
N2 (г) + О2 (г) = 2NO(г) 43.2 кДж |
( Н° = 43.2 кДж) |
N2 (г) + 3Н2 (г) = 2NН3(г) + 91.9 кДж |
( Н° = -91.9 кДж). |
7
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)
