
закон действующих масс
.pdf1
§ 6. Скорость химических реакций
Теоретическое введение
Время протекания химических реакций изменяется в очень широких пределах – от 10- 14 с (реакция H + H2 → H2 + H в газовой фазе) до миллионов лет (образование каменного угля из растительных остатков). Одни реакции могут протекать годами, например, коррозия железа или ферментация (брожение) виноградного сока, в результате которой получается вино. Другие завершаются за несколько дней, например, реакция этилового спирта с соляной кислотой. Третьи заканчиваются очень быстро, например, обменные реакции между ионами в растворах. Мгновенно, за миллионные доли секунды, заканчиваются взрывные реакции.
Для количественной характеристики скорости реакции используют, однако, не время реакции, а другую величину – скорость изменения числа частиц в единице объема, при этом число частиц измеряют обычно в молях. Если за время реакции t = t2 – t1 в объеме V образовалось Δν = ν2 – ν1 молей продукта, то среднюю скорость реакции ω можно определить как отношение
ω = |
1 |
ν = |
1 |
|
ν2 |
− ν1 |
. |
|
|
|
|
||||
V t V t2 |
− t1 |
||||||
Если реакция протекает при постоянном объеме, то скорость реакции можно выразить через изменение молярной концентрации (c = ν / V) продукта:
ω = c = |
c2 |
− c1 |
, |
t t2 |
− t1 |
||
где c1 и c2 – молярные концентрации вещества в моменты времени t1 и t2. Если в реакции образуются несколько продуктов, то скорость реакции можно определять по концентрации любого из них.
Почти все химические реакции в растворе или в газовой фазе происходят при столкновении молекул. Чем больше столкновений, тем больше скорость реакции. Число столкновений зависит от числа молекул в единице объема, т.е. от концентрации, поэтому скорость реакции зависит от концентраций реагирующих веществ. Некоторые реакции происходят без столкновения частиц, при распаде одиночных молекул. Однако и здесь скорость реакции увеличивается с концентрацией: чем больше молекул, тем больше распадов.
Если бы при каждом столкновении молекулы вступали в реакцию, то все химические реакции заканчивались бы мгновенно, и многие из них – со взрывом. На самом деле, одни молекулы при столкновении превращаются в продукты реакции, а другие – нет. Это зависит от энергии, которая нужна для разрыва или ослабления «старых» химических связей. Если сталкиваются «активные» молекулы, которые обладают некоторым запасом энергии, то они могут прореагировать друг с другом; если же энергия молекул мала, то столкновение не приводит к реакции: молекулы сталкиваются и разлетаются, химического превращения нет. Таким образом, чем больше энергия молекул, тем больше скорость реакции. А энергия молекул зависит от температуры. Поэтому второй важнейший фактор, определяющий скорость реак-
2 ции – температура. Скорость огромного большинства реакций увеличивается с ростом температуры.
Для гетерогенных реакций, которые протекают на поверхности реагирующих фаз, огромное значение имеет величина этой поверхности. Чем больше величина поверхности раздела фаз, тем больше скорость гетерогенной реакции.
Во многих случаях скорость реакции можно увеличить или уменьшить до нужной величины с помощью специальных веществ – катализаторов. Они изменяют скорость реакции, но сами в результате не расходуются. Действие катализаторов объясняют тем, что они направляют реакцию по другому, энергетически более выгодному пути.
Таким образом, скорость химических реакций зависит от: а) природы реагирующих веществ; б) концентрации реагирующих веществ; в) температуры; г) присутствия катализаторов.
Зависимость скорости реакции от концентрации. Реакции бывают простыми и сложными. Простые реакции (их еще называют элементарными) протекают в одну стадию непосредственно при столкновении молекул или при их распаде. Сложная реакция состоит из нескольких элементарных реакций. Совокупность этих реакций называют механизмом
сложной реакции. Скорость сложной реакции определяется скоростью самой медленной стадии.
По уравнению реакции нельзя сказать, является данная реакция сложной или элементарной – это можно выяснить только с помощью экспериментальных исследований. Выяснение механизмов химических реакций – одна из главных задач химии.
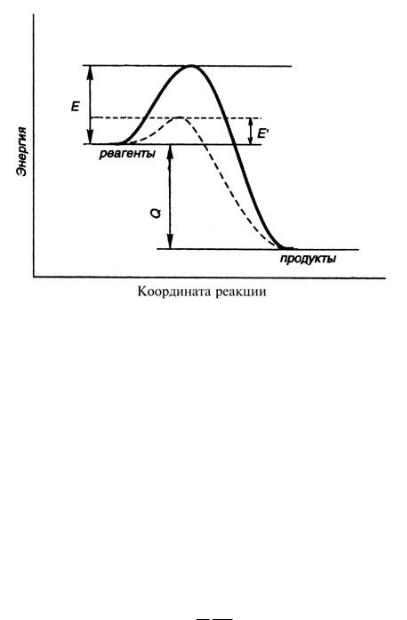
В каждой элементарной реакции в процессе превращения исходных в продукты образуется так называемое «переходное состояние», которое соответствует максимуму на энергетической кривой химической реакции (рис. 6.1). В переходном состоянии старые химические связи уже ослаблены, а новые еще полностью не образовались.
Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Эта величина может принимать всего три значения: 1, 2 и 3. Это означает, что элементарные реакции бывают всего трех типов:
1) Мономолекулярные реакции – элементарные реакции распада и изомеризации, в которых участвует только одна молекула:
X + YZ
XYZ  [X Y Z]
[X Y Z]  XY + Z
XY + Z
реагент |
переходное |
|
|
|
X + Y + Z |
|
|
|
состояние |
|
|
|
|
продукты |
. |
|
|
|
В этом случае происходит разрыв химических связей X−Y или Y−Z или их обеих одновременно при нагревании или под действием света, например:
t
C2H5Br → C2H4 +HBr.

3
2) В бимолекулярных реакциях происходит столкновение двух частиц:
X + YZ |
|
[X Y Z] |
|
XY + Z |
|
|
|||
реагенты |
|
переходное |
|
продукты |
|
|
состояние |
, |
|
|
|
|
||
при этом одна связь (Y−Z) разрывается, а другая – образуется, например:
H + Cl2 → HCl + Cl.
Бимолекулярные реакции – самый распространенный тип элементарных реакций.
3) В тримолекулярных реакциях одновременно сталкиваются три молекулы, напри-
мер:
2NO + O2 → 2NO2.
Закон действующих масс описывает зависимость скорости химической реакции от концентрации.
1) Скорость элементарной химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ:
ω = k c(XYZ) |
|
|
(мономолекулярные реакции); |
ω = k c(X) c(YZ) |
|
|
(бимолекулярные реакции); |
ω = k c(NO)2 c(O |
2 |
) |
(тримолекулярные реакции). |
|
|
|
Коэффициент пропорциональности k между скоростью и произведением концентраций называют константой скорости. Эта величина не зависит от концентраций (отсюда название – константа), но зависит от температуры и природы реагирующих веществ. Скорость реакции равна константе скорости в случае, если концентрации всех реагирующих веществ равны 1 моль/л.
Сумму показателей степеней при концентрациях веществ называют общим порядком реакции. Мономолекулярные реакции имеют первый порядок (ω ~ c), бимолекулярные – второй (ω ~ c c), тримолекулярные – третий (ω ~ c c c).
2) Скорость сложной химической реакции, состоящей из нескольких стадий, определяется скоростью самой медленной из них. В большинстве случаев скорость сложной реакции пропорциональна произведению концентраций реагирующих молекул, возведенных в некоторые степени:
ω = k c(A)x c(B) y
Показатели степени x и y называют порядками реакции по веществам A и B. Эти числа, в общем случае, не обязательно равны коэффициентам в уравнении реакции. Они могут быть целыми, дробными и даже отрицательными. Сумма x + y – общий порядок реакции. Известны сложные реакции минус первого, нулевого, полуторного порядка. При отрицательном порядке скорость реакции увеличивается по мере расходования веществ.
Все реакции первого порядка – и элементарные, и сложные – имеют одну и ту же зависимость концентрации c от времени t:

4
|
1 |
t /T1/ 2 |
|
c(t) = c(0) |
|
|
, |
|
|||
|
2 |
|
|
где c(0) – начальная концентрация в момент времени t = 0, T1/2 – период полураспада, который не зависит от концентрации, а зависит только от температуры и природы распадающегося вещества.
Закон действующих масс – главное теоретическое соотношение для описания скоростей реакции. Это – один из основных законов химии. В законе действующих масс фигурируют концентрации только исходных веществ, но не продуктов реакции. Это означает, что в химической кинетике важна только левая часть химических уравнений. Скорость реакции определяется только свойствами исходных веществ: главное, ЧТО реагирует, а не ВО ЧТО все это превращается.
Зависимость скорости реакции от температуры. Скорость огромного большинства реакций увеличивается с ростом температуры. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа: при нагревании на 10 оС скорость большинства химических реакций увеличивается в 2÷4 раза. Математически это означает, что скорость реакции является степенной функцией от температуры:
ω(T2 ) = γ(T2−T1) /10 ,
ω(T1 )
где ω(T1) и ω(T2) – скорости реакции при температурах T1 и T2, γ – температурный коэффициент скорости (γ = 2÷4), который показывает во сколько раз увеличивается скорость при нагревании на 10 оС. Правило Вант-Гоффа является весьма грубым и применимо только в ограниченном интервале температур.
Более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
k(T) = A e−E /(RT ) ,
где T – температура; R – универсальная газовая постоянная; A – постоянная, который не зависит от температуры, а определяется только видом реакции; E – энергия активации; e = 2,7183 – основание натуральных логарифмов.
Энергия активации – разность между энергией переходного состояния и исходных веществ (рис. 6.1). Если энергия сталкивающихся частиц меньше E, то при столкновении реакция не произойдет, если энергия превышает E, реакция произойдет. Энергия активации не зависит от температуры. Для большинства обычных реакций энергия активации изменяется в пределах от 50 до 100 кДж/моль.
Энергию активации реакции можно изменить, использовав специальные вещества – катализаторы. Катализатор – вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Обычно катализаторы ускоряют реакции. Однако, бывают реакции нежелательные. Катализаторы, за-
5 медляющие такие реакции, называют ингибиторами. Биологические катализаторы белковой природы называют ферментами. Абсолютно все реакции в живом организме катализируются ферментами.
Механизм действия катализаторов связан с тем, что они образуют промежуточные соединения с исходными веществами и тем самым изменяют путь реакции, причем новый путь характеризуется меньшей высотой энергетического барьера, т.е. меньшей энергией активации по сравнению с реакцией без катализатора (рис. 6.1).
Рис. 6.1. Изменение энергии активации в каталитической реакции. Пунктирная кривая – энергетическая кривая каталитической реакции. E и E' – энергия активации без катализатора и с катализатором, соответственно. Тепловой эффект каталитической реакции Q – такой же, как и в отсутствие катализатора.
Задачи с решениями
Задача 6-1. При гидролизе сахарозы в одном литре водного раствора за 10 мин образовалось 18 глюкозы. Определите среднюю скорость гидролиза сахарозы.
Решение. По определению, средняя скорость реакции за время t выражается через количество образовавшегося продукта Δν следующим образом:
ω = 1 ν .
Vt
В данном случае V = 1 л, Δν = ν(C6H12O6) = 18 / 180 |
= 0,1 моль, t = 10 мин. Подставляя эти |
||||
значения в формулу, находим среднюю скорость: |
|
||||
ω = |
1 |
|
0,1моль |
= 0,01 |
моль/(л мин). |
|
|
||||
1л |
|
10 мин |
|
||
Ответ. 0,01 моль/(л мин).

6
Задача 6-2. Как зависит скорость элементарных реакций: а) C2H5Br → C2H4 + HBr; б) C2H5Br + OH– → C2H5OH + Br–; в) 2NO + O2 → 2NO2 от концентраций реагирующих веществ? Какой суммарный порядок имеют эти реакции?
Решение. Применим закон действующих масс для элементарных реакций.
а) Реакция разложения бромэтана в газовой фазе – мономолекулярная. В одном акте реакции участвует одна молекула, поэтому скорость реакции пропорциональна концентрации этих молекул (коэффициент пропорциональности – константа скорости):
ω= k c(C2 H5Br) .
Вправой части этого выражения – только одна концентрация, причем в первой степени, поэтому реакция имеет первый порядок.
б) Реакция щелочного гидролиза бромэтана проходит в водной среде. В этой элементарной реакции участвуют две частицы, поэтому скорость реакции пропорциональна произведению концентраций этих частиц:
ω= k c(C2 H5 Br) c(OH- ) .
Вправой части этого выражения – две концентрации в первой степени, поэтому суммарный порядок реакции: 1 + 1 = 2.
в) Окисление оксида азота (II) происходит в газовой фазе. В одном акте этой элементарной реакции участвуют три частицы – 2 молекулы NO2 и одна молекула O2, поэтому скорость реакции пропорциональна произведению концентраций этих частиц:
ω= k c(NO) c(NO) c(O2 ) = c(NO)2 c(O2 ) .
Вправой части этого выражения – одна концентрация во второй степени и одна концентрация в первой степени, поэтому суммарный порядок реакции: 2 + 1 = 3.
Ответ. а) Первый порядок; б) второй порядок; в) третий порядок.
6-3. Реакция между водородом и этиленом H2(г) + C2H4(г) → C2H6(г) имеет второй порядок. Как изменится скорость образования этана, если: а) давление в системе увеличить в три раза; б) концентрацию этана увеличить в три раза?
Решение. По закону действующих масс, скорость данной реакции пропорциональна произведению молярных концентраций водорода и этилена:
ω = k c(H2 ) c(C2H4 ).
а) Изменять концентрации реагирующих веществ можно за счет давления в сосуде. Из уравнения Клапейрона-Менделеева следует, что молярная концентрация каждого газа прямо пропорциональна давлению:
PV = νRT c = ν = P .
V RT
При увеличении давления в три раза концентрация каждого газа – и водорода, и этилена – возрастет в три раза, а скорость реакции определяется их произведением, поэтому она возрастет в 9 раз:
7
ω1 = k c1 (H2 ) c1 (C2 H4 ),
ω2 = k 3c1 (H2 ) 3c1 (C2H4 ) = 9ω1 .
б) Скорость реакции не зависит от концентрации продуктов, в данном случае этана (скорость определяется только левой частью уравнения реакции), поэтому она не изменится при увеличении концентрации этана в 3 раза.
Ответ. а) Увеличится в 9 раз; б) не изменится.
Задача 6-4. В реакции 2-го порядка A + B → D начальные концентрации веществ A и B равны, соответственно, 0,5 моль/л и 1,2 моль/л. Начальная скорость реакции равна 1,2×10–3
моль/(л с). Рассчитайте константу скорости и скорость реакции в момент, когда концентрация вещества B равна 1,0 моль/л.
Решение. По закону действующих масс, в любой момент времени скорость реакции
равна:
ω(t) = k c(A) c(B) .
В начальный момент времени ω(0) = 1,2×10–3 моль/(л с), c(A) = 0,5 моль/л, c(B) = 1,2 моль/л, откуда можно найти константу скорости:
k = |
ω(0) |
= |
1,2 ×10 |
−3 моль/(л с) |
= 2 |
×10−3 л/(моль с) . |
|
|
|
||||
|
c(A) c(B) 0,5 моль/л ×1,2 моль/л |
|
|
|||
При других концентрациях константа скорости будет такой же. К моменту, когда концентрация вещества B стала равна 1,0 моль/л, в реакцию вступило 1,2 – 1,0 = 0,2 моль/л вещества B. По уравнению реакции, концентрация прореагировавшего вещества A тоже равна 0,2 моль/л, а осталось его: c(A) = 0,5 – 0,2 = 0,3 моль/л. В этот момент времени скорость реакции равна:
ω(t) = 2×10−3 л/(моль с)× 0,3моль/л×1,0 моль/л = 6×10−4 моль/(л с).
Ответ. k = 2×10–3 л/(моль с), ω = 6×10–4 моль/(л с).
Задача 6-5. Разложение N2O5 на NO2 и O2 при нагревании – реакция первого порядка. Период полураспада N2O5 при температуре 49 оС равен 15 мин. Образец оксида азота (V) массой 20 г выдержали при этой температуре в течение 30 мин. Чему равна масса оксида азота (V) после окончания реакции?
Решение. Зависимость массы вещества m от времени t для всех реакций первого порядка описывается степенной функцией:
|
1 |
t/T1/ 2 |
|
m(t) = m(0) |
|
|
, |
|
|||
|
2 |
|
|
где T1/2 – период полураспада. Подставляя в эту формулу значения t = 30 мин, m(0) = 20 г, T1/2
= 15 мин, находим массу вещества после окончания реакции:
8
|
1 |
30/15 |
|
1 |
|
|
m(30) = m(0) |
|
|
= 20 |
|
= 5 |
г, |
|
|
|||||
|
2 |
|
|
4 |
|
|
т.е. через время, равное двум периодам полураспада, останется четверть от исходной массы вещества.
Ответ. 5 г.
Задача 6-6. Срок хранения автомобильных покрышек при температуре 20 °C равен 5 лет, а при температуре 10 °C – 10 лет. Сколько лет можно хранить покрышки при –10 °C?
Средняя скорость старения резины обратно пропорциональна сроку хранения. Следовательно, при охлаждении от 20 °C до 10 °C скорость старения уменьшится в 10 / 5 = 2 раза. Это означает, что температурный коэффициент скорости γ = 2. При охлаждении еще на 20
оС, от +10 до –10 оС, скорость реакции уменьшится в γ2 = 4 раза:
ω(10o C) |
= γ |
[10−(−10)] /10 |
= γ |
2 |
= 4. |
ω(−10o C) |
|
|
|||
|
|
|
|
|
В такое же число раз возрастет срок хранения, который составит 10 × 4 = 40 лет.
Ответ. 40 лет.
Задачи и упражнения
6-1. Назовите самую быструю и самую медленную из известных вам реакций.
6-2. Рассчитайте среднюю скорость окисления этилового спирта в человеческом организме, если известно, что 100 г вина, содержащего 11,5% спирта, полностью окисляется за 1,5 часа.
6-3. Рассчитайте среднюю скорость химической реакции CO2 + H2 = CO + H2O, если через 80 с после начала реакции молярная концентрация воды была равна 0,24 моль/л, а через 2 мин 07 с стала равна 0,28 моль/л.
6-4. За месяц до начала занятий в школе лаборант приготовил водный раствор пероксида водорода с концентрацией 0,3 моль/л и оставил колбу с раствором на полке. Первого сентября учитель химии готовил демонстрационный опыт и обнаружил, что концентрация H2O2 в колбе уменьшилась вдвое. Рассчитайте среднюю скорость реакции разложения пероксида водорода.
6-5. Перекись водорода при нагревании разлагается с выделением кислорода: 2H2O2 = 2H2O + O2. При начальной концентрации c(H2O2) = 0,156 моль/л половина вещества распалось за 2,5 часа. Рассчитайте среднюю скорость реакции разложения. Какой объем кислорода (в пересчете на н.у.) выделится из 1 л раствора H2O2 за это время?
9
6-6. При каталитическом разложении перекиси водорода половина вещества распалось за 0,8 с при начальной концентрации c(H2O2) = 0,156 моль/л. Рассчитайте среднюю скорость реакции разложения. Во сколько раз увеличилась скорость реакции за счет катализатора (см.
данные предыдущей задачи)?
6-7. Средняя скорость разложения оксида азота (V) при 67 оС равна 0,25 моль/(л мин). Определите время полураспада N2O5 при начальной концентрации 1 моль/л.
6-8. Какие факторы влияют на скорость синтеза аммиака по уравнению N2 + 3H2 = 2NH3? Как можно увеличить скорость этой реакции?
6-9. Какие факторы влияют на скорость коррозии железа по уравнению 2Fe + 3/2 O2 + nH2O → Fe2O3 nH2O? Как можно уменьшить скорость этой реакции?
6-10. Какие факторы влияют на скорость спиртового брожения глюкозы по уравнению C6H12O6 = 2C2H5OH + 2CO2? Как можно увеличить скорость этой реакции?
6-11. Какая из перечисленных величин может принимать только целые значения: а) порядок реакции; б) скорость реакции; в) молекулярность реакции?
6-12. Какая из перечисленных величин может принимать отрицательные значения: а) порядок реакции; б) скорость реакции; в) константа скорости реакции?
6-13. Чему равен порядок элементарных реакций: а) CH3Br → CH3 + Br; б) Сl + H2 = HCl + H?
6-14. Напишите выражение закона действующих масс для следующих элементарных реак-
ций:
а) N2O4 → 2NO2;
б) 2NO → N2 + O2;
в) 2C2F4 → C4F8;
г) 2NO + Cl2 → 2NOCl. Определите общий порядок этих реакций.
6-15. Вещество A распадается по реакции первого порядка. Начальная концентрация c(A) = 0,2 моль л–1. Рассчитайте константу скорости этой реакции, если начальная скорость реакции равна 2,0 10–5 моль л–1 с–1.
6-16. Вещества A и B участвуют в реакции второго порядка. Начальная концентрация обоих веществ равна 0,4 моль л–1. Рассчитайте константу скорости этой реакции, если начальная скорость реакции 6,4 10–4 моль л–1 с–1.
10
6-17. Скорость реакции второго порядка A + B → D равна 2,7 10–7 моль/(л с) при концентрациях веществ A и B, соответственно, 3,0 10–3 моль/л и 2,0 моль/л. Рассчитайте константу скорости.
6-18. Для реакции с участием вещества A было проведено два измерения начальной скорости реакции при разных условиях. При концентрации 0,5 моль л–1 скорость реакции составила 2,0 моль л–1 с–1, а при концентрации 1,0 моль л–1 – 4,0 моль л–1 с–1. Определите порядок реакции по веществу A.
6-19. Определите размерность константы скорости для реакции первого порядка, если скорость выражена в моль/(л с).
6-20. Реакция разложения C2H5Br(г) → C2H4(г) + HBr(г) имеет первый порядок. Как нужно изменить давление, чтобы скорость разложения уменьшилась в 5 раз?
6-21. Реакция между водородом и иодом H2(г) + I2(г) → 2HI(г) имеет второй порядок. Как изменится скорость образования иодоводорода, если: а) концентрацию H2 увеличить в три раза; б) концентрацию H2 увеличить в три раза, а I2 – в два раза; в) давление в системе увеличить в три раза; г) концентрацию HI увеличить в 1,5 раза?
6-22. Период полураспада бромэтана по уравнению C2H5Br = C2H4 + HBr при некоторой температуре равен 30 мин. За какое время исходная масса бромэтана уменьшится в 16 раз?
6-23. Разложение сложного эфира CH3COOC2H5 при нагревании – реакция первого порядка. Образец эфира массой 66 г нагрели до температуры реакции, и через 42 мин масса исходного вещества составила 16,5 г. Рассчитайте период полураспада эфира.
6-24. Скорость некоторой реакции увеличивается в 3 раза при повышении температуры на 10
оC. Во сколько раз увеличится скорость реакции при повышении температуры от 10 до 50°С?
6-25. Скорость некоторой реакции увеличивается в 2,8 раза при повышении температуры на 10 оC. Во сколько раз уменьшится скорость реакции при охлаждении от 30 до 10°С?
6-26. Скорость реакции при 20 и 40 оС равна, соответственно 0,02 моль/( л мин) и 0,125 моль/( л мин). Определите скорость реакции при 10 оС.
6-27. Срок хранения креветок при температуре –3 оС равен 72 часа, а при температуре –23 оС
– один месяц. Сколько времени креветки можно хранить при температуре –13 оС?
