
2.Химия р-элементов
2.1.Напишите уравнения следующих реакций:
|
Гидролиз BCl3 |
NH3 + 3 O2 –t |
|
H3BO3 + NaOH |
S + HNO3 (конц.) |
|
Al4C3 + Н2O |
KI + KNO2 + H2SO4 |
|
AlСl3 + Na2S + Н2O |
Р + КОН + Н2О |
|
KAl(SO4)2 + K2CO3 + Н2O |
PCl3 + KOH |
|
Pb(NO3)2 + Na2CO3 + H2O |
H3AsO3 + Zn + HCl |
|
SiH4+ 2H2О |
Сl2 + KOH –t |
|
Гидролиз SiF4 |
S + KOH -t |
|
(NH4)2SnS2 + HCl |
SO2 + H2S |
|
Pb + H2SO4 (конц.) |
Гидролиз Al2S3 |
Решение
1) 2NaOH + 4H3BO3 → Na2B4O7 + 7H2O
2) Al4C3 + 12 H2O → 4 Al(OH)3↓ + 3CH4↑
3) 2KAl(SO4)2 + 2H2O → K2SO4 + 2Al(OH)SO4 + H2SO4
4) Pb(NO3)2 + Na2CO3 → PbCO3↓ + 2NaNO3 (водные растворы)
5) SiH4+ 2H2О → SiO2 + 4H2↑
6) SiF4 + 2Н2О → SiO2 + 4HF
7) Pb + 2 H2SO4 (конц.) → PbSO4 + SO2↑ + 2H2O
8) 3 NH3 + 3 O2 → 2N2 + 6H2O
9) S + 6 HNO3 (конц. → H2SO4 + 6NO2↑ + 2H2O
10) 2 KI + 2 KNO2 + 2 H2SO4 → I2 + 2 K2SO4 + 2NO + 2H2O
11) 4 Р + 3 КОН + 3 Н2О → PH3 + 3KH2PO2
12) PCl3 + 5 KOH → K2[HPO3] + 3KaCl + 2 H2O
13) H3AsO3 + 3 Zn + 6 HCl → AsH3 + 3 ZnCl2 + 3H2O
14) Сl2 + 2 KOH → KCl + KClO + H2O
15) 3S + 6 KOH → K2SO3 + 2 K2S + 3H2O
16) Гидролиз Al2S3
Al2S3 + 6H2O → 2Al(OH)3↓ + H2S↑
Задача 2.2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Si SiO2 SiCl4 K2SiO3 SiO2 SiF4
Sn SnSO4 Sn(SO4)2 K2[Sn(OH)6] SnS2 (NH4)3SnS3.
P4 … PH3 H3PO4 MgHPO4 Mg2P2O7
Решение
а) Si → SiO2 → SiCl4 → K2SiO3 → SiO2 → SiF4
Si +О2 → SiO2
SiO2 + 4 HCl → SiCl4 + 2 H2O
SiCl4 + 2 KOH → K2SiO3 + HCl
K2SiO3 + 2HCl → 2KCl + SiO2↓ + H2O
SiO2 + 4HF → SiF4 + 2H2O.
б) Sn → SnSO4 → Sn(SO4)2 → K2[Sn(OH)6] → SnS → (NH4)3SnS3
Sn +H2SO4 (разб) → SnSO4 + H2↑
Sn + 4H2SO4(конц) → Sn(SO4)2 + 4H2O + 2SO2
Sn + 2KOH +2H2O → K2[Sn(OH)4] + H2↑
K2[Sn(OH)4] +2 H2S → SnS + K2SO4 +2 H2O
SnS + (NH4)2S2 → (NH4)2SnS3
в) P4 → ….→ PH3 → H3PO4 → MgHPO4 → Mg2P2O7
8P + 12H2O → 2PH3↑ + 3H3PO4
H3PO4 + MgOH → MgHPO4 + H2O
2MgHPO4 → Mg2P2O7 + 2 H2O
Задача 2.3. Равновесие реакции: N2(г) + 3H2(г) = 2NH3(г) установилось при следующих концентрациях: [N2]=0,5 моль/л; [H2]=0,1 моль/л; [NH3]=1,6 моль/л. Определите константу равновесия и исходные концентрации азота и водорода.
Решение
Константа равновесия равна отношению произведения равновесных концентраций (парциальных давлений) продуктов реакции в степенях, равных стехиометрическим коэффициентам в уравнении реакции, к произведению равновесных концентраций (парциальных давлений) исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для гомогенной реакции синтеза аммиака уравнение константы равновесия имеет вид:
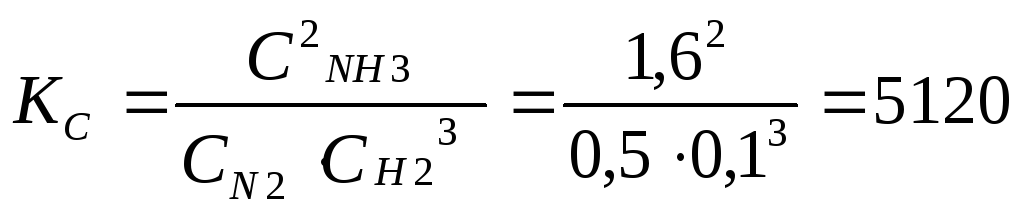
Принимаем, что объем системы равен 1 л, тогда количества веществ равны концентрациям. Равновесные концентрации продуктов реакции С и изменения концентрации исходных веществ к моменту равновесия ΔС будут пропорциональны стехиометрическим коэффициентам соответствующих веществ в уравнении реакции. Начальная концентрация азота определяется из соотношения:
Со = С + ΔС
Составляем пропорцию, согласно коэффициентам уравнения реакции:
при образовании 2 молей NH3 расходуется 1 моль N2
« « 1,6 молей NH3 « « х молей N2
Откуда х = ΔС = 0,8 моля/л
Со = 0,5 + 0,8 =1,3 моль/л
при образовании 2 молей NH3 расходуется 3 моль Н2
« « 1,6 молей NH3 « « х молей Н2
Откуда х = ΔС = 2,4 моля/л
Со = 0,1 + 2,4 =2,5 моль/л
Ответ: 5120; 1,3 моль/л; 2,5 моль/л
Задача 2.4. В одном объеме воды при 00С растворяется 1176 объемов NH3, измеренного при нормальных условиях. Какова процентная концентрация получающегося при этом раствора.
Решение
Массовая доля растворенного вещества (ω) показывает число граммов (единиц массы) растворенного вещества, содержащегося в 100 г (единиц массы) раствора.
Для решения задачи принимаем, что 1 объем равен 1 л. Определяем массу 1176 объемов аммиака:
![]() Поскольку
М (NH3)
= 17 г/моль, то mв-ва
= 52,5*17 = 367,5 г
Поскольку
М (NH3)
= 17 г/моль, то mв-ва
= 52,5*17 = 367,5 г
mр-ра = 1000 + 367,5 = 1367,5 г
![]()
Ответ: 26,87%
Задача 2.5. Рассчитать молярность, моляльность и титр серной кислоты, массовая доля которой равна 100%, а плотность- 1,838 г/см3.
Решение
Определяем массу 1 л раствора:
mр-ра = 1000 * 1,838 = 1838 г
Поскольку массовая доля H2SO4 100%, следовательно, в 1 л раствора содержится 1838 г серной кислоты
Молярная концентрация – это концентрация, которая показывает число молей вещества, содержащегося в 1 л раствора.
![]()
Моляльность показывает число молей растворенного вещества, содержащегося в 1000 г растворителя
![]()
Титром раствора (Т) называется число граммов растворенного вещества содержащихся в 1см3 раствора.
Так как в 1 дм3(л) раствора содержится 1838 г кислоты, то Т = 1838/1000 =1,838 г/см3
Ответ: 1876 М; 18,76 m; 1,838
Список использованной литературы
1. Ахметов Н.С. Общая и неорганическая химия. Учебник.–М.: Высшая школа, 2008. – 743 с.
2. Глинка Н.Л. Общая химия. - М.: Интеграл-Пресс, 2006.- 702 с.
3. Задачи и упражнения по общей химии: учебное пособие /Мин. образов. и науки РФ; под ред. Н.В. Коровина.– М.: Высшая школа, 2008
4. Коровин Н.В. Общая химия: учеб. для технических направлений и спец. вузов / Н.В. Коровин – 12 изд. М.: Высшая школа, 2010. - 557 с.
