
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •5. Реакции переноса.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •5. Реакции переноса.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
5. Реакции переноса.
При реакциях переноса атом или группа атомов переходит от одной структурной единицы к другой:
АВ + ВС = А + В2С,
А2В + 2СВ2 = АСВ2 +АСВ3.
Например:
2AgCl + SnCl2 = 2Ag + SnCl4,
H2O + 2NO2 = HNO2 + HNO3.
Классификация реакций по фазовым признакам
В зависимости от агрегатного состояния реагирующих веществ различают следующие реакции:
1. Газовые реакции
|
|
to |
|
|
H2 + Cl2 |
= |
2HCl. |
2. Реакции в растворах
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н2О(ж)
3. Реакции между твердыми веществами
|
|
to |
|
|
СаО(тв) +SiO2(тв) |
= |
СаSiO3(тв) |
Классификация реакций по типу переносимых частиц
1. Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например:
|
CH3COOH |
+ H2O = |
CH3COO- + |
H3O+ |
|
кислотаI |
основаниеI |
основаниеI |
кислотаII |
|
NH3 + |
H2O = |
NH4+ + |
OH- |
|
основаниеI |
кислотаII |
кислотаII |
основаниеII |
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
3. Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2,
Fe + 5CO = [Fe(CO)5],
Al(OH)3 + NaOH = [NaAl(OH)4].
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
Обратимые и необратимые химические реакции
Билет №10
Проблемное обучение химии как средство воспитания и развития учащихся
Проблемное обучение — это развивающее обучение, так как мыслить человек начинает лишь тогда, когда у него есть потребность что-то понять. А такая потребность возникает лучше всего в условиях проблемного обучения. Следовательно, задача, которая стоит перед учителем в рамках проблемного обучения, — определить, как и когда его использовать. Учащиеся же должны решать проблемы, которые ставит перед ними учитель. Главное при осуществлении проблемного обучения — проанализировать содержание, чтобы обнаружить в нем проблемы, а затем выстроить их в порядке подчинения друг другу. В этом случае использование проблемного обучения приобретает свойство системности, что очень важно для развития мышления.
Например, идея зависимости свойств веществ от их состава является центральной проблемой, рассматриваемой в разных конкретных темах. Решение этой общей проблемы зависит от более частных. После изучения теории строения атома более общая проблема зависимости свойств элементов от строения их атомов может расчленяться в процессе решения на частные: почему сходны свойства у лития и натрия? Почему свойства элементов изменяются периодически? Почему, несмотря на нарушение последовательности возрастания относительных атомных масс, аргон и калий имеют соответственно порядковые номера 18 и 19, а не наоборот? Другими словами, на каждой ступени обучения свои проблемы, которые учащиеся решают в зависимости от уровня подготовки по предмету и своего развития.
Способы выявления учебных проблем в химии
Учебные проблемы легко обнаруживаются при установлении связей между теориями и фактами, между теориями и понятиями, между отдельными понятиями и т. д. Проблемы объяснения свойств веществ на основе их строения и, наоборот, заключение о строении вещества на основе его свойств возникают при выявлении связей между теорией строения вещества и системой понятий о веществе.
Для того чтобы отыскать учебную проблему, необходимо проанализировать содержание, а для того чтобы это сделать, нужно прежде всего вскрыть его структуру, т. е. выделить элементы содержания и связи между ними, а также внутрипредметные связи с предыдущими и последующими темами. Например, при изучении свойств аммиака вначале характеризуют строение атомов элементов азота и водорода, строение молекулы аммиака, определяют степени окисления атомов азота и водорода в аммиаке, а затем химические свойства этого соединения.
Проблемное обучение практически возможно на любом этапе обучения, но по-разному реализуется в зависимости от химического содержания учебного материала и возрастных особенностей учащихся.
Признаки учебной проблемы следующие: наличие проблемной ситуации, готовность субъекта к поиску решения, возможность неоднозначного пути решения. Их можно считать условиями осуществления проблемного обучения.
Этапы осуществления проблемного подхода:
Первый этап. Подготовка к восприятию проблемы. На этом этапе проводится актуализация знаний, которые необходимы для того, чтобы учащиеся могли решить проблему, так как при отсутствии необходимой подготовки они не могут приступить к решению. Например, если поставить перед учащимися VII класса вопрос, почему вещества, имеющие одинаковый количественный и качественный состав, обладают разными свойствами, эта важнейшая химическая проблема не вызовет потребности ее решать, так как их знаний пока недостаточно.
Второй этап. Создание проблемной ситуации. Это самый ответственный и сложный этап проблемного подхода, который характерен тем, что учащийся не может выполнить задачу, поставленную перед ним учителем, с помощью имеющихся у него знаний и должен дополнить их новыми. Учащийся обязан осознать причину этого затруднения. Однако проблема должна быть посильной. Класс может быть готов к ее решению, но учащиеся должны получить установку к действию. Они примут задание к исполнению, когда будет четко сформулирована проблема.
Третий этап. Формулирование проблемы — это итог возникшей проблемной ситуации. Она указывает, на что учащиеся должны направить свои усилия, на какой вопрос искать ответ. Это познавательная задача, которую ставит перед учащимися учитель. Если учащиеся систематически вовлекаются в решение проблем, они могут сформулировать проблему сами.
Четвертый этап. Процесс решения проблемы. Он состоит из нескольких ступеней: а) выдвижение гипотез; б) построение плана решения для проверки каждой гипотезы; в) подтверждение или опровержение гипотезы.
Пятый этап. Доказательство правильности избранного решения, подтверждение его, если возможно, на практике.
Способы создания проблемных ситуаций
1. Демонстрация или сообщение некоторых фактов, которые учащимся неизвестны и требуют для объяснения дополнительной информации. Они побуждают к поиску новых знаний. Например, учитель демонстрирует аллотропные видоизменения элементов и требует объяснить, почему они возможны или, например, учащиеся еще не знают, что хлорид аммония может возгоняться, а им предлагают вопрос, как разделить смесь хлорида аммония и хлорида калия.
2. Использование противоречия между имеющимися знаниями и изучаемыми фактами, когда на основании известных знаний учащиеся высказывают неправильные суждения. Например, учитель задает вопрос: может ли при пропускании оксида углерода (IV) через известковую воду получиться прозрачный раствор? Учащиеся на основании предшествующего опыта отвечают отрицательно, а учитель показывает опыт с образованием гидрокарбоната кальция.
3. Объяснение фактов на основании известной теории. Например, почему при электролизе раствора сульфата натрия на катоде выделяется водород, а на аноде — кислород? Учащиеся должны ответить на вопрос, пользуясь справочными таблицами: рядом напряжений металлов, рядом анионов, расположенных в порядке убывания способности к окислению, и сведениями об окислительно-восстановительной сущности электролиза.
4. С помощью известной теории строится гипотеза и затем проверяется практикой. Например, будет ли уксусная кислота как кислота органическая проявлять общие свойства кислот? Учащиеся высказывают предположения, учитель ставит эксперимент, а затем дается теоретическое объяснение.
5. Нахождение рационального пути решения, когда заданы условия и дается конечная цель. Например, учитель предлагает экспериментальную задачу: даны три пробирки с веществами. Определить эти вещества наиболее коротким путем, с наименьшим числом проб.
6. Нахождение самостоятельного решения при заданных условиях. Это уже творческая задача, для решения которой недостаточно урока. Нужно дать учащимся подумать дома, использовать дополнительную литературу, справочники. Например, подобрать условия для определенной реакции, зная свойства веществ, вступающих в нее, высказать предположения по оптимизации изучаемого производственного процесса.
7. Принцип историзма также создает условия для проблемного обучения. Например, поиск путем систематизации химических элементов, приведший в конечном счете Д. И. Менделеева к открытию периодического закона. Многочисленные проблемы, связанные с объяснением взаимного влияния атомов в молекулах органических веществ на основе электронного строения, также являются отражением вопросов, возникавших в истории развития органической химии.
При использовании проблемного подхода нужно помнить, что только тогда можно говорить о развитии мышления, когда проблемные ситуации используются регулярно, сменяя одна другую, т. е. характеризуются динамичностью.
Наиболее удачно найденной проблемной ситуацией следует считать такую, при которой проблему формулируют сами учащиеся.
Важной положительной стороной проблемного обучения является его развивающий характер. Изложение делается более доказательным и потому убедительным. Учащиеся мыслят творчески, диалектически, приучаются к поиску. Обучение с использованием такого подхода более эмоционально, что способствует повышению интереса к учению, оказывает воспитывающее воздействие, так как это формирует убеждения и в конечном счете мировоззрение, обеспечивает прочность знаний, так как знания, добытые путем самостоятельного поиска, всегда удерживаются сознанием дольше полученных в готовом виде.
В результате осуществления проблемного подхода учащиеся приобретают новые знания, устанавливают новые связи между известными и неизвестными фактами и понятиями. Проблемное обучение можно использовать и как способ диагностики интеллектуальных возможностей учащихся.
К недостаткам проблемного подхода следует отнести слабую управляемость мыслительным процессом. Однако в этом заключено и его преимущество, так как творческое мышление требует свободы. Осуществление проблемного подхода требует гораздо больше времени.
Требования к домашнему заданию при изучении химии
Учитель задает домашнее задание до звонка, давая необходимые разъяснения по его выполнению.
Во избежание перегрузки учащихся учитель обеспечивает правильную дозировку заданий по объему и сложности.
Время на выполнение дз 30 минут – 1 час.
Продумывать дифференцированные индивидуальные домашние задания для сильных и слабоуспевающих учащихся.
В качестве домашнего задания учителю необходимо использовать творческие работы по предмету.
Проиллюстрировать возможности использования периодического закона и периодической системы на примере изучения химии элементов IIA подгруппы в 9 классе
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Переодический закон возможности использования ПС в кач ЛОС
1. Опрелять число электронов и протонов в атоме эелементов (порядковый номер)
2. Определять массовое число природной смеси изотопов
А=N1*f1+...
3. Опрелеять атомы каких элементов имеют стабильные изотопы, а какие не имеют(в квадратных скобках указаны радиоактивные элементы
4. определять число электронных слоев, на которых находится электрон Номер периода
5. определять число электронов на внешнем слое номер группы
6. определять высшую положительную и высшее отрицательную сткпень окисления( условный заряд электролита вычисленный из предположения что соединение состоит из простых ионов)
7. Определить валентность элемента( номер группы или 8-томер)
8. опрелелять отношение к металлам или не металлам
9. определять формулу оксидов
10. определять формулу соединений с водородом
11. оценить электроотрицательность
12. оценить проявляет ли вещество простое вещество элемента св-ва окисления и восстановления
13. предположить возможность протекания реакции
14. вещества в пр/пол. Колонках им. Высок.хим. Сродства
X= ЭО=1/2(J+E)
В главных подгруппах с увеличением порядкового номера:
1) Усиливаются металлические свойства
2) Ослабевают неметаллические свойства
3) Высшая валентность равна номеру группы.
4) атомный радиус - в подгруппе сверху вниз возрастает;
5) энергия ионизации - в подгруппе уменьшается;
6) электроотрицательность - в подгруппе уменьшается
Во 2 группе главной подгруппе элементы с валентностью 2, и СО +2, 0. Гидроксиды имеют вид Э(ОН)2, способны образовывать оксиды ЭО, гидриды ЭН2.
Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы. У элементов I и II групп электронами заполняется s–подуровень, поэтому они называются s–элементами. У элементов III - VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d–подуровня предпоследнего слоя, а у лантаноидов и актиноидов f- -подуровня предпредпоследнего слоя.
Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Билет №11
Химия как предмет в современной школе
Химия как учебный предмет формирует личность учащегося.
Для достижения целей, стоящих пред школьным обучение химии преподаватель ставит пред собой задачи, решение которых осуществляется с позиции единства обущающей, воспитальной и развивающей функции.
Школьный курс химии должен: обеспечивать сознательное освоение науки, знакомить с методами науки формирование научного мировоззрения, формировать интерес к предмету, бережное отношение к природе
развивать мышления учащихся, их активность в овладении знаниями, обеспечивать принцип политехнизма, знакомить с главными направлениями в химической промышленности и сельском хозяйстве
Формирование содержания школьного курса химии и требование к нему.
Формирование содержания определяется тем по какой программе работает школа линейной или цикличной.При цикличной программе учитель должен за 8-9 класс дать знанию позволяющее человеку жить в современном обществе.
Недостаток цикл. Программы отсутствие логической последовательности и необходимоссть преодоления барьера знакомости в 10-11 кл.
Почасовое планирование должно быть у каждого учителя
Линейная программа построена таким образом — 8кл общая химия 9- неорг, 10-11 органич и повторение и углубление материала.
В настоящее время существует 3 проф. Школ. В которых по разному ведется преподавание химии: школа с гуманитарным уклоном; школа с углубленным изучением химии; общественно-образовательная школа
Дидактические требования, содержание образования должно быть представлено 4 видам, которые взаимосвязаны : система научных знаний, система умений, опыт творческой деятельности , опыт отношения к окружающей действительности
Принципы: Научность, доступность, систематичность, индуктивный подход, дидуктивный подход, историзм, политехнизм.
Развитие экспериментальных способностей учащихся в обучении химии
Ученический эксперимент — это вид самостоятельной работы. В школьной программе по химии оговорено, какие экспериментальные работы должны быть выполнены.
Эксперимент не только обогащает учащихся новыми понятиями, умениями, навыками, но и является способом проверки истинности приобретенных ими знаний, способствует более глубокому пониманию материала, усвоению знаний. Он позволяет более полно осуществлять связь с жизнью, с будущей практической деятельностью учащихся.
Ученический эксперимент разделяют на лабораторные опыты и практические занятия. Они различаются по дидактической цели. Цель лабораторных опытов — приобретение новых знаний, изучение нового материала. Практические занятия обычно проводятся в конце изучения темы и служат для закрепления и совершенствования, конкретизации знаний, формирования практических умений, совершенствования уже имеющихся умений и навыков учащихся.
Выполнение ученического эксперимента с точки зрения процесса учения должно проходить по следующим этапам : 1осознание цели опыта;2изучение веществ;3сборка или использование готового прибора;4выполнение опыта;5анализ результатов и выводы;6объяснение полученных результатов и составление химических уравнений;7составление отчета.
После анализа работы, который учащийся должен сделать самостоятельно, он делает вывод на основе соответствующей теоретической концепции. Он учит краткому и точному формулированию мысли, правильной записи.
Лабораторные опыты по химии могут быть индивидуальными (опыты выполняют все учащиеся индивидуально), групповыми (учащиеся, сидящие за одним столом, выполняют одну и ту же работу, но функции между ними распределены), коллективными (учащиеся, сидящие за разными столами, выполняют разные опыты, а затем, получив результат, докладывают о нем в классе и делают коллективные выводы).
Место лабораторного опыта в структуре урока, как правило, отводится в процессе изучения нового материала; учащихся можно о нем заранее не предупреждать.
Успех лабораторного опыта на уроке зависит от его подготовки.
После окончания работы организовывают обсуждение ее результатов. Оформлять результаты опыта следует в рабочих тетрадях. Хотя единых требований к оформлению записей опытов нет, лучше осуществлять их по графам, так как без них учащиеся пишут очень много лишних слов.
Часть тетрадей учитель после лабораторного опыта собирает, но оценку ставит только тем учащимся, которые были взяты специально под контроль, так как охватить всех учащихся целенаправленным наблюдением невозможно.
Поскольку лабораторные работы проводятся в процессе объяснения материала, их приходится проводить так, чтобы не терялась нить изложения. Однако при этом недостаточное внимание уделяется формированию практических умений и навыков.
Практические занятия по химии. Выработке умений и навыков уделяется очень большое внимание на практических занятиях, которые проводятся уже с VIII класса, где играют особенно большую роль. Они образуют строгую систему формирования практических умений.
Практические занятия бывают двух видов: проводимые по инструкции и экспериментальные задачи.
Диагностика может вскрыть несоответствие учебного материала возрастным особенностям учащихся, указать на недостаточный бюджет времени для его изучения или на гигиенические условия работы класса.
Диагностика — обязательный элемент методического исследования.
Методика изложения понятий «атом», «элемент» и «молекула» в 8 классе
ХЭ может существовать в трех формах: свободные атомы, простые вещества и сложные вещества. Понятие «атом» возникло еще в античном мире для обозначения частиц вещества. С греч. «неделимый».
Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в в периодической системе и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
Атом обладает различными свойствами: атомной массой, атомным радиусом, магнитным моментом, энергетическими уровнями, валентностью. Так же атом элемента способен к радиоактивному распаду, в следствие чего он переходит в другой элемент.
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева[1]. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева.
Формой существования химических элементов в свободном виде являются простые вещества
|
атомная масса |
|
заряд иона |
|
|
Символ элемента |
|
|
порядковый номер |
|
число атомов в молекуле |
Примеры:
 —молекула водорода,
состоящая из двух атомов водорода
—молекула водорода,
состоящая из двух атомов водорода —ион медис
зарядом 2+
—ион медис
зарядом 2+
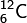 —атом углеродасзарядом
ядра, равным 6 иатомной
массой, равной 12.
—атом углеродасзарядом
ядра, равным 6 иатомной
массой, равной 12.
Молекула (новолат. molecula, уменьшительное от лат. moles — масса) — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества.
Билет №12
Цели и задачи обучения химии в средней школе. Образовательные, воспитательные и развивающие функции обучения в изучении химии
Химия формирует личность учащихся. Для достижения этой цели обучение химии ставит перед собой задачи, решение которых осуществляется с позиции единства образовательной, воспитывающей и развивающей функции обучения. Школьный курс химии должен знакомить учащихся с основами науки, т.е.
* обеспечивать сознательное усвоение учащимися важнейших химических законов, теорий, понятий, знакомить с методами химической науки.
* формировать научное мировоззрение, а также понятие того, что химическое образование – обязательный элемент культуры.
* воспитывать трудолюбие, нравственность, интерес к предмету, понимание приоритета человеческих ценностей.
* развивать мышление учащихся, их самостоятельность и творческую активность в овладении знаниями.
* обеспечить знакомство с главными направлениями химизации народного хозяйства, с возрастающим значением химии в окружающей действительности.
* формировать практические умения и навыки, способствовать профориентации.
Выбор экспериментальных методов обучения (демонстрационный эксперимент, лабораторные и практические работы) в преподавании химии
Демонстрационный эксперимент. Важнейшим из словесно-наглядных методов обучения является использование демонстрационного химического эксперимента. Химический эксперимент в обучении позволяет ближе ознакомить учащихся не только с самими явлениями, но и с методами химической науки. Демонстрационным называют эксперимент, который проводится в классе учителем, лаборантом или иногда одним из учащихся. Демонстрационные опыты по химии указаны в программе, но учитель может заменить их другими, эквивалентными в методическом отношении, если у него отсутствуют требуемые реактивы.
Лабораторные работы.Лабораторные опыты по химии могут быть индивидуальными, коллективными.Место лабораторного опыта в структуре урока, как правило, отводится в процессе изучения нового материала; учащихся можно о нем заранее не предупреждать.спех лабораторного опыта на уроке зависит от его подготовки. Прежде всего нужно продумать расстановку и подбор оборудования на каждом столе.После окончания работы организовывают обсуждение ее результатов. Оформлять результаты опыта следует в рабочих тетрадях. Хотя единых требований к оформлению записей опытов нет, лучше осуществлять их по графам, так как без них учащиеся пишут очень много лишних слов.
Практические занятия по химии.Выработке умений и навыков уделяется очень большое внимание на практических занятиях, которые проводятся уже с VIII класса, где играют особенно большую роль.Вначале изучаются некоторые приемы препаративной химии — приобретаются умения обращаться с нагревательными приборами, инструментами, осваиваются приемы лабораторной техники (нагревание веществ, разделение смесей), изучаются элементарные правила техники безопасности. Затем учащиеся получают простое вещество, например кислород, при разложении сложного и исследуют его свойства. Следующий этап — получение сложного вещества, например сульфата меди, и выделение его из раствора, затем приготовление раствора из сухого вещества. Практические занятия бывают двух видов: проводимые по инструкции и экспериментальные задачи.
Методика изложения понятия «оксиды» в 8 классе- определение, классификация, получение, свойства
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды (например, оксид натрияNa2O, оксид меди(II)CuO): оксиды металлов,степень окислениякоторых I—II;
кислотные оксиды (например, оксид серы(VI)SO3, оксид азота(IV)NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинкаZnO,оксид алюминияAl2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II)СО,оксид азота(I)N2O, оксид азота(II)NO.
|
Основные-реагируют с избытком кислоты с образованием соли и воды.Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами МgO+2HCl=MgCl2+H2O 3.С кислотнями оксидами CaO+CO2=CaCO3 4.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 |
Амфотерные (ZnO, Al2O3,Cr2O3, MnO2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 |
Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
Получение
1. Взаимодействие простых веществ (за исключением инертных газов,золотаиплатины) скислородом:
2Н2 + O2 = 2H2O 2Cu + O2 = 2CuO
При горении в кислородещелочных металлов(кромелития), а такжестронцияибарияобразуютсяпероксидыинадпероксиды:
2 Na + O2 = Na2O2 K + O2 = KO2
2. Обжиг или горение бинарных соединенийвкислороде:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 Cs2 + 3O2 = CO2 + 2SO2 2PH3 + 4O2 = P2O5 + 3H2O
3. Термическое разложение солей:
CaCO3 = CaO + CO2 2FeSO4 = Fe2O3 + SO2 + SO3
4. Термическое разложение основанийиликислот:
2Al(OH)3 = Al2O3 + 3H2O 4HNO3 = 4NO2 + O2 + 2H2O
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
4FeO + O2 = 2Fe2O3
6. Взаимодействие некоторых металловс водой при высокой температуре:
Zn + H2O = ZnO + H2
7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
8. Взаимодействие металлов с кислотами-оксилителями:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
9. При действии водоотнимающих веществ на кислотыисоли:
2KClO4 + H2SO4 = K2SO4 + CL2O7 + H2O
10. Взаимодействие солей слабых неустойчивых кислотс более сильнымикислотами:
NaHCO3 + HCl = NaCl + H2O + CO2
