
-
Сосновская н.Г., учебное пособие «экологические проблемы
ЭЛЕКТРОХИМИЧЕСКИХ ПРОИЗВОДСТВ»
Электрохимическая деструкция
При электрохимической деструкции происходит изменение рН и Е в объеме раствора за
счет электродных процессов. В прикатодном слое происходит подщелачивание электролита при разряде на катоде ионов или молекул воды, в прианодном слое раствора — подкисление среды за счет разряда ионов ОН— или молекул воды на поверхности анода. Если катодный или анодный процесс исключает разряд молекул воды, то происходит накопление только ионов Н+ или ОН—.
Величина E изменяется аналогично изменению величины рН с той разницей, что на по-
верхности электродов и в объеме раствора происходят электронные изменения, а в растворе накапливаются продукты окислительно-восстановительных реакций. Численно величина E в об щей форме может быть определена по известному уравнению Нернста.
Существенное влияние на величину E раствора оказывают ионы металлов переменной
валентности, выделяющиеся в раствор при ионизации металлических анодов (катодов). В первую очередь к ним следует отнести ионы Fe2+, преимущественно выделяющиеся при растворении железных анодов. Ионы Fe2+, обладающие восстановительными свойствами, находятся в растворе в равновесии с ионами Fe3+ и молекулярным кислородом, обладающим окислительными свойствами. Ионы хрома Сr6+, выделяющиеся при использовании анодов из хромоникелевых сталей, придают раствору окислительные свойства.
Наибольший сдвиг в область положительных значений E ≥ (1,0÷1,2) В, превышающих потенциалы верхнего предела устойчивости воды, обеспечивают ионы хлора, разряжающиеся на аноде. За счет хорошей растворимости в воде газообразного хлора в слабокислых и нейтральных растворах образуется ион гипохлорита, а при высоких рН — хлорноватистая кислота. Эти соединения должны окислять воду до тех пор, пока E не сдвинется в область термодинамической устойчивости.
Менее существенно влияют на величину E выделяющиеся при электролизе кислород и водород. Как установлено расчетами, величину E воды, нейтральной с точки зрения окислительно-восстановительного взаимодействия, можно повысить за счет растворения кислорода только на 0,526 В (до верхнего предела устойчивости +0,814 В), а за счет растворения водорода — понизить на 0,9 В (до нижнего предела устойчивости —0,414 В). Разумеется, если жидкость содержит вещества, легко окисляющиеся кислородом или восстанавливающиеся водородом, то при сдвиге потенциала от равновесного достижение предельных значений E возможно только после их полного окисления или восстановления.
Величина E природных и сточных вод, подвергающихся электролизу, зависит от многих
факторов:
- температуры раствора и ее изменения;
- перемешивания электролита;
- продолжительности контакта с воздухом;
- координаты точки отбора пробы для оценки этого значения.
Для электрокорректирования рН и E применяют как бездиафрагменные, так и диафрагменные электролизеры.
Бездиафрагменные электролизеры используются в тех случаях, когда процессы, протекающие на поверхности рабочего электрода, необратимы или изменение свойств раствора в приэлектродных зонах не влияет отрицательно на выход требуемых продуктов.
Диафрагменные электролизеры обеспечивают разделение продуктов электродных реак-
ций, смешение которых исключает эффект изменения рН и E. Как правило, разделение продуктов реакций осуществляется с помощью ионообменных или инертных диафрагм. Разделение можно производить также без диафрагм, отбирая католит и анолит непосредственно из приэлектродных зон.
Наиболее широко в практике водоочистки используется бездиафрагменный электролиз с
нерастворимыми электродами в присутствии хлор-ионов, при котором редокси-потенциал обрабатываемой воды повышается до значений 0,9÷1,1 В за счет образования молекулярного хлора, хорошо растворяющегося в воде. Этот метод нашел также применение для окисления простых и комплексных цианидов.
При растворении железных анодов в бездиафрагменном электролизере происходит снижение E среды до значений — (0,4÷ 0,8) В за счет перехода в раствор ионов двухвалентного железа, обладающего восстановительными свойствами. Это позволяет восстанавливать шестивалентный хром в сточных водах гальванического производства, меховых фабрик и др.
Базовый электрокорректор рН состоит из катодных и анодных камер, разделенных элек-
тродными блоками-модулями, подводящих и отводящих лотков и арматуры (рис.).
Конструктивной особенностью блока электродов является то, что он состоит из перфори-
рованных катодов и инертных анодов (ОРТА, графит, нержавеющая сталь и др.). При этом сами электроды и диафрагма плотно прижаты друг к другу с изоляцией внутренней поверхности электродов специальным материалом (лаки, краски и др.). Электрокорректоры могут быть выполнены фильтр-прессного или емкостного типов.
При обработке воды с высоким солесодержанием (1÷5 г/л) возможно обычное размещение
электродов или устройство блоков-модулей без диафрагмы с уменьшением размеров отверстий в электродах до 1÷3 мм. Вместо диафрагмы можно использовать сплошную диэлектрическую пластину, не доходящую до дна корпуса аппарата.
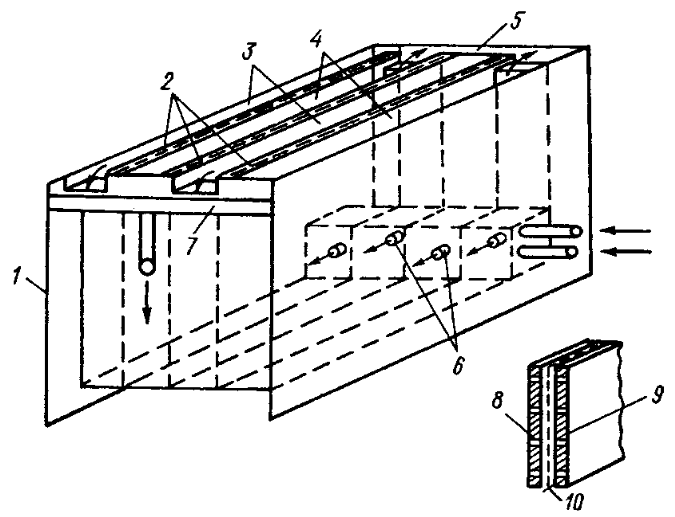
Рис.. Диафрагменный электрокорректор рН безнапорного типа: 1 — боковые стенки; 2 —электродные блоки; 3 — катодные камеры; 4 — анодные камеры; 5 — лоток для сбора анолита; 6 — распределительная система исходной воды; 7 — лоток для сбора католита; 8 — катод; 9 — анод; 10 — диафрагма
Электрохимическое корректирование рН и E имеет существенные преимущества перед
химическим. Кроме исключения ввода дефицитных реагентов, предотвращающих загрязнение воды катионными и анионными остатками кислот и щелочей, преимуществом является также и то, что в результате электролиза изменяются многие физико-химические характеристики воды, обеспечивающие ее ≪активность≫. Такая вода обладает лучшими обезжиривающими и моющими свойствами, биологически активна и может использоваться по самому широкому назначению.
Список использованных источников информации:
