
- •Пинаевская Екатерина, 58 правая группа, п/п
- •Расчет навески – g
- •Расчет навески – g
- •Математическая обработка экспериментальных данных
- •3. Оценка правильности (оценка систематических отклонений)
- •Коэффициенты Стьюдента (tP или tα,k)
- •4. Сравнение выборок
- •Теоретические значения критерия Фишера (fт)
- •5. Расчет абсолютной и относительной погрешностей определения
- •5.1. Абсолютная погрешность (ошибка):
- •5.2. Относительная погрешность (ошибка):
Пинаевская Екатерина, 58 правая группа, п/п
Бригада № 3 – Пинаевская Екатерина, Трофимова Мария
Бригада № 4 – Визжачий Андрей, Белугин Сергей
ЛАБОРАТОРНАЯ РАБОТА 1-2
ХИМИЧЕСКИЕ (ТИТРИМЕТРИЧЕСКИЕ) МЕТОДЫ
АНАЛИЗА ПРИРОДНЫХ ОБЪЕКТОВ
Титриметрическое определение сульфат-ионов в воде (РД 52.24.406-2006). Осадительное титрование. Бариметрия (упрощенная версия)
Сущность метода: Выполнение измерений массовой концентрации сульфатов титриметрическим методом основано на образовании труднорастворимого сульфата бария при прибавлении раствора хлорида бария к анализируемой воде. После практически полного осаждения сульфатов избыток ионов бария реагирует с индикатором с образованием комплексного соединения. При этом окраска раствора изменяется от сине-фиолетовой (фиолетовой) до голубой. Для уменьшения растворимости осадка сульфата бария титрование проводят в водно-спиртовой или водно-ацетоновой среде. Диапазон измерений 30-300 мг SO42-/л.
K2SO4 + BaCl2 = 2KCI + BaSO4↓
Приготовление раствора титранта: Приготовить 250 мл раствора хлорида бария с СN 0,02 моль/дм
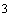 .
Навеску
(0,61±0,01) г BaCl2•2H2O
(проверьте расчетами правильность
навески), взвешенную на ТВ, растворите
в мерной колбе на 250 мл.
Раствор можно хранить в темной плотно
закрытой склянке не более 6 мес.
.
Навеску
(0,61±0,01) г BaCl2•2H2O
(проверьте расчетами правильность
навески), взвешенную на ТВ, растворите
в мерной колбе на 250 мл.
Раствор можно хранить в темной плотно
закрытой склянке не более 6 мес.
Расчет навески – g
g = CN • МЭ • V (л) = 0,02 • 121,5 • 0,25 = 0,6075 г
М = 137 + 35 • 2 + 2 • (1 • 2 + 16) = 207 + 36 = 243 г
МЭ = М • fЭ = 243 • 0,5 = 121,5 г/Моль
Приготовление раствора установочного вещества. Приготовить 250 мл раствора сульфата калия с массовой концентрацией сульфатов 250 мг/дм
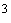 .
Для
приготовления аттестованного раствора
сульфатов взвесьте на АВ навеску
сульфата калия K2SO4
(0,1134±0,0001) г (проверьте
расчетами правильность навески)
предварительно высушенного в сушильном
шкафу при 1050
С в течение 1 ч и охлажденного в эксикаторе
до комнатной температуры. Количественно
перенесите ее в мерную колбу вместимостью
250 см
.
Для
приготовления аттестованного раствора
сульфатов взвесьте на АВ навеску
сульфата калия K2SO4
(0,1134±0,0001) г (проверьте
расчетами правильность навески)
предварительно высушенного в сушильном
шкафу при 1050
С в течение 1 ч и охлажденного в эксикаторе
до комнатной температуры. Количественно
перенесите ее в мерную колбу вместимостью
250 см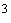 ,
растворите примерно в 200 см
,
растворите примерно в 200 см дистиллированной воды, добавьте 0,5 см
дистиллированной воды, добавьте 0,5 см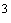 0,1 М раствора соляной кислоты и
перемешайте. По универсальной индикаторной
бумаге рН полученного раствора должен
быть около 4. Доведите объем раствора
в колбе до метки дистиллированной водой
и вновь перемешайте. Перенесите раствор
в склянку с хорошо притертой стеклянной
или пластиковой пробкой. Раствор
сульфатов с массовой концентрацией
250 мг/см
0,1 М раствора соляной кислоты и
перемешайте. По универсальной индикаторной
бумаге рН полученного раствора должен
быть около 4. Доведите объем раствора
в колбе до метки дистиллированной водой
и вновь перемешайте. Перенесите раствор
в склянку с хорошо притертой стеклянной
или пластиковой пробкой. Раствор
сульфатов с массовой концентрацией
250 мг/см хранится в плотно закрытой посуде не
более 6 мес.
хранится в плотно закрытой посуде не
более 6 мес.
Расчет навески – g
g = CN • МЭ • V (л) =
М = 39 • 2 + 32 + 16 • 4= 78 + 32 + 64 = 174
МЭ = М • fЭ =
Приготовление раствора соляной кислоты: Приготовить 100 мл 0,1 М раствора HCl.
Так как кислоты, особенно концентрированные, нельзя взвешивать навеску на объем. Для этого нужно определить её титр. Определяется объем концентрированной кислоты. Возьмите рассчитанное количество концентрированной кислоты в мл мерной пипеткой. В мерную колбу нужного объема налейте на половину дистиллированную воду. Внесите туда мерной пробиркой необходимое количество концентрированной кислоты. Хорошо перемешайте содержимое колбы и доведите объем до метки дистиллированной водой. Закройте колбу пробкой, перемешайте 15-20 раз и перелейте раствор в чистую посуду.
Приготовление растворов индикаторов:
а)
Раствор ортанилового К, 0,05%-ный:
Приготовить 50 мл 0,05%-го раствора
ортанилового К. В 50 см![]() дистиллированной воды растворите 25 мг
ортанилового К. Хранится в темной
склянке в течение 2 месяцев.
дистиллированной воды растворите 25 мг
ортанилового К. Хранится в темной
склянке в течение 2 месяцев.
б)
раствор нитхромазо, 0,025%-ный: Приготовить
100 мл 0,025%-го раствора нитхромазо. В 100
см![]() дистиллированной воды растворите 25 мг
нитхромазо. Хранится в темной склянке
в течение 2 месяцев.
дистиллированной воды растворите 25 мг
нитхромазо. Хранится в темной склянке
в течение 2 месяцев.
Стандартизация титранта (хлорида бария): В коническую колбу вместимостью 100 см
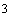 внесите мерной пипеткой 10,0 см
внесите мерной пипеткой 10,0 см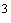 аттестованного раствора сульфатов с
массовой концентрацией 250 мг/дм
аттестованного раствора сульфатов с
массовой концентрацией 250 мг/дм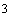 ,
добавьте 10 см
,
добавьте 10 см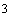 этилового спирта (при отсутствии спирта
- ацетон) и 0,3 см
этилового спирта (при отсутствии спирта
- ацетон) и 0,3 см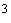 раствора индикатора ортанилового К
или нитрохромазо и титруйте раствором
хлорида бария 0,02 моль/дм
раствора индикатора ортанилового К
или нитрохромазо и титруйте раствором
хлорида бария 0,02 моль/дм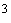 при постоянном перемешивании до перехода
окраски из фиолетовой (или сине-фиолетовой)
в голубую.
при постоянном перемешивании до перехода
окраски из фиолетовой (или сине-фиолетовой)
в голубую.
Титрование
проводите медленно, особенно вблизи
точки эквивалентности, и продолжайте
до тех пор, пока сине-фиолетовая окраска
не будет возвращаться в течение 2-3 мин.
Повторите титрование и, при отсутствии
расхождения в объемах хлорида бария
более 0,05 см![]() ,
за результат титрования примите среднее
арифметическое. В противном случае
повторите титрование до получения
результатов, отличающихся не более чем
на 0,05 см
,
за результат титрования примите среднее
арифметическое. В противном случае
повторите титрование до получения
результатов, отличающихся не более чем
на 0,05 см![]() .
Результаты занесите в таблицу 1.
.
Результаты занесите в таблицу 1.
Таблица 1
|
№ п/п |
V установочного вещества (K2SO4) с СN = 250 мг/дм3 |
V титранта (BaCl2) |
Условия титрования
|
|
1. 2. 3.
|
10 мл 10 мл 10 мл
V (средн.) = 10 мл |
V1 = 1,7 V2 = 1,6 V3 = 1,7
V (средн.) = 1,7 |
|
Точную нормальную концентрацию раствора хлорида бария рассчитайте по формуле:
![]() ,
,
М = 250*10 / 48,03*1000*1,7 = 2500 / 81651 = 0,0306181 моль/дм3
где
![]() - нормальная концентрация раствора
хлорида бария, моль/дм
- нормальная концентрация раствора
хлорида бария, моль/дм![]() ;
;
![]() - массовая
концентрация аттестованного раствора
сульфатов, мг/дм
- массовая
концентрация аттестованного раствора
сульфатов, мг/дм![]() ;
;
![]() - объем аттестованного
раствора сульфатов, см
- объем аттестованного
раствора сульфатов, см![]() ;
;
![]() - молярная масса
эквивалента сульфат-иона, г/моль (
- молярная масса
эквивалента сульфат-иона, г/моль (![]() 48,03);
48,03);
![]() - объем раствора
хлорида бария, израсходованного на
титрование раствора сульфатов, см
- объем раствора
хлорида бария, израсходованного на
титрование раствора сульфатов, см![]() .
.
Анализ воды: Возьмите аликвоту задачи № 2. Прилейте объем этилового спирта или ацетона, равный суммарному объему анализируемой воды, добавьте 0,3 см
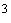 раствора индикатора и титруйте раствором
хлорида бария при постоянном перемешивании
содержимого колбы до перехода окраски
из фиолетовой (сине-фиолетовой) в
голубую.
раствора индикатора и титруйте раствором
хлорида бария при постоянном перемешивании
содержимого колбы до перехода окраски
из фиолетовой (сине-фиолетовой) в
голубую.
В начальной стадии титрования, особенно в пробах с невысоким содержанием сульфатов, окраска изменяется уже после добавления первых капель хлорида бария. Вследствие этого титрование проводите медленно, при энергичном перемешивании. Титрование продолжайте до тех пор, пока сине-фиолетовая окраска не будет возвращаться в течение 2-3 мин.
Таблица 2
|
№ п/п |
V анализируемой воды (V2) |
V титранта (BaCl2) |
Условия титрования
|
|
1. 2. 3. 4. 5. 6. 7. 8. 9.
|
10 мл 10 мл 10 мл 10 мл 10 мл 10 мл 10 мл 10 мл 10 мл
V (средн.) = 10 мл |
V1 = 2,0 V2 = 2,1 V3 = 2,1 V4 = 1,8 V5 = 1,6 V6 = 1,8 V7 = 1,6 V8 = 1,5 V9 = 1,7
V (средн.) = 1,8 |
|
Титрование повторите и, если расхождение между параллельными титрованиями не превышает предела повторяемости, за результат принимайте их среднее значение. В противном случае повторите титрование до получения допустимого расхождения результатов.
Если
массовая концентрация сульфатов в
анализируемой пробе воды превышает 300
мг/дм![]() ,
для титрования берите аликвоту пробы
от 1 см
,
для титрования берите аликвоту пробы
от 1 см![]() до 5 см
до 5 см![]() и разбавляйте ее дистиллированной водой
до 10 см
и разбавляйте ее дистиллированной водой
до 10 см![]() .
Аликвоту следует выбирать таким образом,
чтобы в ней содержалось не менее 1,5 мг
сульфатов.
.
Аликвоту следует выбирать таким образом,
чтобы в ней содержалось не менее 1,5 мг
сульфатов.
Вычисление и оформление результатов измерений: Массовую концентрацию сульфатов в анализируемой пробе воды
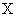 ,
мг/дм
,
мг/дм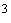 ,
рассчитывают по формуле:
,
рассчитывают по формуле:
![]() ,
,
Х = 48,03*1,8*0,03*1000 / 10 =259,2 мг/дм3
где
![]() - молярная масса эквивалента сульфат-иона,
г/моль (
- молярная масса эквивалента сульфат-иона,
г/моль (![]() 48,03);
48,03);
![]() - объем раствора
хлорида бария, израсходованного на
титрование аликвоты анализируемой
пробы, см
- объем раствора
хлорида бария, израсходованного на
титрование аликвоты анализируемой
пробы, см![]() ;
;
![]() - нормальная
концентрация раствора хлорида бария,
моль/дм
- нормальная
концентрация раствора хлорида бария,
моль/дм![]() ;
;
![]() - объем аликвоты
пробы воды, взятый для титрования, см
- объем аликвоты
пробы воды, взятый для титрования, см![]() .
.
