
- •Молекулярная физика и термодинамика.
- •17. История атомистических учений. Наблюдения и опыты, подтверждающие
- •1. Все тела состоят из частиц – атомов и молекул.
- •2. Эти частицы находятся в непрерывном хаотическом (тепловом) движении
- •Масса и размер молекул. Постоянная Авогадро
- •Масса молекул
- •18. Идеальный газ. Давление газа. Основное уравнение мкт.
- •19. Тепловое движение. Абсолютная температура как мера средней кинетической
- •Абсолютная температурная шкала
- •20. Уравнение Клапейрона-Менделеева. Изопроцессы и их графики.
- •Уравнения изопроцессов
- •21. Объяснение агрегатных состояний вещества на основе атомно-молекулярных
- •Плавление и кристаллизация
- •Парообразование и конденсация
- •22. Насыщенные и ненасыщенные пары. Влажность воздуха. Абсолютная и
- •Насыщенным называется пар, находящийся в равновесии со своей жидкостью.
- •Влажность воздуха
- •23. Внутренняя энергия и работа газа. Первый закон термодинамики
- •Изменение внутренней энергии идеального газа
- •Первый закон термодинамики
- •Первый закон термодинамики
- •24. Адиабатный процесс. Тепловые двигатели и охрана окружающей среды. Кпд тепловых двигателей. Необратимость тепловых процессов.
- •Кпд теплового двигателя
Молекулярная физика и термодинамика.
17. История атомистических учений. Наблюдения и опыты, подтверждающие
атомно- молекулярное строение вещества. Масса и размеры молекул.
Постоянная Авогадро.
1. Все тела состоят из частиц – атомов и молекул.
Современные приборы(электронный микроскоп, ионный проектор) позволяют видеть отдельные атомы и молекулы.
2. Эти частицы находятся в непрерывном хаотическом (тепловом) движении
Опытные доказательства – диффузия и броуновское движение
Диффузия – взаимное проникновение молекул одного вещества в промежутки между молекулами другого вещества. Диффузию можно наблюдать для газообразных, жидких и твердых тел. Примеры:
Б роуновское
движение–тепловое движение
взвешенных в газе или жидкости частиц.
Обнаружил английский ботаник Роберт
Броун в 1827 году. Причина броуновского
движения частицы заключается в том, что
удары молекул жидкости о частицу не
компенсируют друг друга.
роуновское
движение–тепловое движение
взвешенных в газе или жидкости частиц.
Обнаружил английский ботаник Роберт
Броун в 1827 году. Причина броуновского
движения частицы заключается в том, что
удары молекул жидкости о частицу не
компенсируют друг друга.
Экспериментальное исследование броуновского движения – Жан Перрен.
Траектория броуновской частицы.
3. Частицы взаимодействуют друг с другом силами притяжения и отталкивания.
Опытные доказательства – существование твердых, жидких и газообразных тел; существование силы трения; усилие, необходимое для сжатия любого тела; существование объемных тел.
Масса и размер молекул. Постоянная Авогадро
Определения
m–масса всего вещества, кг
p–давление, Па
V-объем всего вещества, м3 . 1л= 10-3 м3
N– число всех молекул в веществе
ρ =m/V– плотность вещества, кг/м3. 1 г/см3 = 106 кг/м3
n=N/V– концентрация молекул, или число молекул в единице объема. 1/м3=м-3
m0–масса одной молекулы
Количество вещества ν(«ню»)пропорционально числу частиц.
Единица измерения количества вещества - моль
Моль равенколичеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода.
Постоянная Авогадро - количество молекул в одном моле вещества
![]()
Если известно количество вещества (число молей ν), то число молекул Nво всем веществе
![]()
Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро:
![]()
Молярной массойназываетсявеличина, равная массе одного моля данного вещества:
![]()
Зная молярную массу, можно посчитать количество вещества:
![]()
Значения молярной массы, выраженные в г/моль, приведены в таблице Менделеева. Например, молярная масса атома водорода (H) равна1 г/моль,
молекулы водорода (H2)2 г/ моль,
молекулы углекислого газа (CO2 )12+32=44 г/моль,
молекулы воды (H2O)2+ 16=18 г/моль.
Масса молекул
Для определения массы одной молекулы m0нужноразделить массу вещества на число молекул в нем
![]()
Посчитаем массу одной молекулы воды:
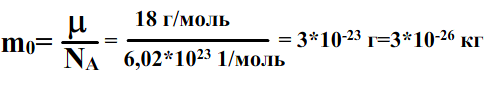
18. Идеальный газ. Давление газа. Основное уравнение мкт.
Д ля
объяснения свойств вещества в газообразном
состоянии вместо реального газа
используетсяего физическая модель -
идеальный газ.
ля
объяснения свойств вещества в газообразном
состоянии вместо реального газа
используетсяего физическая модель -
идеальный газ.
В модели идеального газа предполагается:
молекулы можно считать точечными массами;
между молекулами не действуют силы притяжения;
при соударении молекул друг с другом и со стенками сосуда действуют силы упругого отталкивания
Молекулы идеального газа обладают только кинетической энергией.
Основное уравнение МКТ позволяет вычислить давление газа, если известны масса молекулы, среднее значение квадрата скорости и концентрация молекул.
Давление идеального газа
Причина давления идеального газа на стенки сосуда заключается в том, что молекулы при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела.
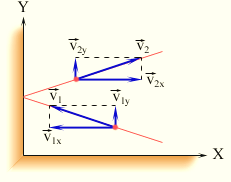 По
закону сохранения импульсав результате
упругого удара каждая молекула передает
стенке импульс, следовательно, на стенку
со стороны молекул действует сила.
По
закону сохранения импульсав результате
упругого удара каждая молекула передает
стенке импульс, следовательно, на стенку
со стороны молекул действует сила.
Если подсчитать импульс, переданный одной молекулой, умножить на число соударений и разделить на время наблюдения, мы получим давление газа на стенку сосуда.
Результат называется основным уравнение МКТ.
![]()
П![]() оскольку
среднее значение кинетической
энергии поступательного движения
молекул идеального газа:
оскольку
среднее значение кинетической
энергии поступательного движения
молекул идеального газа:
справедливо также уравнение
![]()
