
8
.pdf
Билет №8
1. Альфа распад и изомерный переход. Примеры
Альфа-превращение ядер
Альфа-распад - это процесс самопроизвольного испускания возбужденным
ядром альфа-частицы (ядра атома гелия - 4 Не ) с высвобождением энергии в форме 2
кинетической энергии альфа-частицы и дочернего ядра.
Альфа-радиоактивность установлена у природных изотопов элементов,
имеющих Z = 83 и выше, а также у некоторых лантаноидов.
Уравнение и схема альфа-превращения ядра:
|
X |
|
X + |
|
He |
( |
|
X |
|
A |
|
A-4 |
|
4 |
|
|
A |
|
A-4 |
Z |
|
Z-2 |
|
2 |
|
|
Z |
|
Z-2 |
X )
zA X
A 4 X z 2
Уравнение и схема альфа-превращения отражает явление, при котором исходное
(материнское) ядро, находящееся в возбужденном состоянии, испускает альфа-частицу и превращается в дочернее ядро, имеющее заряд на 2 единицы меньший, и массу,
меньшую на 4 единицы, чем у исходного ядра.
Примеры:
238 92
232 90
U |
|
|
|
|
234 |
Th |
90 |
|
|
||
|
|
228 |
|
|
88 |
Th
Ra
226 88
152 62
Ra |
|
|
222 |
Sm |
86 |
|
|
|
148 |
|
60 |
Rn
Nd
Кинетическая энергия альфа-частиц, испускаемых разными радионуклидами,
лежит в пределах от 2 до 9 Мэв. Причем у радионуклидов тяжелых элементов она составляет 4-9 Мэв, а у легких (лантаноидов) - 2-4 Мэв.
Для каждого радионуклида характерна своя максимальная энергия альфа-
частиц, а разброс по энергии небольшой, составляет доли Мэв. В связи с этим
энергетический спектр альфа-частиц был назван "узким".

n
Е, Мэв
Рисунок 1. Энергетический спектр альфа-частиц
Например, излучение 239Pu имеет в своем составе альфа-частицы следующих энергетических групп: E1= 5.099 Мэв (11%), Е2=5.137 Мэв (20%), Е3=5.15 Мэв (69%).
Гамма-превращение ядер (изомерный переход, ИП)
Гамма-превращение - это процесс самопроизвольного перехода ядра из возбужденного состояния в основное (или менее возбужденное) состояние ядра-
изомера путем испускания одного или нескольких гамма - квантов.
Гамма - излучение часто сопутствует альфаили бета-распаду ядра, когда такой распад происходит не на основной, а лишь на менее возбужденный уровень дочернего ядра. Спектр гамма-излучения дискретный вследствие дискретности энергетических уровней ядра.
2760 С о
Примеры альфа- и бетараспадов ядер
с последующим испусканием гамма-излучения
|
|
|
|
|
|
|
|
|
|
226 |
Ra |
|
|
|
|
|
|
|
|
|
|
|
|
88 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Cs |
|
|
|
|
|
|
|
||||
- |
137 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
55 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
- |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
137m |
Ba |
|
|
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
56 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
137 |
|
|
|
222 |
Rn |
|
|
|
|
|
|
|
|
|
|
|
||||
|
28 Ni |
|
|
|
|
56 |
Ba |
|
86 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|

n
Е, Мэв
Рисунок 2. Энергетический спектр гамма-квантов
С гамма-излучением конкурирует процесс внутренней конверсии::
возбужденное ядро может перейти в основное состояние (или менее возбужденное)
путем передачи через виртуальный квант своей энергии одному из электронов атомной оболочки, который и излучается с энергией Е0 = Евозб - Есвязи, при этом высвобождающиеся электроны моноэнергетичны. С наибольшей вероятностью отрываются и излучаются атомом электроны К-оболочки. Это сопровождается испусканием характеристического рентгеновского излучения, а также электронов Оже
(электроны Оже испускаются в процессе непосредственной передачи энергии возбуждения атома одному из его внешних электронов без предварительного испускания фотона).
В настоящее время получены и нашли широкое применение в медицине
(радиодиагностике) так называемые метастабильные радионуклиды, испытывающие изомерный переход и имеющие короткий период полураспада. К их числу относятся 99mTc (Т1/2 = 6 час), 113mIn (Т1/2=100 мин). В составе излучения указанных нуклидов кроме электромагнитных квантов имеется небольшой процент низкоэнергетичных конверсионных электронов (еk).
Для практического применения в клинике их получают непосредственно на месте с помощью генераторов короткоживущих изотопов, на которых идет отделение дочернего метастабильного нуклида (элюирование специальными растворами), генерированного в результате радиоактивного распада материнского
нуклида. Так, 99Mo в результате е-- распада превращается в 99mTc, который,
испытывая изомерный переход, превращается в ядро-изомер 99Tc. Свойства 99Tc
отличны от свойств 99mTc. Являясь также нестабильным, 99Tc испытывает е--распад с
T1/2 = 2*105 лет.
|
- |
|
|
Tc |
|
- |
5 |
|
Ru |
99 |
Mo |
99m |
99 |
Tc |
99 |
||||
|
(67 часов) |
(6 часов) |
|
(2*10 лет) |
|
||||
42 |
|
|
43 |
|
43 |
|
|
44 |
|
Радионуклид 113mIn получают на генераторе из 113Sn, который испытывает
е--захват, превращаясь в 113mIn. Последний имеет T1/2=100 минут и путем испускания гамма-квантов переходит в стабильное состояние:
113 |
3 115дней |
113m |
107мин |
113 |
In |
50 |
Sn |
49 |
In |
49 |
|
|
|
|
2. Пострадиационное восстановление.
Прямая репарация генетических повреждений.
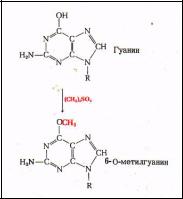
Репарация О-6 – алкилированного гуанина.
Имеется 14 позиций, по которым ДНК метилируется. Гуанин может быть метилирован (по кислороду в 6-ом положении), и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Полученный продукт был назван О6-метил-гуанином или сокращенно О6-меГ .В 1978-1979 годах генетики и биохимики обнаружили, что метильная группа может отщепляться от гуанина и тогда происходит прямое восстановление структуры ДНК в этой точке. В 1982-1988 годах было установлено, что такой же механизм функционирует при репарации О4-алкилтимина. Последующие исследования показали, что в клетках есть белки метилтрансферазы, которые могут захватывать
метильные группы от модифицированного гуанина и благодаря этому восстанавливать исходную структуру ДНК .Интересно отметить, что метилтрансфераза, захватив метильную группу, не может от нее освободиться и гибнет («фермент-самоубийца»). Тем самым в прямом смысле эти белки не ферменты, так как последние не изменяются в ходе реакций.
Если для каждого акта прямой репарации О6-меГ или О4-алТ нужна новая молекула белка, клетка вынуждена запустить синтез новых его порций. Как правило, внутри клетки их накапливается несколько тысяч, чтобы обеспечить нужды репарации: по одной молекуле уходит на одно повреждение. Если процесс возникновения новых повреждений в ДНК идет медленнее, чем синтез новых порций белков, то последних хватает на захват всех метильных групп в гуанинах и мутации не возникают. Если же скорость внесения новых повреждений превышает скорость синтеза белков, последние перестают справляться со всеми повреждениями и в клетках накапливаются мутации. В минуту в клетке E. coli может синтезироваться порядка 100 молекул метилтрансфераз. Следовательно, мутации не возникнут, если скорость возникновения О6-меГ повреждений будет меньше 100 в минуту. Для справки: кишечные палочки делятся каждые 30 минут и,
таким образом, клетка за один клеточный цикл может накопить не более 3000 метилтрансфераз.
Репарация АП-сайтов за счет прямой вставки пуринов
При некоторых типах повреждений пуриновых оснований ковалентная связь между основанием и сахаром (гликозидная связь) может рваться. Тогда в молекуле ДНК на месте этих оснований образуется брешь, названная АП-сайтом. Термин приложим также к случаям, когда из ДНК выпадают пиримидиновые основания (термин АП-сайт, таким образом, объединяет все случаи выщепления оснований с образованием и апуриновых и апиримидиновых сайтов). Описаны ферменты, названные инсертазами (от англ. insert - вставлять), которые могут вставлять в брешь такое же основание, какое было до поражения, и соединять его с сахаром. Структура ДНК приобретает исходный неповрежденный вид.
Репарация однонитевых разрывов ДНК.
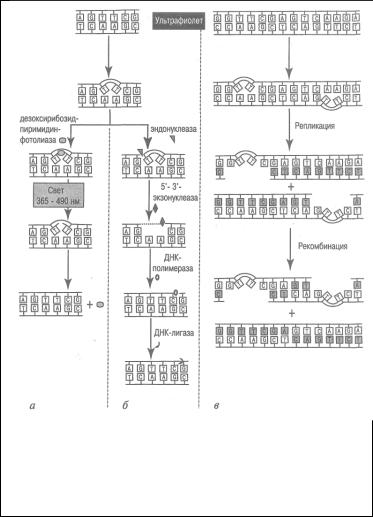
Еще один тип реакций прямой репарации был обнаружен для однонитевых разрывов ДНК, индуцируемых, ионизирующим излучением. При этом с помощью фермента ДНК полинуклеотидлигазы (от англ. ligase - соединять, связывать) происходит прямое воссоединение разорванных концов в молекуле ДНК. Восстановление однонитевого разрыва ДНК происходит с использованием в качестве матрицы комплиментарной цепочки ДНК.
Фотореактивация см рис.1
Эксцизионная репарация
Представляет собой более сложные реакции восстановления ДНК, когда поврежденные участки вырезаются из цепи ДНК (отсюда происходит и термин "эксцизионная репарация", от англ.
excision - вырезание), а затем образовавшиеся бреши заполняются неповрежденным материалом.
Эксцизионная репарация оснований необходима для коррекции модифицированных оснований, которые образуются при действии на ДНК свободных радикалов. Именно этот тип нарушений образуется при косвенном повреждении ДНК ионизирующей радиацией. Эксцизионная репарация осуществляется в несколько этапов. На первом этапе поврежденное основание удаляется ДНК гликозилазами, далее сахар без основания (АПсайт) вырезается АП-эндонуклеазами. На втором этапе образовавшаяся брешь размером в
одно основание восстанавливается до исходной последовательности с помощью совместного действия экзонуклеаз, полимеразы и ДНК лигазы.
Различают два типа эксцизионной репарации:
1). Вырезание поврежденных азотистых оснований гликозилазами и застройка АП-сайта или эксцизионная репарация удалением поврежденных оснований (BER – base excision repair).
2). Вырезание поврежденных нуклеотидов или эксцизионная репарация нуклеотидов в ДНК (NER – nucleotid excision repair).
Эксцизионная репарация удалением поврежденных оснований.
К настоящему времени описано много типов ферментов-гликозилаз, каждый из которых узнает разнообразные поврежденные основания (такие, как метилированные, окисленные, восстановленные, дезаминированные основания, основания, связанные с формамидными группировками, и т.п.). Гликозилазы присоединяются к ним, рвут гликозидные связи между модифицированным основанием и сахаром дезоксирибозой, за счет чего образуются АП-сайты. АП-сайт распознается теперь другим ферментом, АП-эндонуклеазой. Последние найдены у бактерий, растений, животных, включая человека. Как только в нити ДНК возникает разрыв, в работу вступает еще один фермент - фосфодиэстераза: он отщепляет от ДНК
ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной нити ДНК расположен неповрежденный нуклеотид, и следующий фермент - ДНК полимераза I вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному 3'ОН-концу. Чтобы соединить два свободных конца (3'ОНконец вставленного нуклеотида и 5'-конец, ранее образовавшийся при разрыве нити ДНК АП-эндонуклеазой), вступает в действие еще один фермент - полинуклеотидлигаза. Теперь вся структура ДНК полностью восстановлена: неправильное основание удалено, сахарофосфат, к которому это основание было прикреплено, вырезан из нити ДНК, брешь заполнена правильным нуклеотидом, и все однонитевые разрывы залечены. Поскольку последовательность реакций запущена в действие путем расщепления гликозидной связи, этот вид репарации получил название "вырезание оснований с помощью гликозилаз".
Проводятся исследования механизмов сопряжения BER с другими генетическими процессами: транскрипцией, репликацией ДНК и регуляцией клеточного цикла. Повреждения ДНК, связанные с появлением некодирующих (AP-) участков менее опасны для клеток, так как они допускают осуществление полноценной пострепликативной репарации повреждений, чем появление ошибочно кодирующих оснований, приводящих к мутациям. ДНК-гликозилазы, участвующие в BER, способны переводить сайты, содержащие модифицированные основания (например, урацил), в некодирующие сегменты одной из цепей ДНК. Урацилгликозилазы, ассоциированные с белковыми комплексами репликативных вилок, эффективно действуют на одноцепочечные ДНК, и их активность регулируется во время клеточного цикла.
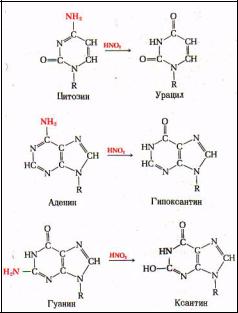
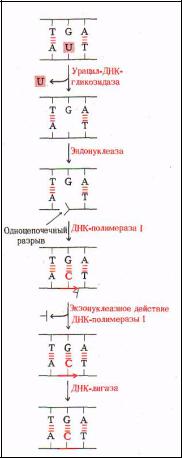
Удаление урацила из ДНК Характерным отличительным признаком молекулы ДНК от РНК является присутствие в последней урацила вместо тимина. Но иногда урацил может встраиваться в цепь ДНК, что в дальнейшем приводит к неверному спариванию оснований и возникновению мутаций. Это может происходить под действием ионизирующей радиации и других факторов мутагенеза.
Соответственно, существует система репликации, которая исправляет это повреждение.
1.Урацил удаляется ферментом урацил-ДНК-N-гликозилазой, который вырезает урацил путем разрушения связи между основанием и остатком сахара.
2. Удаленный урацил покидает АП-сайт (апиримидиновый), который распознает фермент апиримидиновая (АП) эндонуклеаза, последний разрезает цепь ДНК, оставляя
одноцепочечный разрез.
3.ДНК полимераза I (DNA pol I) связывается с местом разреза и реализуя 5`-3`экзонуклеазную активность и 5`-3` полимеразную активность заделывает АП сайт, встраивая туда тимин. В результате поврежденное место в цепи ДНК репарируется.
4.ДНК лигаза зашивает одноцепочечный разрез и ДНК восстанавливает свой прежней нуклеотидный состав.
Надо заметить, что по аналогичному механизму удаляются все дезаминированные основания в ДНК, которые в дальнейшем могут быть причинами мутаций.
Дезаминирование оснований: Аденин превращается в гипоксантин, который образует две водородные связи с цитозином. Гуанин превращается в ксантин, который образует водородные связи с тимином.При дезаминировании цитозина образуется урацил. Тимин не может быть дезаминирован (единственный в ДНК).
Эксцизионня репарация нуклеотидов в ДНК (ЭРН, NER).
Другим типом эксцизионной репарации является более сложная и энергетически более дорогая реакция вырезания не просто поврежденного основания, а значительного участка цепи ДНК перед и позади повреждения. Эту реакцию в клетках E. coli выполняет мультиферментный комплекс, содержащий эндонуклеазы, кодируемые тремя генами: uvrA, uvrB и uvrC (названия генов даны по первым буквам слов ultra violet repair). Комплекс получил название "эксинуклеаза". Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНКполимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.
Большому прогрессу в раскрытии механизма ЭРН у эукариот мы обязаны наследственному заболеванию человека – пигментной ксеродерме. Изучение молекулярных основ этого заболевания выявили их сопряженность с дефектами системы ЭРН, результатом чего и явилось раскрытие генетического контроля ЭРН.
Репарация неспаренных оснований (мисмэтч – репарация).
Довольно часто (у E. coli один раз на 10 тыс. пар нуклеотидов, у эукариотов еще чаще) во время репликации ДНК происходят ошибки спаривания (спонтанно или под действием повреждаюших факторов), в результате которых вместо комплементарной пары нуклеотидов А + Т или Г + Ц в дочернюю цепь ДНК оказываются включенными нуклеотиды, некомплементарные нуклеотидам в материнской нити (их называют мисмэтчами - от англ. mismatch).
Однако ДНК полимеразы обладают следующим свойством: после подстановки очередного нуклеотида в растущую нить ДНК (полимеразный комплекс движется в направлении от 5'-конца синтезируемой нити к 3'-OH-концу) делать шаг назад (в направлении от 3' к 5') и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной нити ДНК. Этот процесс исправления ошибок спаривания, или коррекции, иногда не срабатывает, и тогда в ДНК по окончании репликации остаются невырезанными некоторые неправильные пары, остаются мисмэтчи. Для их устранения клетки живых организмов обладают специально созданной Природой системой репарации.
При неправильном спаривании, в отличие от всех описанных выше случаев репарации модифицированных или поврежденных оснований и нуклеотидов, в структуре ДНК не появляется необычных оснований, неправилен лишь характер спаривания. Как же клетка в таком случае ухитряется распознать неправильность и начать репарацию? Ясно, что неправильное спаривание (ошибка репликации) может затронуть только дочернюю нить ДНК; матричная нить в процессе репликации остается неизменной (если в матричной нити появилось повреждение и не было исправлено с помощью репарации, то это и есть мутация, и она будет воспроизводиться при репликации во всех последующих поколениях). Следовательно, система репарации мисмэтчей должна оперировать на дочерней нити и производить замену некомплементарных оснований только в ней. Клетки при этом используют важное различие в структуре матричной и дочерней нитей. Оказалось, что вскоре после окончания репликации специальные ферменты - метилазы присоединяют метильные группы к аденинам в последовательностях ГАТЦ. Поэтому во время следующего раунда репликации нити ДНК оказываются различимыми: материнская нить ДНК несет метилированные аденины, а в дочерней нити до окончания репликации аденины еще неметилированы. Их метилирование начнется только по окончании репликации. Пока они остаются неметилированными, клетки должны успеть отрепарировать мисмэтчи. Репарация мисмэтчей в кишечной палочке идет под контролем продуктов четырех генов MutH, MutL, MutS и MutU (MutU, как было выяснено позже, есть не что иное, как ген UvrD, или хеликаза II). Такой процесс обнаружен в клетках человека, дрожжей и некоторых других организмов.
Пострепликативная репарация
Двунитевые разрывы ДНК (DSB) представляют угрозу для стабильности генома и их репарация ( DSBR ) является существенной для выживания клетки и предотвращения рака. SB индуцируются внеклеточными агентами, такими, как ионизирующая радиация и генотоксичные химические продукты, спонтанно возникают в процессе репликации ДНК и образуются на непродолжительное время в процессе мейоза или рекомбинации V(D)J в иммунной системе.
DSB репарируются с помощью гомологичной рекомбинации (HR) и соединением негомологичных концов (NHEJ). HR воссоединяет концы ДНК без потери информации с помощью матрицы сестринской хроматиды. В противоположность этому, при NHEJ концы ДНК часто укорачиваются, и этот вариант является потенциально мутагенным. В
обоих вариантов репарации DSB (DSBR) необходим комплекс Rad50/Mre11/Nbs1 , функционирующий также при формировании теломеры и проверке повреждений ДНК.
Роль Rad50/Mre11/Nbs1 во всех указанных явлениях выяснена плохо, для ее понимания недостает общего механизма.
Гомологичная рекомбинация (ГР)
Молекулярный механизм и генетические возможности гомологичной рекомбинации вначале были изучены у бактерий и дрожжей, но теперь стало ясно, что эти же пути используются и у высших организмов. В частности у S.cerevisiare найдены гены RAD50, RAD52, RAD54,55, 57,59, MRE11 и XRS2, которые играют важную роль в ГР и дефекты в которых приводят к повышению чувствительности к действию ионизирующей радиации. У млекопитающих существует значительная гомология с генами группы RAD50.
Здесь принимает участие большое количество белков, которые распознают двухцепочечный разрыв, связываются с 5`- и 3` - концами в месте разрыва. Важную роль играет Rad51, который связывается с неповрежденной молекулой ДНК. После обнаружение региона, гомологичного поврежденному участку, Rad51 катализирует обмен цепей и после прохождения ряда конформационных изменений происходит восстановление поврежденного участка.
Негомологичная рекомбинация.
Негомологичное воссоединение происходит между концами ДНК, которые имеют негомологичные последовательности или очень короткие гомологичные районы. Этот тип репарации не безошибочен и часто является источником генетических перестроек. Восстановление исходной структуры ДНК возможно только в том случае, если воссоединение происходит между концами одной и той же нити ДНК. Если процесс происходит между разными молекулами, он вызывает хромосомные аберрации, такие, как делеции, инсерции, транслокации и инверсии. У млекопитающих и дрожжей в процесс негомологичного воссоединения вовлечены Rad50 и родственные ему белки, факторы Ku, ДНК-лигаза IV и др.
SOS – репарация.
Что случится, если клетка подошла к моменту, когда нужно реплицировать ДНК, но в ней остались повреждения, которые ни одна из описанных выше систем репарации не смогла устранить? Репликация застопорится на первом же неустраненном поражении, и если их в ДНК много, клетка должна погибнуть. В этих условиях в клетках активируется еще один крайне рискованный механизм репарации, обнаруженный впервые в 1974 году югославским ученым Мирославом Радманом, эмигрировавшим во Францию. Радман установил, что при этом индуцируется синтез белков, которые присоединяются к ДНК полимеразному комплексу, "загрубляют" его работу, и такой "подпорченный" комплекс становится способным строить дочернюю ДНК напротив дефектных звеньев матричной нити, но, разумеется, в дочерней нити теперь появляется довольно много ошибок, мутаций. Радман назвал этот механизм "SOS-репарация" от международно признанного сигнала бедствия SOS (спасите наши души). В результате SOS-репарации клетка спасается от гибели на этом этапе: ее ДНК оказывается удвоенной, хотя и с ошибками, и теперь может произойти клеточное деление, но если жизненно важные функции все-таки безнадежно испорчены, такая клетка все равно погибнет позже из-за неспособности правильно функционировать. Если же возникшие мутации не окажут летального действия, клетка худо-бедно, но проживет и ее потомки будут нести уже теперь всегда наследственную память о пережитых некогда последствиях мутационной катастрофы.
Конечный исход можно дорисовать в своем воображении самим, так же как легко может себе представить, чем обернется устойчивое загрязнение среды обитания для любых организмов, включая человека, если им придется все чаще и чаще прибегать к индуцированному загрязнениями ответу типа SOS-репарации.
Роль оксида азота в формировании сигнала SOS – репарации
Цитотоксическому и мутагенному действию излучений и ДНК-тропных агентов на клетку противостоит включение в репарацию мощной индуцибельной системы пострадиационного восстановления – SOS-репарации ДНК.
Установлено, что УФ-излучение, и три типа ионизирующей радиации – α-частицы, γ- излучение и быстрые нейтроны индуцируют экспрессию генов SOS-регулона. При этом генотоксические эффекты γ-излучения обусловлены главным образом формированием высокореакционноспособных радикалов кислорода.
Оксид азота (NO) прекрасно адаптирован для выполнения сигнальных функций в биологических системах. В биологической среде NO существует и транспортируется в составе стабильных комплексов, таких как динитрозильные комплексы железа с тиолосодержащими лигандами, нитрозоглутатион и др.
Показано, что цитотоксические и цитогенетические эффекты NO обусловлены формированием активного окислителя – пероксинитрата в реакции взаимодействия NO с супероксидным анион – радикалом или протонированной формы пероксинитрита.
Установлено, что пероксинитрит и его протонированная форма, проникая через мембраны с помощью переносчиков анионов, обладают широким спектром химической активности, вызывая разрыв цепей ДНК, окисление ее оснований, нитрование гуанина и различных белков, окисление липидов биологических мембран, разрушение Fe-S центров ряда ключевых ферментов, в том числе аконитазы и компонентов дыхательной цепи. Результатом указанных взаимодействий является цитогенетические и мутагенные эффекты.
Учитывая характер повреждений ДНК, формирующихся при действии оксида азота, было предложено, как их следствие, формирование в клетках E.coli SOS – сигнала и активации SOS – системы репарации ДНК.
Природа повреждений ДНК, приводящих к индукции SOS – системы, пока окончательно не установлена, однако предполагается, что SOS – ответ может быть индуцирован как повреждениями оснований, так и одноили двунитевыми разрывами ДНК. NO, будучи свободным радикалом, может выступать одновременно в роли первичного, вторичного и третичного генотоксиканта и мутагена. В реакциях с молекулярным кислородом NO может формировать соединения с высокой реакционной способностью. Главным кандидатом на роль генотоксикантов являются N2O3 и пероксинитрит.
Имеются доказательства индукции физиологическими донорами оксида азота SOSрепарационной системы в бактериальных клетках. Таким образом, к многочисленным биологическим функциям сигнальной молекулы NO нужно отнести также формирование SOS-сигнала и активацию системы SOS – репарации ДНК.
3.Кишечная, церебральная, токсемическая формы олб. Лечение
костномозговая (1-10 Гр)
кишечная (10-20 Гр)
токсемическая (сосудистая) (20-80 Гр)
