
- •Российский национальный исследовательский медицинский университет имени н.И. Пирогова
- •Содержание
- •Строение атома
- •Заряд атома нейтральный!
- •Заполнение орбиталей
- •Виды атомных орбиталей
- •Главные характеристики атома
- •Периодический закон и периодическая система химических элементов д.И. Менделеева
- •Физический смысл Периодического закона (на примере )
- •Закономерности изменения свойств элементов
- •Семейства химических элементов
- •Характер оксидов и гидроксидов I-VII групп
- •Химическая связь
- •Механизмы образования ковалентной связи
- •Способы перекрывания электронных облаков
- •Свойства ковалентной связи
- •Типы гибридизации
- •Кристаллические решетки
- •Сравнительная характеристика кристаллических решеток
- •Валентность и степень окисления
- •Правила определения степени окисления элемента в соединении
- •Химические реакции и закономерности их протекания Классификация химических реакций
- •Методы расстановки коэффициентов в уравнениях овр
- •Обратимые химические реакции. Химическое равновесие
- •Растворы. Электролитическая диссоциация
- •Способы выражения состава раствора
- •Теория электролитической диссоциации (1887 г., Сванте Аррениус)
- •Реакции ионного обмена
- •Гидролиз
- •Случаи гидролиза солей
- •Важнейшие классы неорганических соединений
Гидролиз
Гидролиз – это реакция обменного (гидролитического) разложения веществ водой.
Гидролизу подвергаются многие вещества:
Карбиды: CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Нитриды: Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑
Фосфиды: Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑
Галогениды: SiCl4 + 3H2O = H2SiO3↓ + 4HCl↑
Углеводы: C12H22O11 + H2O = C6H12O6 + C6H12O6
Сложные эфиры, в т.ч. жиры:
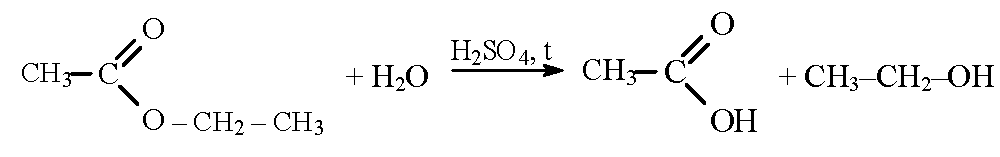
и др.
Гидролиз соли – это процесс обменного взаимодействия ионов соли с молекулами воды.
Факторы, влияющие на степень гидролиза солей: химическая природа соли, температура, концентрация ионов Н+ и ОН- в растворе.
Случаи гидролиза солей
|
Кислота |
Основание | |
|
Сильный электролит (NaOH, KOH, LiOH, Ca(OH)2… |
Слабый электролит (NH4OH, Zn(OH)2, Al(OH)3…) | |
|
Сильная |
KNO3, Na2SO4, KMnO4, NaI… Гидролиз не идет. Среда нейтральная. Цвет индикаторов не изменяется. |
ZnCl2, Al2(SO4)3, Fe(NO3)2, NH4Cl… Гидролиз по катиону. Среда кислая. Красная окраска лакмуса. |
|
Слабая |
Na2CO3, Na2SiO3, K2S, NaF… Гидролиз по аниону. Среда щелочная. Малиновая окраска фенолфталеина. |
CH3COONH4, (NH4)2CO3, (CH3COO)3Al… Гидролиз и по катиону, и по аниону. Среда может быть различной. Окраска индикаторов в соответствии с характером среды. |
Особые случаи гидролиза:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
2CuSO4 + 2Na2CO3 + H2O → (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
2ZnCl2 + 2K2CO3 + H2O → (ZnOH)2CO3↓ + 4KCl + CO2
|
НЕОРГАНИЧЕСКАЯ ХИМИЯ |
Важнейшие классы неорганических соединений
Классификация неорганических соединений
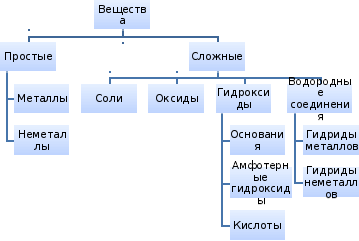
Классификация оксидов
|
Несолеобразующие |
Солеобразующие | ||
|
Основные |
Амфотерные |
Кислотные | |
|
N2O, NO, CO, SiO |
Na2O, CaO… |
ZnO, Al2O3, BeO… |
SO2, SO3, P2O5… |
Классификация оснований
|
1. По числу гидроксогрупп в молекуле: а) Однокислотные (NaOH, NH4OH…) б) Двухкислотные (Ca(OH)2, Fe(OH)2…) в) Трехкислотные (Mn(OH)3, Fe(OH)3…) |
2. По степени диссоциации: а) Сильные основания, или щелочи (NaOH, Ca(OH)2, Ba(OH)2…) б) Слабые основания (Cu(OH)2…) |
Классификация кислот
|
1. По числу атомов водорода в молекуле: а) Одноосновные (HCl, HClO3, HNO3…) б) Двухосновные (H2S, H2SO4, H2SiO3…) в) Трехосновные (H3PO4, H3AsO4…) г) Четырехосновные (H4P2O7…) |
2. Содержание атомов кислорода: а) Бескислородные (HBr, H2S…) б) Кислородсодержащие (H2SO4, HClO4, H3PO4…) |
Классификация солей
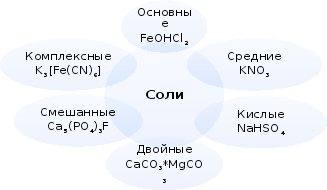
Генетические связи между классами неорганических веществ
Me → MexOy → Mex(OH)y → Соль
Амф. → АмфxOy → HxАмфyOz или Амфx(OH)y → Соль
НеMe → НеMexOy → HxHeMeyOz → Соль
Химические свойства классов неорганических веществ
|
Реагент |
О.О. |
А.О. |
К.О. |
Щелочь |
Амф.Г. |
К-та |
Соль |
H2O |
|
О.О. |
- |
соль |
соль |
- |
соль + Н2О |
соль + Н2О |
- |
щелочь |
|
А.О. |
соль |
- |
соль |
соль + Н2О |
- |
соль + Н2О |
- |
- |
|
К.О. |
соль |
соль |
- |
соль + Н2О |
соль + Н2О |
- |
- |
кислота |
|
Щелочь |
- |
соль + Н2О |
соль + Н2О |
- |
соль + Н2О |
соль + Н2О |
соль + основание |
диссоц. |
|
Амф.Г. |
соль + Н2О |
- |
соль + Н2О |
соль + Н2О |
- |
соль + Н2О |
- |
- |
|
К-та |
соль + Н2О |
соль + Н2О |
- |
соль + Н2О |
соль + Н2О |
- |
соль + кислота |
диссоц. |
|
Соль |
- |
- |
- |
соль + основание |
- |
соль + кислота |
соль + соль |
гидролиз |
