
- •Российский национальный исследовательский медицинский университет имени н.И. Пирогова
- •Содержание
- •Строение атома
- •Заряд атома нейтральный!
- •Заполнение орбиталей
- •Виды атомных орбиталей
- •Главные характеристики атома
- •Периодический закон и периодическая система химических элементов д.И. Менделеева
- •Физический смысл Периодического закона (на примере )
- •Закономерности изменения свойств элементов
- •Семейства химических элементов
- •Характер оксидов и гидроксидов I-VII групп
- •Химическая связь
- •Механизмы образования ковалентной связи
- •Способы перекрывания электронных облаков
- •Свойства ковалентной связи
- •Типы гибридизации
- •Кристаллические решетки
- •Сравнительная характеристика кристаллических решеток
- •Валентность и степень окисления
- •Правила определения степени окисления элемента в соединении
- •Химические реакции и закономерности их протекания Классификация химических реакций
- •Методы расстановки коэффициентов в уравнениях овр
- •Обратимые химические реакции. Химическое равновесие
- •Растворы. Электролитическая диссоциация
- •Способы выражения состава раствора
- •Теория электролитической диссоциации (1887 г., Сванте Аррениус)
- •Реакции ионного обмена
- •Гидролиз
- •Случаи гидролиза солей
- •Важнейшие классы неорганических соединений
Характер оксидов и гидроксидов I-VII групп
|
Номер группы |
I |
II |
III |
IV |
V |
VI |
VII |
|
Оксиды, их характер |
R2O Осн. |
RO Осн., амф. |
R2O3 Осн., амф., кисл. |
RO2 Кисл. |
R2O5 Кисл. |
RO3 Кисл. |
R2O7 Кисл. |
|
Гидроксиды, их характер |
ROH
Осн. |
R(OH)2
Осн., амф.гидр. |
R(OH)3 H3RO3 Осн., амф.гидр., кислота |
H2RO3
Кислота |
HRO3 H3RO4 Кислота |
H2RO4
Кислота |
HRO4
Кислота |
Химическая связь
Вид химической связи зависит от электроотрицательности образующих её элементов.
Ионная связь
Образуется при взаимодействии атомов элементов, резко отличающихся друг от друга значениями электроотрицательности (Ме + НеМе).
![]()
Свойства: ненаправленность, ненасыщаемость.
Соединения: твердые, малолетучие, тугоплавкие вещества (галогениды типичных металлов, щелочи, гидриды металлов).
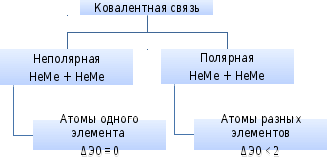
Ковалентная связь
Возникает в результате образования общих электронных пар (НеМе + НеМе).
A· + ·В → А : В
Соединения (неполярная ковалентная связь): газообразные, твердые, реже – жидкие вещества (O2, Cl2, Br2, I2, алмаз, графит, сера).
Соединения (полярная ковалентная связь): жидкие и газообразные вещества (HCl, H2O, NH3, кислотные оксиды, кислоты).
Металлическая связь
Образуется в результате взаимодействия относительно свободных электронов с ионами металлов.
Свойства: ненаправленность.
Соединения: твердые вещества (все Ме, кроме ртути).
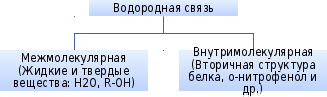
Водородная связь
Образуется между атомом водорода, связанным с атомом электроотрицательного элемента одной молекулы и атомом сильно электроотрицательного элемента другой молекулы.
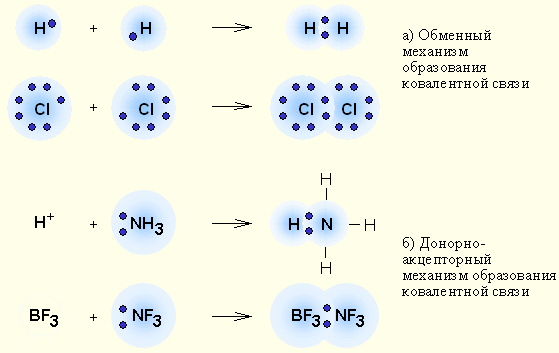
Механизмы образования ковалентной связи
Обменный
Донорно-акцепторный
Способы перекрывания электронных облаков
(«а,б,в» - σ-тип, «г» - π-тип)
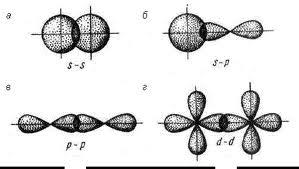
σ-связь – это ковалентная связь, образованная при перекрывании атомных орбиталей по линии, соединяющей центры атомов (прочная связь).
π-связь – это ковалентная связь, образованная при перекрывании атомных орбиталей вне линии, соединяющей ядра атомов (непрочная связь).
Свойства ковалентной связи
Длина связи (l) – это расстояние между ядрами атомов, образующих связь.
Энергия связи (Есв) – это энергия, необходимая для разрыва связи, измеряется в кДж/моль.
Чем больше перекрывание атомных орбиталей, тем больше энергия связи, тем прочнее химическая связь.
Порядок (кратность) связи – это число электронных пар, участвующих в образовании связи.
|
N=N Тройная связь (σ+π+π) |
О=С=О Двойная связь (σ+π) |
Cl-Cl Одинарная связь (σ) |
Чем больше кратность связи, тем больше прочность (энергия) связи, тем меньше ее длина.
Насыщаемость – это способность атомов образовывать определенное число ковалентных связей.
Направленность связи обуславливает пространственную структуру молекул, т.е. их геометрию.
Полярность связи характеризует степень смещения общей электронной пары к более электроотрицательному атому.
Поляризуемость ковалентной связи – это способность молекул изменять свою полярность под действием внешнего электрического поля.
Гибридизация электронных орбиталей – это процесс взаимодействия атомных орбиталей разной формы, обладающих различной энергией, приводящий к образованию гибридных орбиталей, одинаковых по форме и энергии.
Число гибридных орбиталей равно числу исходных орбиталей!
Тип гибридизации электронных орбиталей определяет пространственную конфигурацию молекулы.
