
- •Неорганическая химия способы выражения состава растворов
- •Практическое занятие.
- •Задачи для самостоятельного решения
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Коэффициенты активности ионов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Буферное действие
- •Границы буферного действия
- •Буферная емкость
- •Кривые титрования
- •Произведение растворимости
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Невозможность образования химической связи между атомами He
- •Ионная связь Ионные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов.
- •Потенциальная энергия для однозарядных ионов:
- •Поляризующее действие ионов тем больше, чем меньше радиус и чем устойчивее электронная оболочка иона. Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
- •Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
- •Энергия связи
- •1649 КДж/моль. В молекуле метана имеются четыре равноценные связи с-н поэтому средняя энергия такой связи равна
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
- •5. Изобразите геометрическую форму ионов: ClO-, ClO3-, ClO4-.
- •Вопросы для подготовки к экзамену
- •Окислительно_восстановительные реакции
Кривые титрования
1. Построить кривую титрования сильного основания сильной кислотой. Для этого рассчитать рН при добавлении к 50 мл 0,1М NaOH следующих объёмов 0,1М НС1 (в мл): О; 10; 25; 40; 49; 49,9;50; 50,1; 51; 60; 75; 100. (Считать плотности растворов равными 1,00 г/мл)
Выделить на кривой титрования скачок титрования, точку эквивалентности, выбрать индикатор.
Возможно ли титрование с метилоранжем (рТ=4,0) и с фенолфталеином (рТ=9)? Каков тип индикаторной ошибки?
2. Вычислить рН в растворе после добавления к 100 мл 0,2М раствора гидроксида натрия 50 мл 0,2М раствора соляной кислоты.
3. Вычислить рН начала скачка при титровании 50 мл 0,1М НС1 раствором гидроксида натрия с с(NaOH)=0,l моль/л.
4. Построить кривую титрования слабого основания сильной кислотой. Для этого рассчитать рН при добавлении к 50 мл водного раствора аммиака с концентрацией аммиака 0,1 мопь/л [Ко(NH3H2O)=1,75•10-5] следующих объёмов 0,1м НС1 (в мл): О; 10; 25; 40; 49; 49,9; 50; 50,1; 51;60; 75; 100 (считать плотности растворов равными 1,00 г/мл). Сравнить полученную кривую титрования с кривой титрования сильного основания сильной кислотой (см.пункт 1). Выделить на кривой титрования скачок титрования, точку эквивалентности, выбрать индикатор.
Возможно ли титрование с метилоранжем (рТ=4,0), метиловым красным (рТ=5,0), фенолфталеином (рТ=9). Каков тип индикаторной ошибки?
5. Вычислить рН в растворе после добавления к 50 мл 0,1М раствора уксусной кислоты 25 мл 0,1М раствора гидроксида натрия, если Ко(СН3СООН)=1,7910-5. Плотности растворов равны 1,00 г/мл.
6. Вычислить рН в растворе после добавления к 100 мл 0,1М раствора карбоната натрия 50 мл 0,1М раствора соляной кислоты. Плотности растворов равны 1,00 г/мл. Для угольной кислоты: Ко(Н2СО3)=4,510-7 Ко(НСО3-)=4,810-11
7. Вычислить рН в растворе после реакции 10 мл водного раствора аммиака с с(NH3)= 0,1 моль/л и 5 мл раствора соляной кислоты с с(НС1)=0,2 моль/л, если Ко(NH3H2O) =1,7510-5 . Плотности растворов равны 1,00 г/мп.
8. Вычислить рН в растворе после реакции 10 мл 0,1М KCN и 10 мл O.IM НС1, если Кo(HCN) =5,0 •10-10. Плотности растворов равны 1,00г/мл.
Произведение растворимости
Пример1. Рассчитайте растворимость фосфата бария, если ПР(Ba3(PO4)2) = 6,3·10-39.
Решение:
Ba3(PO4)2 = 3Ba2+ + 2PO43-
Если s- растворимость фосфата бария, то: [Ba2+]= 3s , [PO43-] = 2s.
ПР = (3s)3 (2s)2 = 108s5 = 6,3 ·10-39.

Отсюда s = √ 6,3 ·10-39 / 108 = 9 10-9 моль/л.
1. Дайте определение понятиям: «произведение растворимости», «растворимость» .
2. Вычислите произведение растворимости хромата серебра, если в 500 мл воды при 25°С растворяются 0,011 г Аg2 СгО4.
3. Произведение растворимости АgС1 равно 1,810-10 Вычислите растворимость соли (моль/л и г/л) в воде и 0,01М КС1. Коэффициенты активностей ионов принять равными 1.
4. Смешали 10 мл 0,01М раствора СаС12и 40 мл 0.01М раствора оксалата аммония (NH4)2C2O4 . Выпадет ли осадок оксалата кальция, если ПР(CaC2O4) =2 10-9 ?
5. В раствор, содержащий 0,01 моль/л BaCl2, и 0,01 моль/л SrCl2 , медленно добавляют раствор сульфата натрия. Какой осадок выпадет первым,
если ПР(BaSO4) =1,1 10-10; ПР(SrSO4)=3,2 • 10-7?
Строение атома
Для описания химических свойств элементов и соединений необходимо знать электронное строение электронных оболочек атомов. Электрон - особая структура, имеющая отрицательный заряд, и обладающая свойствами как частицы, так и волны. Описание движения электрона в поле притяжении ядра атома с помощью классической механики невозможно. Для этого используются методы теории вероятности, общей теории электромагнетизма и квантовой механики.
Существует так называемая волновая функция ψ, связывающая вероятность положения электрона в пространстве с его полной энергией. Соответствующее волновое уравнение – уравнение Шредингера - представляет собой сложное тригонометрическое дифференциальное уравнение второго порядка комплексного переменного. Важно, что квадрат волновой функции | ψ|2 пропорционален вероятности нахождения электрона в определенной области пространства вблизи атома. Такая область получила названиеатомная орбиталь (АО). Графический образ – квадрат.


Понятие АО вытекает из решения волнового уравнения и определяется как область пространства вблизи атомного ядра, вероятность нахождения электрона в которой максимальна и составляет 90-95%. Данная область имеет определенную форму, размеры и энергию, которые определяются набором 3-х т.н. квантовых чисел(n,l,ml),вытекающих из решения волнового уравнения.
Главное квантовое число n– определяет размеры и потенциальную энергию АО. это число принимает значения 1, 2, 3… Совокупность АО с постояннымnопределяетэнергетический уровень (ЭУ).
Орбитальное квантовое число l- «ответственно» за форму АО. Значенияlот 0 до максимальногоn-1. Орбитальному числуl= 0 отвечаютs–орбитали, числуl=1- р-орбитали, числуl=2 -d-орбитали. Совокупность АО с постоянным значениемlпри данномnобразуетэнергетический подуровень(ЭПУ).
Магнитное квантовое число ml – определяет ориентацию орбитали в пространстве. Значения: –l от – до +l. Так дляp- энергетического подуровня (l=1) значенияmlследующие: -1, 0, +1. Таким образом, можно определить число АО на данном энергетическом подуровне, которое равно2l + 1. Тогда, наs–ЭПУ - 1 АО, наp–ЭПУ – 3 АО, а наd–ЭПУ -5 АО.
Любая АО описывается набором 3-х квантовых чисел.
Электрон в атоме имеет собственный вращательный момент механического движения, который также квантуется. В зависимости от знака вращения соответствующее квантовое число (ms) –спиновое - имеет два значения +1/2 и -1/2. Следовательно, электрон в атоме описывается набором 4-х квантовых чисел, три из которых относятся к атомной орбитали, которую он занимает и собственное спиновое квантовое число.




ms= +1/2ms= --1/2
Принципы заселения ЭПУ электронами.
Принцип минимума энергии. Наибольшая устойчивость электронной системы атома соответствует минимуму полной энергии для незаселенных состояний.
Принцип Паули. В атоме не может быть 2-х электронов с одинаковым набором всех четырех квантовых чисел. Другими словами, на АО максимально может разместиться не более 2-х электронов с противоположным значением спиновых чисел.
Правило Гунда. При заселении ЭПУ суммарное спиновое число для электронов должно быть максимально положительным.
Правило Клечковского. Заселение ЭПУ происходит от меньших значений суммы (n+l) к большим значениям (n+l). При одинаковых значениях этой суммы первым заполняется ЭПУ с меньшим значением главного квантового числа n.
Тогда последовательность заселения пустых ЭПУ представляется такой
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s и т.д.
Существует два основных вида составления электронных состояний нейтральных атомов или простых ионов.
Электронная формула (электронная конфигурация). Для нейтрального атома число электронов равно заряду ядра этого атома. Эти электроны, в соответствии с принципами заселения, размещаются на вакантных ЭПУ и записываются слева направо в порядке увеличения энергии ЭПУ. Так, для атома кремния порядковый номер 14. Тогда электронная формула нейтрального атома будет иметь вид: Si 1s22s22p63s23p2. Часто используется сокращенная запись, в которой невалентные электроны обозначаются через устойчивую конфигурацию предшествующего благородного газа. Для кремния это неон. В таком случае можно записать: Si [Ne] 3s23p2.















Второй формой записи электронных состояний является энергетическая диаграмма, которая отражает различие в энергии энергетических подуровней и степень их заполнения электронами.











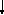






 Е
Е
3p
3s
2s2p
1s
Электронные конфигурации простых катионов и анионов получаются путем удаления или добавления определенного числа электронов на валентные АО. Так, для хлора электронная формула нейтрального атома1s22s22p63s23p5. Для анионаCl-добавляется один электрон 1s22s22p63s23p6. Для степени окисления хлора +5 необходимо удалить 5 электронов ср-подуровня: 1s22s22p63s23p0.
При составлении электронных формул d-элементов нужно учитывать тот факт, что при наличии хотя бы одного электрона на(n-1)d-ЭПУ, энергия этого подуровня становится меньше, чем энергияnsвалентного подуровня. Соответственно, при образовании катионов первыми будут «уходить» электроны именно сns-подуровня. Так, сокращенная электронная формула нейтрального атома титана:Ti[Ar]3d24s2,дляTi(+2) формула иона будет следующей: [Ar]3d24s0.
Для некоторых элементов оказывается энергетически выгодным переход электронов с ns ЭПУ на(n-1)d энергетический подуровень. В частности, такая ситуация реализуется для атомов хрома, молибдена, меди, серебра и т.д. Например, хром имеет следующую конфигурацию валентных ЭПУ: [Ar]3d54s1.
Изоэлектронные состояния реализуются для близко расположенных атомов в Периодической таблице в различных степенях окисления, при которых в них содержится равное число электронов. Так, атом водорода в степени окисления (-1) имеет электронную формулу 1s2. Такую же конфигурацию будут иметь и атом гелия, и катионы лития(+1), бериллия(+2), бора (+3).
Геометрические и энергетические характеристики атомов.
При движении по периоду слева направо возрастает как заряд ядра атомов , так и суммарный заряд электронов. Следовательно, сила притяжения между ядром и электронами, в соответствии с законом Кулона, возрастает, тогда валентные ЭПУ будут «сжиматься» и размеры атомов будут уменьшаться. В таком случае затраты энергии для отрыва валентных электронов будут увеличиваться. Ранее величина, характеризующая энергию отрыва наиболее слабо связанного электрона от нейтрального атома, носила название первый потенциал ионизации (I1)и измерялась в электронвольтах (эВ/атом). В настоящее время используется понятие –энергия ионизации(Ei) - энергия, затрачиваемая для образования 1 моль однозарядных катионов из нейтральных атомов и измеряемая в кДж/моль. Энергия ионизации всегда затрачивается, т.е. является эндотермическим процессом. Естественно, обе этих величины будут увеличиваться по периоду, хотя и не вполне монотонно.
С этих же позиций кажется вполне очевидным, что при движении сверху вниз по группе размеры атомов увеличиваются, а энергия ионизации уменьшается.
С другой стороны, атомы некоторых элементов могут принимать электроны с образованием анионов. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону ( в электронвольтах на атом) или энергией сродства к электрону (в кДж/моль). Этот эффект может быть как эндотермическим, так и экзотермическим.
Величиной, характеризующей способность атома принимать или отдавать электроны, является относительная электроотрицательность(χ χ). Вообще говоря, она является математической функцией от полусуммы энергий ионизации и сродства к электрону. Определяется как мера способности атома смещать к себе электронную плотность от других атомов, выраженная в условных единицах. Минимальные значения (0,7-0,8) соответствуют щелочным металлам, максимальные – активным неметаллам (у фтора 4,1 у кислорода 3,5).Cлева направо по периоду значенияχ увеличиваются, а сверху вниз по группе уменьшаются.
1. Напишите электронные формулы для атомов натрия,железа;для ионов Cr3+,C1- .Какие атомы или ионы изоэлектронны иону Cl- ?
2. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода?
3. Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов фосфора и алюминия.
4. На каком основании Cr и S,C1 и Мп расположены в одной группе
периодической системы Д.И.Менделеева? Почему их помещают в разных подгруппах?
