
- •Неорганическая химия способы выражения состава растворов
- •Практическое занятие.
- •Задачи для самостоятельного решения
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Коэффициенты активности ионов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Буферное действие
- •Границы буферного действия
- •Буферная емкость
- •Кривые титрования
- •Произведение растворимости
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Невозможность образования химической связи между атомами He
- •Ионная связь Ионные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов.
- •Потенциальная энергия для однозарядных ионов:
- •Поляризующее действие ионов тем больше, чем меньше радиус и чем устойчивее электронная оболочка иона. Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
- •Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
- •Энергия связи
- •1649 КДж/моль. В молекуле метана имеются четыре равноценные связи с-н поэтому средняя энергия такой связи равна
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
- •5. Изобразите геометрическую форму ионов: ClO-, ClO3-, ClO4-.
- •Вопросы для подготовки к экзамену
- •Окислительно_восстановительные реакции
Валентность
Валентность- свойство атома данного элемента присоединять или замещать определённое число атомов другого элемента. Мерой валентности является число ковалентных связей, которые образует атом. При этом учитывают связи, образованные как по обменному механизму, так и по донорно-акцепторному.
При образовании химической связи по обменному механизму каждый из взаимодействующих атомов по одному неспаренному электрону для образования связывающей электронной пары. Так образуется, например, молекула водорода: Н∙ + ∙Н = Н׃Н
При определении числа химических связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбуждённое состояние число его неспаренных электронов может увеличится в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбуждённое состояние стабилизируется. Это возможно при переходе электронов на более высокие подуровни внутри одного и того же энергетического уровня. Переходы электронов с подуровней одного энергетического уровня на другой энергетически не выгодны.
Поэтому возбуждённые состояния атомов возникающие в результате таких переходов у элементов первых трёх периодов не могут стабилизироваться химической связью.
Валентности атомов лития (1s22s12p0), азота(1s22s22px12py12pz1),
кислорода(1s22s22px2py1pz1), фтора(1s22s2p5), неона(1s22s22p6) равны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в этих атомах возможно только при переходе электронов на новый, более высокий энергетический уровень.
Таким образом валентность лития равна 1, азота 3, кислорода 2, фтора 1, неона 0.
В атомах бериллия бора углерода может происходить разделение электронных пар за счёт перехода электронов с 2s- подуровня на 2p-подуровень,так как в атомах этих элементов на 2p- подуровне имеются вакантные орбитали. Поэтому валентности 2,3 и 4, присущие атомам Ве,В,С в возбуждённом состоянии, более характерны для них, чем валентности, определяемые числом неспаренных электронов в основном состоянии.
Число химических связей, которые атом образует по донорно-акцепторному механизму, зависит от числа имеющихся на его валентных подуровнях несвязывающих электронных пар или вакантных орбиталей. Например, атом азота может образовывать четыре химические связи: три- за счёт трёх неспаренных электронов и ещё одну – за счёт электронной пары.
Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация.Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
Для объяснения геометрической конфигурации молекулы используется представление о гибридизации АО центрального атома.
Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора - 2s12p2и возбужденный атом углерода - 2s12p3. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. Например, в таких соединениях как BeCl2, BeCl3,CCl4должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны.
Основные положения метода гибридизации:
Гибридные орбитали образуются из различных атомных орбиталей, не сильно отличающиеся по энергиям,
Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
Гибридные орбитали одинаковы по форме электронного облака и по энергии.
По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
sp- гибридизация
sp–гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.

Рис.3sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
sp2-гибридизация
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120одруг к другу. Такова, например, конфигурация молекулыBF3:


Рис.4 sp2-гибридизация
sp3-гибридизация
sp3-гибридизация характерна для соединений углерода. В результате гибридизации одной s-орбитали и трех
р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4и др.
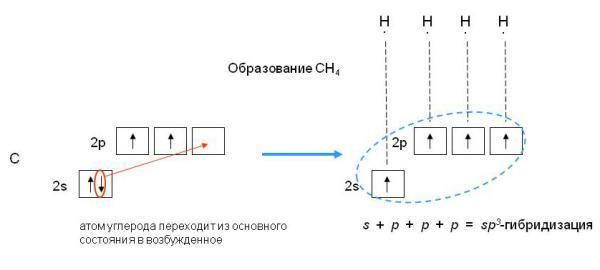

Рис.5sp3-гибридизация
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 2). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105о, что довольно близко к теоретическому значению 109о.

Рис.6sp3-гибридизация атомов кислорода и азота в молекулах а) H2O и б) NCl3.
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому.
Теория гибридизации объясняет геометрию молекулы аммиака. В результате гибридизации 2sи трёх 2pорбиталей азота образуются четыре гибридные орбиталиsp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связямиN-Hне равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.

Рис.7sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Гибридизация объясняет также отличие угла между связями О-Н в угловой молекуле воды. В результате гибридизации 2sи трёх 2pорбиталей кислорода образуются четыре гибридных орбиталиsp3, из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру.
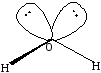
Рис.8sp3-гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как [SiF6]4-, [Fe(CN)6]4-. При этом молекула имеет конфигурацию октаэдра:

Рис. 9 d2sp3-гибридизация в ионе [Fe(CN)6]4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом.
Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
