
- •Неорганическая химия способы выражения состава растворов
- •Практическое занятие.
- •Задачи для самостоятельного решения
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Коэффициенты активности ионов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Буферное действие
- •Границы буферного действия
- •Буферная емкость
- •Кривые титрования
- •Произведение растворимости
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Невозможность образования химической связи между атомами He
- •Ионная связь Ионные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов.
- •Потенциальная энергия для однозарядных ионов:
- •Поляризующее действие ионов тем больше, чем меньше радиус и чем устойчивее электронная оболочка иона. Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
- •Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
- •Энергия связи
- •1649 КДж/моль. В молекуле метана имеются четыре равноценные связи с-н поэтому средняя энергия такой связи равна
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
- •5. Изобразите геометрическую форму ионов: ClO-, ClO3-, ClO4-.
- •Вопросы для подготовки к экзамену
- •Окислительно_восстановительные реакции
Методическое пособие для студентов (черновой вариант)
Неорганическая химия способы выражения состава растворов
Массовая доля ω(в)растворённого вещества «В» – отношение массы растворённого веществаm(в) к сумме масс растворённого вещества и растворителя, чаще всего, воды (т.е. к массе раствора):
(в) =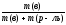
Массовая доля растворённого вещества выражается в долях или в %%( процентное содержание). Например, раствор с массовой долей серной кислоты ω (H2SO4)=0,2(т.е.20%) может быть обозначен как 20% - раствор серной кислоты.
В биологии и медицине также часто используют мг% и мкг%. Число мг% показывает, сколько мг растворённого вещества содержится в 100 г раствора. Число мкг% показывает, сколько мкг растворённого вещества содержится в 100 г раствора. Содержание растворённого вещества в мг% и мкг% применяют для характеристики очень разбавленных растворов. Например, массовая доля раствора глюкозы равна 0,001% или 1мг% или 1000мкг%.
Молярная концентрация с(в)растворённого вещества «В»- отношение количества веществаn(в) к объёму раствора:
c(в)=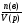 (моль/л).
(моль/л).
Раствор, в котором молярная концентрация растворённого вещества равна с(в) моль/л, характеризуется молярностью, численно равной значению с(в).
Например, раствор с молярной концентрацией серной кислоты с(H2SO4)= 0,1моль/л может быть обозначен как 0,1МH2SO4(децимолярный раствор серной кислоты в воде).
Нормальная концентрация(молярная концентрация химического эквивалента сeq (в)растворённого вещества «В» – это отношение эквивалентного количества веществаneq(в) к объёму раствора:

Раствор, в котором молярная концентрация эквивалента равна ceq(в) моль/л, характеризуется нормальностью, численно равной значениюceq(в).
Например, раствор с молярной концентрацией эквивалента серной кислоты ceq(H2SO4)= 1моль/л может быть обозначен как 1нH2SO4(однонормальный раствор серной кислоты в воде).
Нормальность раствора определяется эквивалентным количеством растворённого вещества и, следовательно, как и последнее, зависят от эквивалентного числа z(в), постоянного только для конкретной реакции, причём величинаceq(в) всегда вz(в) раз больше его молярной концентрацииc(в): сeq(в)=z(в) с(в).
Химическим эквивалентом называется реальная или условная частица вещества «В», которая в данной кислотно-основной реакции эквивалентна одному иону Н+ или в данной окислительно-восстановительной реакции одному электрону. В одной формульной единице вещества «В» может содержаться z(в) химических эквивалентов этого вещества. Эквивалентное числоz(в) показывает, сколько химических эквивалентов содержится в одной формульной единице; всегдаz(в) ≥1.
Например, 0,1н H2SO4– это раствор, содержащий 0,1 моль/л эквивалента серной кислоты, т.е.
(1/2 H2SO4). При указании нормальной концентрации обязательно следует указывать конкретную реакцию, в которой данный раствор применяется.
Молярная доляχ растворённого вещества - отношение количества данного компонента «В» в молях, содержащегося в растворе, к общему количеству всех веществ, включая растворитель:
χ = n(в)/n(в) +n(р-ль)
Молярная доля χ , как и массовая выражается в долях единицы, в процентах.
Например, χ(H2SO4) = 0,01 = 1%.
Моляльность раствора b – отношение количества данного растворённого веществаn(в) моль
к массе растворителя (в кг): b=n(в)/m(р-ль).
Например, b(H2SO4) = 0.1моль/кг.
Пример 1. В 450 г воды растворили 50 гCuSO4·5H2O. Вычислите массовую долю кристаллогидрата, безводной соли и ионов меди в растворе.
Решение:
ω (CuSO4·5H2O)
=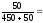 0,1
= 10%
0,1
= 10%
ω (CuSO4) = 6,4%
ω (Cu2+) =
6,4%
ω (Cu2+) =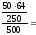 2,56%
2,56%
Пример 2.Какую массу 5%-ного раствораMgSO4 можно приготовить из 300 гMgSO4 ·7H2O?
Решение: ω(MgSO4) =m(MgSO4)/m(р-р) .m(р-р) =m(MgSO4)/0,05
m(MgSO4) =m(MgSO4 ·7H2O)/M(MgSO4 ·7H2O) ·M(MgSO4) = 300/246 · 120 = 146,3(г)
m(р-р) = 146,3/0,05 = 2926,8(г)
Пример3.Сколько воды следует прибавить к 200мл 20% -ного раствора серной кислоты с плотностью 1,14г/мл, чтобы получить 5% -ный раствор?
Решение: m(р-раH2SO4) = 200·1,14 = 228(г).m(H2SO4) = 228 · 0.2 = 45.6(г)
0,05 =45,6/ [228 + m(H2O)]. [228 +m(H2O)] = 45,6/0,05 = 912(г)
m(H2O) = 912 – 228 = 684(г).
Пример 4.Смешали 300г 40% раствора азотной кислоты и 700г 10% раствора той же кислоты. Определите массовую долю полученного раствора.
Решение: m(р-раHNO3) = 300 + 700 = 1000(г).
m(HNO3) = 300 · 0,4 + 700 · 0,1 = 190(г). ω(нового раствора) = 190/1000 = 0,19=19%
Пример 5.Определите массу 30% раствора серной кислоты, которую следует добавить к 600 г 80% раствора той же кислоты для получения 60% раствора.
Решение: Пусть масса 30% раствора X. Тогда масса раствора после смешения:m(р-р) = 600 +X
m(H2SO4) = 600 · 0,8 + X · 0,3. 0,6 = [600 · 0,8 +X· 0,3. 0,6] / (600 +X).X= 400(г).
Пример 6.Как приготовить 500мл 1,5 М раствора серной кислоты из 96%-ного раствора с плотностью 1,84г/мл?
Решение: n(H2SO4) = 1,5 · 0,5 = 0,75(моль).m(H2SO4) = 98 0,75 = 73,5(г).
V(96% р-ра H2SO4) = 73,5/ 1,84 · 0,96 = 42(мл). Далее необходимо долить воды, чтобы довести объём раствора до 500мл.
Пример 7. Вычислите молярную и нормальную концентрацию раствораH3PO4 с массовой долей кислоты 49% и плотностью 1,33г/мл.Фактор эквивалентности кислоты равен 1/3.
Решение: Масса 1л раствора: 1000 ·1,33 = 1330(г). m(H3PO4) = 1330 · 0,49 = 650(г).
n(H3PO4) = 650 / 98 = 6,6(моль).c(H3PO4) = 6,6 моль/л.c(1/3H3PO4) = 6,6 / (1/3) = 19,8(моль экв),т.е.
19,8н H3PO4.
