Фазовая диаграмма фенол-вода.doc (физ.химия) лаб
..docФазовая диаграмма системы, состоящей из 2-х взаимно ограниченно растворимых жидкостей.
ФАЗОВАЯ ДИАГРАММА СИСТЕМЫ,
СОСТОЯЩЕЙ ИЗ ДВУХ ВЗАИМНО
ОГРАНИЧЕННО РАСТВОРИМЫХ ЖИДКОСТЕЙ.
Целью данной работы является построение фазовой диаграммы для системы, содержащей две ограниченно растворимые друг в друге жидкости.
Предположим, что имеется жидкость А, в которой может растворяться другая жидкость В. В свою очередь жидкость В способна растворять жидкость А. В обоих случаях можно получить насыщенные растворы, характеризующиеся максимальной концентрацией одной жидкости в другой. Такие пары жидкостей принято называть взаимно ограниченно растворимыми. В качестве примеров можно привести частично растворимые друг в друге диэтиловый эфир и воду, фенол и воду, никотин и воду и др.
Рассмотрим, какие принципы могут быть положены в основу построения фазовых диаграмм (рис. 1).
Возьмем чистую жидкость А (мольное содержание вещества А в смеси х составляет 100%, а вещество В отсутствует, х = 0%) и при постоянной температуре Т (этому условно соответствует на рис.1 начальная точка 1), начнем добавлять к системе жидкость В. Так как вещество В частично растворимо в жидкости А, то его концентрация х в растворе должна возрастать. Относительное мольное содержание вещества А в этом растворе х уменьшается. В частности, в точке "2" х < 1; х > 0. Дальнейшее введение вещества В в систему в конце концов приведет к насыщению раствора В в А. Этому состоянию отвечает точка 3. После этого, сколько бы не вводилось вещество В, его концентрация в А не может возрасти. После насыщения раствора В в А добавление очередной порции В приводит к появлению новой фазы - насыщенного раствора А в В. Концентрация фазы, выделяющейся после насыщения веществом В жидкости А, т.е. насыщенного раствора А в В, отвечает точке 4.
Следующая порция вещества В приводит к увеличению массы насыщенного раствора А в В (состав отвечает точке 4) и уменьшению относительной массы раствора В в А (состав отвечает точке 3). Наконец, если соотношение чисел молей веществ А и В в системе в целом станет равным концентрации раствора в точке 4, раствор В в А исчезнет. Последующее добавление вещества В к системе приводит к появлению уже ненасыщенного раствора А в В (точка 5). Если с ростом температуры растворимость жидкости повышается, то появление насыщенного раствора В в А наступает при более высокой концентрации В, а насыщенного раствора А в В - при более низкой концентрации А (точки 3' и 4' на линии, отвечающей более высокой температуре Т2).
Из рис. 1 следует, что растворы В в А и А в В с концентрациями, отвечающими составу между точками 3 и 4 (или точками 3' и 4' при температуре Т2 не существует. Если общему составу системы отвечает величина хA (или хB), находящаяся между абсциссами точек 3 и 4, то в таком случае в системе находятся в равновесии две фазы: раствор В в А (состав точки 3) и раствор А в В (состав точки 4).
Рассчитаем относительную массу разновесных фаз для случая, когда общий состав системы находится между концентрациями насыщенных растворов (рис. 2). Обозначим концентрацию насыщенного раствора В в А хα, а A в B - хβ. Промежуточный общий (его еще называют валовым) состав системы равен х0
Если массы этих растворов равны соответственно mα и mβ, то масса вещества А в системе равна
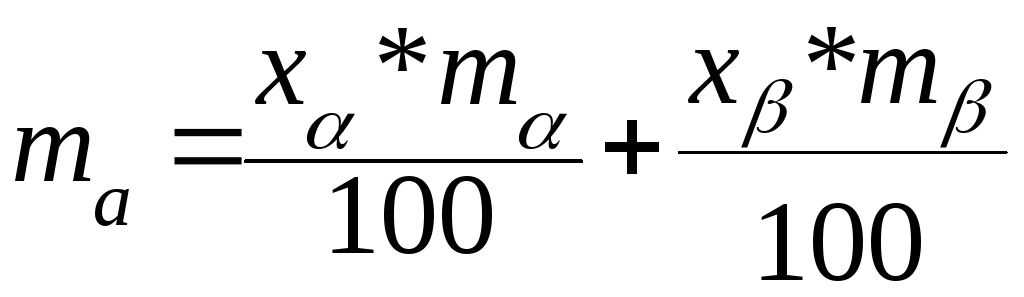
Кроме того, масса вещества А в системе должна быть равна
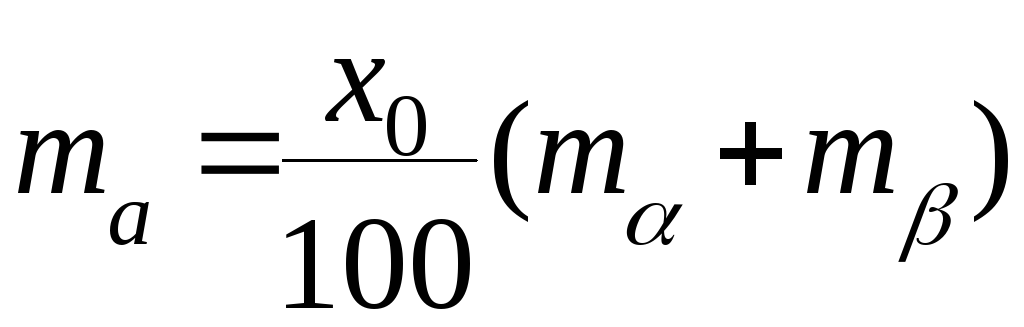
Таким
образом,
![]()
или
![]()
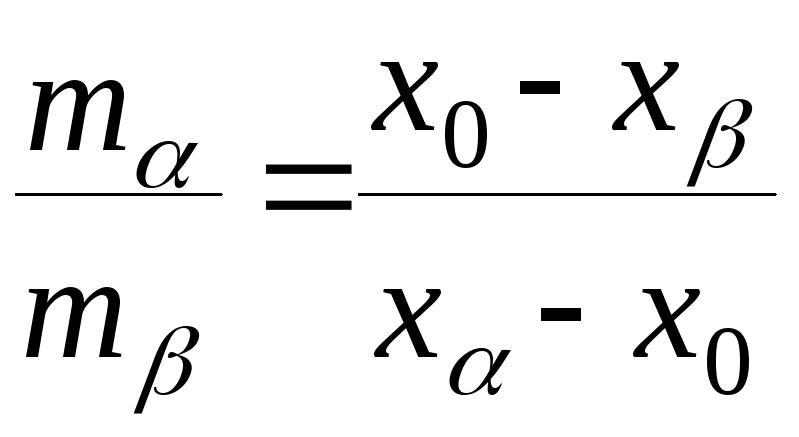 (1)
(1)
Уравнение (1) выражает так называемое "правило рычага" и позволяет рассчитывать относительные массы фаз для данного общего состава системы.
Перейдем теперь к анализу фазовой диаграммы системы (рис.3).
Соединив все точки, характеризующие насыщенные растворы при различных температурах, получим сплошную линию, которая разделяет площадь диаграммы на две части.
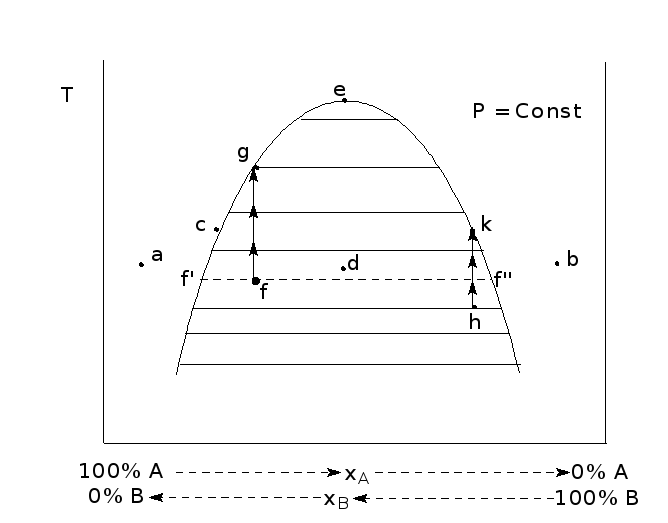
Любая точка на заштрихованной области (рис. 3), например "d" или "f отвечает двухфазной области. В частности, точка "f" отвечает равновесному сосуществованию двух фаз с концентрациями вещества, определяемыми как абсциссы точек f' и f". Любая точка вне заштрихованной плоскости отвечает однофазной области. Точка на линии, например "С", отвечает насыщенному раствору одной фазы, находящемуся в равновесии с мельчайшей капелькой другой фазы.
Так как в данном случае рассматриваются жидкости, взаимная растворимость которых с температурой растет непрерывно, то в итоге левая и правая ветви кривой совпадают в точке максимума "e".
Выше температуры, отвечающей точке "e" двухфазная система не существует. Поэтому такую температуру называют верхней критической.
Можно вообразить, что взаимная растворимость жидкостей увеличивается со снижением температуры (такие системы также реально
существуют). В этом случае имеется нижняя критическая температура, определяющая предел существования двухфазной области.
В каждой точке на диаграмме можно найти число степеней свободы, т.е. число параметров (состав фаз, температура), которые при заданном числе фаз можно изменять независимо.
Число степеней свободы рассчитывают по правилу фаз Гиббса:
![]() (2)
(2)
где: f - число степеней свободы,
К - число компонентов,
Ф - число фаз,
r - число внешних параметров.
Для данной системы К = 2 (компоненты А и В), r = 1 (переменной является только температура).
В приведенном выше анализе диаграммы и способе ее построения использовали изменения состава при постоянной температуре, что и было проиллюстрировано рис. 1 и 2. Теперь же оценим, как влияет температура на состав равновесных фаз и соотношение их масс.
Выбрав любую точку на заштрихованном поле, например точку "f" на рис. 3, и сохраняя постоянным общий состав системы, будем повышать температуру. Росту температуры в этих условиях отвечает направление, показанное стрелками. По мере повышения температуры взаимная растворимость жидкостей возрастает, что приводит к сближению ветвей кривой. Происходит также изменение отношения масс фаз. Если точка "f" находится левее точки, отвечающей верхней критической температуре (точке "е" на рис. 3), то при температуре, отвечающей точке "g", фаза, представляющая собой раствор А в В, исчезает, и при несколько более высокой температуре система становится гомогенной. Если же исходная точка (точка "h") находится правее, то в точке "к" исчезает, наоборот, раствор В в А и система приобретает гомогенность.
Таким образом, точки кривой для построения фазовой диаграммы можно определить по моменту исчезновения неоднородности системы.
Если в системе находятся две фазы, то обычно происходит их расслоение, и фазы можно различать по естественной окраске (если обе фазы бесцветны, то одну из них слегка подкрашивают). Равновесные фазы отличаются друг от друга также показателем преломления. Поэтому при встряхивании гетерогенной системы происходит ее помутнение. В точке на кривой, отвечающей исчезновению одной из двух фаз ( точки "с", "g", "е" и др.), мутность пропадает. Появление или исчезновение мутности используют на практике для построения диаграмм.
Заметим, что при нагревании системы в результате того, что скорость передачи тепла через стенки сосуда относительно невелика, температура внешней среды оказывается выше, чем внутри системы. При охлаждении получаются, наоборот, заниженные результаты.
В связи с этим, подбирая приблизительно равные скорости нагревания и охлаждения, фиксируют точки исчезновения мутности при нагревании и появления мутности при охлаждении. Истинную температуру появления гомогенности определяют как среднюю арифметическую этих величин.
Ход работы.
Установка для изучения растворимости системы фенол-вода состоит из сосуда с водой, штатива для ампул со смесями (табл. 1), нагревателя, холодильника, мешалки, термометра.
Таблица 1.
|
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Состав смеси (% фенола) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
Мотор мешалки включают через регулятор напряжения и, вращая ручку регулятора, устанавливают скорость вращения мешалки. Включают нагреватель на 220 вольт. Используя в случае необходимости водяной холодильник, устанавливают скорость нагрева воды в сосуде 0,7 - 0,8 градусов в минуту.
Содержимое ампул периодически перемешивают, вынимая ампулы из штатива и быстро переворачивая их 1 - 2 раза (перемешивание необходимо производить быстро, учитывая значительную разницу температур воды в термостате и воздуха в помещении).
По исчезновению мути определяют температуру растворения смесей. Результаты записывают в таблицу.
В ходе работы необходимо учитывать, что сначала будут растворяться смеси с малым и большим содержанием фенола. После того, как растворение произойдет во всех ампулах, выключают нагреватель и определяют температуры, при которых смеси становятся гетерогенными (появление мути). Охлаждение необходимо проводить со скоростью 0,7 - 0,8 градусов в минуту, обязательно используя водяной холодильник.
Полученные результаты используют для построения диаграммы растворимости (температура-состав). Точки, полученные при нагреве и охлаждении, обозначают различными знаками ( + , о ).
Вопросы для самоподготовки и контроля.
1. Какую систему называют системой двух ограниченно растворимых жидкостей?
2. Укажите примеры взаимно ограниченно растворимых систем.
3. Какие растворы называют насыщенными?
4. Какие изменения происходят при увеличении количеств второго жидкого компонента, добавляемого к чистому первому веществу?
5. Как влияет повышение или понижение температуры на изменение концентрации насыщенных растворов?
6. Каков состав фаз, находящихся в равновесии при температурах Т1 и Т2?
7 Укажите на диаграмме поле гомогенных растворов фенол в воде и вода в феноле, и поле, отвечающее равновесному сосуществованию двух взаимно насыщенных растворов?
8 Сформулируйте правило фаз Гиббса.
9 Что называют числом степеней свободы?
10 Сформулируйте правило рычага.
11 Укажите состав фаз, находящихся в равновесии в точке "d".
12 Изложите ход выполнения работы.
13 Какие признаки позволяют судить о переходе системы в гомогенное или гетерогенное состояние?
14 Чем обусловлено различие в температурах растворения и расслоения, получаемых при нагреве и охлаждении смесей?
15 Как нужно изменить условия проведения эксперимента, чтобы получить одинаковую температуру при гомогенизации и расслоении смеси системы?
16 Рассчитайте число степеней свободы для точек "а", "е", "d". (рис. 3).
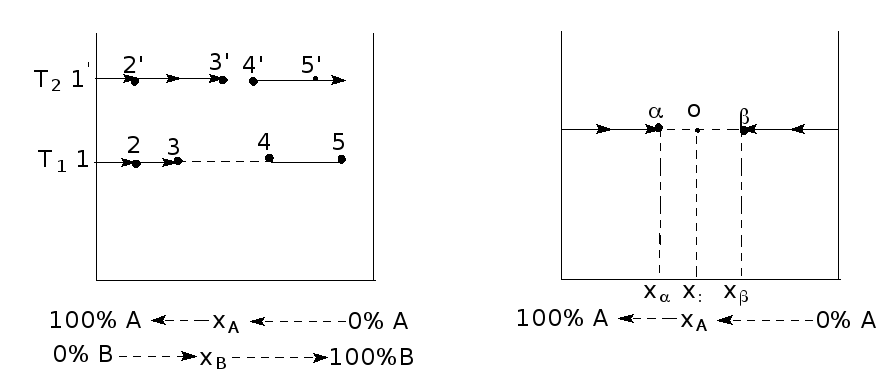
Рис. 1. Один из способов построения фазовой диаграммы в системе жидкость – жидкость.
Рис. 2. Расчёт относительной массы фаз при равновесии в системе жидкость – жидкость.