
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1 Основные понятия и признаки химического равновесия
- •3.2 Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1 Основные понятия
- •7.2 Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Упражнения для самостоятельного решения
- •10. Окислительно_восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Упражнения для самостоятельного решения
- •11. Химическая связь.
- •11.1 Ковалентная связь
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Свойства ковалентной связи
- •11.2. Ионная связь
- •11.3 Водородная связь
- •11.4. Металлическая связь
- •11.5. Химическая связь в твердых телах
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3 Природа химической связи в комплексных соединениях
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
4.2. Способы выражения состава растворов
Массовая доля ω(в) растворённого вещества «В» —отношение массы растворённого вещества m(в) к сумме масс растворённого вещества и растворителя, чаще всего, воды (т.е. к массе раствора):
(в)
=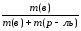
Массовая доля растворённого вещества выражается в долях или в %%( процентное содержание). Например, раствор с массовой долей серной кислоты ω(H2SO4)=0,2(т.е.20%) может быть обозначен как 20% - раствор серной кислоты.
В биологии и медицине также часто используют мг% и мкг%. Число мг% показывает, сколько мг растворённого вещества содержится в 100 г раствора. Число мкг% показывает, сколько мкг растворённого вещества содержится в 100 г раствора. Содержание растворённого вещества в мг% и мкг% применяют для характеристики очень разбавленных растворов. Например, массовая доля раствора глюкозы равна 0,001% или 1мг% или 1000мкг%.
Молярная концентрация с(в) растворённого вещества «В»—отношение количества вещества n(в) к объёму раствора:
c(в)=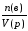 (моль/л).
(моль/л).
Раствор, в котором молярная концентрация растворённого вещества равна с(в) моль/л, характеризуется молярностью, численно равной значению с(в).
Например, раствор с молярной концентрацией серной кислоты с(H2SO4)= 0,1моль/л может быть обозначен как 0,1М H2SO4 (децимолярный раствор серной кислоты в воде).
Нормальная концентрация(молярная концентрация химического эквивалента сeq (в) растворённого вещества «В» —это отношение эквивалентного количества вещества neq(в) к объёму раствора:
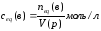
Раствор, в котором молярная концентрация эквивалента равна ceq(в) моль/л, характеризуется нормальностью, численно равной значению ceq(в).
Например, раствор с молярной концентрацией эквивалента серной кислоты
ceq(H2SO4)= 1моль/л может быть обозначен как 1н H2SO4 (однонормальный раствор серной кислоты в воде). Нормальность раствора определяется эквивалентным количеством растворённого вещества и, следовательно, как и последнее, зависят от эквивалентного числа z(в), постоянного только для конкретной реакции, причём величина ceq(в) всегда в z(в) раз больше его молярной концентрации c(в):
сeq(в)=z(в)∙ с(в).
Молярная доля χ растворённого вещества ― отношение количества данного компонента «В» в молях, содержащегося в растворе, к общему количеству всех веществ, включая растворитель: χ = n(в) / [n(в) + n(р-ль)]
Молярная доля χ , как и массовая выражается в долях единицы, в процентах.
Например, χ(H2SO4) = 0,01 = 1%.
Моляльность раствора b – отношение количества данного растворённого вещества n(в) моль к массе растворителя (в кг): b = n(в) / m(р-ль).
Например, b(H2SO4) = 0.1моль/кг.
Пример 1. В 450 г воды растворили 50 г CuSO4·5H2O. Вычислите массовую долю кристаллогидрата, безводной соли и ионов меди в растворе.
Решение:
ω (CuSO4·5H2O)
=
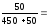 0,1
= 10%
0,1
= 10%
ω (CuSO4)
=
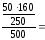 6,4%
ω (Cu2+)
=
6,4%
ω (Cu2+)
=
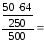 2,56%
2,56%
Пример 2. Какую массу 5%-ного раствора MgSO4 можно приготовить из 300 г
MgSO4 ·7H2O?
Решение: ω(MgSO4) = m(MgSO4) / m (р-р) . m(р-р) = m(MgSO4) / 0,05.
m(MgSO4) = m( MgSO4 ·7H2O) /M (MgSO4 ·7H2O) ·M(MgSO4) =
300 / 246 · 120 = 146,3(г)
m(р-р) = 146,3 / 0,05 = 2926,8(г)
Пример3. Сколько воды следует прибавить к 200мл 20% -ного раствора серной кислоты с плотностью 1,14г/мл, чтобы получить 5% -ный раствор?
Решение: m(р-ра H2SO4) = 200·1,14 = 228(г). m(H2SO4) = 228 · 0.2 = 45.6(г)
Массовая доля серной кислоты в конечном растворе: 0,05 =45,6 / [228 + m(H2O)].
Отсюда: [228 + m(H2O)] = 45,6/0,05 = 912(г)
m(H2O) = 912 – 228 = 684(г).
Пример 4. Смешали 300г 40% раствора азотной кислоты и 700г 10% раствора той же кислоты. Определите массовую долю полученного раствора.
Решение: m(р-ра HNO3) = 300 + 700 = 1000(г).
m(HNO3) = 300 · 0,4 + 700 · 0,1 = 190(г).
ω(нового раствора) = 190/1000 = 0,19=19%
Пример 5. Определите массу 30% раствора серной кислоты, которую следует добавить к 600 г 80% раствора той же кислоты для получения 60% раствора.
Решение: Пусть масса 30% раствора x. Тогда масса раствора после смешения:
m(р-р) = 600 + x
m(H2SO4) = 600 · 0,8 + x · 0,3. 0,6 = [600 · 0,8 + x · 0,3. 0,6] / (600 + x).
x = 400(г).
Пример 6. Как приготовить 500мл 1,5 М раствора серной кислоты из 96%-ного раствора с плотностью 1,84г/мл?
Решение: n(H2SO4) = 1,5 · 0,5 = 0,75(моль). m(H2SO4) = 98 0,75 = 73,5(г).
V(96% р-ра H2SO4) = 73,5/ 1,84 · 0,96 = 42(мл). Далее необходимо долить воды, чтобы довести объём раствора до 500мл.
Пример 7. Вычислите молярную и нормальную концентрацию раствора H3PO4 с массовой долей кислоты 49% и плотностью 1,33г/мл. Фактор эквивалентности кислоты равен 1/3.
Решение: Масса 1л раствора: 1000 ·1,33 = 1330(г). m(H3PO4) = 1330 · 0,49 = 650(г).
n(H3PO4) = 650 / 98 = 6,6(моль).
c(H3PO4) = 6,6 моль/л; c(1/3 H3PO4) = 6,6 / (1/3) = 19,8(моль экв), т.е.19,8н H3PO4.
Пример 8. Рассчитайте нормальную и молярную концентрацию раствора гидроксида натрия, если 20мл этого раствора было нейтрализовано 10мл 0,1н H2SO4.
Решение: В соответствии с законом эквивалентов:
c(NaOH) ∙V(NaOH) = c(1/2H2SO4) ∙ V(H2SO4).
Отсюда c(NaOH) = c(1/2H2SO4) ∙ V(H2SO4) / V(NaOH) = 0,1 ∙10 / 20 = 0,05(моль/л).
