
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1 Основные понятия и признаки химического равновесия
- •3.2 Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1 Основные понятия
- •7.2 Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Упражнения для самостоятельного решения
- •10. Окислительно_восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Упражнения для самостоятельного решения
- •11. Химическая связь.
- •11.1 Ковалентная связь
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Свойства ковалентной связи
- •11.2. Ионная связь
- •11.3 Водородная связь
- •11.4. Металлическая связь
- •11.5. Химическая связь в твердых телах
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3 Природа химической связи в комплексных соединениях
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Механизмы образования химической связи
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону.
В молекулах Н2, Li2, F2 и Cl2 связи образуются за счет неспаренных s- и р-электронов этих атомов. В молекулах HF и HCl связи образуются s-электронами водорода и p-электронами галогенов. Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов. Из квантовых ячеек N и Н
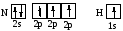
можно видеть, что атом азота имеет 3 неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4.
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома (донор) и свободной орбитали другого(акцептор).
Примером образования химической связи по донорно-акцепторному механизму является реакция аммиака с ионом водорода: H+ + ׃NH3 = NH4+
Роль акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+ атом азота четырехвалентен. В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями
Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация. Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
Для объяснения геометрической конфигурации молекулы используется представление о гибридизации АО центрального атома. Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора - 2s12p2 и возбужденный атом углерода - 2s12p3. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. Например, в таких соединениях как BeCl2, BeCl3,CCl4 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны. Для устранения этого противоречия была предложена концепция гибридизации
Основные положения метода гибридизации:
1. Гибридные орбитали образуются из различных атомных орбиталей, не сильно отличающиеся по энергиям,
2. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
3. Гибридные орбитали одинаковы по форме электронного облака и по энергии.
4 .По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
Следует отметить, что как физический процесс гибридизация орбиталей не существует. Метод гибридизации представляет собой удобную модель наглядного описания молекул.
sp- гибридизация
sp–Гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о(рис.4).
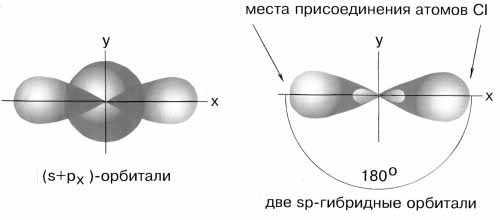
Рис.4 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны, и обе связи имеют одинаковую длину.
sp2-гибридизация
В результате комбинации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу. Такова, например, конфигурация молекулы BF3 (рис.5):
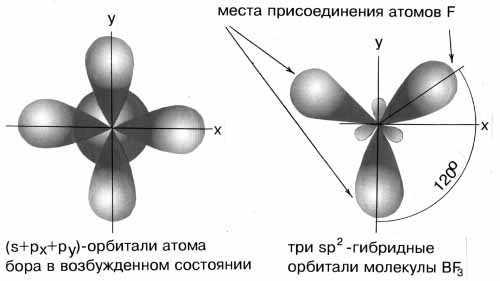
Рис.5 sp2-гибридные орбитали
sp3-гибридизация
sp3-Гибридизация характерна для соединений углерода. В результате комбинации одной s-орбитали и трех р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4 и др.(рис.6).

Рис.6 sp3-гибридные орбитали
Метод гибридизации объясняет геометрию молекулы аммиака. В результате комбинации одной 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о ,соответствующие тетраэдру(рис.7):
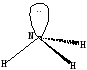
Рис.7 sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода H+ + ׃NH3 = NH4+ в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Гибридизация объясняет также отличие угла между связями О-Н в угловой молекуле воды. В результате комбинации одной 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp3, из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру (рнс.8):
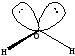
Рис 8 sp3- гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как [SiF6]4-, [Fe(CN)6]4-. При этом молекула имеет конфигурацию октаэдра:
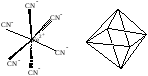
Рис. 9 d2sp3-гибридизация в ионе [Fe(CN)6]4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом.
Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
