
- •В.И. Вершинин, т.В. Антонова, с.В. Усова
- •По аналитической химии
- •Часть 1
- •Издание ОмГу Омск 1998
- •1. Введение для преподавателей
- •2. Правила безопасной работы в лаборатории аналитической химии
- •3. Правила взвешивания на двухчашечных демпферных аналитических весах 2
- •4. Оформление отчетов по лабораторным работам
- •5. Лабораторные работы по химическим методам анализа
- •5.1. Гравиметрическое определение железа Методические указания к лабораторной работе № 1
- •5.2. Аргентометрическое определение галогенидов Методические указания к лабораторной работе № 2
- •А. Стандартизация раствора AgNOз
- •Б. Титрование по методу Мора
- •В. Титрование по методу Фаянса
- •Г. Титрование по методу Фольгарда
- •Д. Выполнение контрольной задачи
- •5.3. Кислотно-основное титрование сильных электролитов Методические указания к лабораторной работе № 3
- •А. Приготовление раствора нCl и его стандартизация методом пипетирования
- •Б. Приготовление раствора NаOh, стандартизация его методом отдельных навесок
- •В. Проверка правильности стандартизации растворов нСl и NaOh
- •5.4. Кислотно - основное титрование слабых электролитов Методические указания к лабораторной работе № 4
- •А. Определение концентрации ледяной уксусной кислоты
- •Б. Определение концентрации водного раствора аммиака
- •В. Определение содержаний карбоната и бикарбоната натрия в их смеси
- •Г. Раздельное определение соляной и борной кислот в смеси. Метод замещения
- •Д. Определение содержания аммонийного азота в солях аммония
- •5.5. Кислотно - основное титрование в неводных средах Методические указания к лабораторной работе № 5
- •Краткие теоретические сведения
- •А. Стандартизация раствора нСlO4в сн3соон
- •Б. Определение концентрации анилина
- •В. Определение состава смеси ацетата и хлорида натрия
- •5.6. Комплексонометрическое титрование Методические указания к лабораторной работе № 6
- •А. Стандартизация рабочего раствора комплексона III по фиксаналу MgSo4
- •Б. Способы установления конечной точки титрования
- •В. Определение общей и кальциевой жесткости воды
- •Г. Способы проведения комплексонометрических титрований
- •Сравнение результатов при титровании разными способами
- •Д. Комплексонометрическое титрование многокомпонентных систем
- •5.7. Перманганатометрическое титрование Методические указания к лабораторной работе № 7
- •А. Стандартизация раствора kMnO4
- •Б. Определение содержания Fe (II) в соли Мора
- •5.8. Хроматометрическое титрование Методические указания к лабораторной работе № 8
- •А. Приготовление рабочего раствора. Прямое титрование восстановителей
- •Б. Определение неустойчивых восстановителей (SnCi2) по методу замещения
- •В. Определение окислителей по методу обратного титрования
- •5.9. Иодометрия Методические указания к лабораторной работе № 9
- •А. Стандартизация рабочего раствора иода
- •Б. Определение концентрации раствора Na2so3методом обратного титрования
- •В. Определение концентрации ионов меди (II) по способу замещения
- •Г. Иодометрическое определение кислот
- •Д. Определение концентрации перекиси водорода по методу замещения
- •6. Материалы для подготовки к практическим занятиям
- •6.1. Правила записи исходных данных и расчет результатов. Использование констант
- •Практическое занятие № 1
- •Оценка погрешности результатов расчета и правила их записи.
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.2. Расчет гетерогенного равновесия “осадок - раствор” Практическое занятие № 2 Теоретические сведения
- •Расчет возможности осаждения при добавлении реагента-осадителя.
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.3. Расчеты протолитических равновесий Практическое занятие № 3
- •Теоретические сведения
- •Примеры расчетов
- •Контрольные вопросы
- •6.4. Расчеты равновесий комплексообразования Практическое занятие № 4 Теоретические сведения
- •Расчет концентрации свободных ионов металла в отсутствие избытка лиганда
- •Расчеты закомплексованности и маскирования при введении избытка лиганда
- •Определение степени образования различных комплексов в их смеси
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.5. Расчет результатов титриметрического анализа Практическое занятие № 5 Теоретические сведения
- •Расчет результатов прямого или заместительного титрования
- •Расчет результатов обратного титрования
- •Другие способы расчета
- •Точность результатов титриметрического анализа
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.6. Статистическая обработка данных. Вычисление и использование доверительных интервалов Практическое занятие № 6 Теоретические сведения
- •Примеры типовых расчетов
- •Контрольные вопросы
- •7. Задачи для самостоятельного решения
- •7.1. Типовые задачи Запись и оценка точности исходных данных
- •Расчеты, связанные с растворимостью осадков
- •Расчеты, связанные с процессом протолиза
- •Расчеты, связанные с равновесием комплексообразования
- •Расчет результатов в титриметрическом анализе
- •Статистическая обработка результатов
- •7.2. Нетрадиционные задачи
- •8. Методические указания для самостоятельной работы на пэвм с применением расчетных программ
- •Справочные материалы (приложения)
- •Коэффициенты активности ионов [8]
- •Свойства некоторых протолитических растворителей
- •Константы кислотности некоторых кислотно-основных пар (кислотные константы)
- •Мольная доля наиболее депротонированных форм вещества HnR (например, анионов Rn-)
- •Закомплексованность металлов с некоторыми маскирующими реагентами-лигандами при разной концентрации l (без учета рН)
- •Критерии отбраковки грубых промахов а) значения q-теста для разных уровней значимости
- •Б) критические значения максимального относительного отклонения [16]
- •Коэффициенты Стьюдента для некоторых уровней значимости
- •Значения критерия Фишера а) для уровня значимости 0,05:
- •Литература
- •Содержание
- •Часть 1
- •В.И. Вершинин, т.В. Антонова, с.В. Усова
- •По аналитической химии
- •Часть 1
Примеры расчетов
1.Рассчитать pH 0,4 % -го раствора едкого натра.
Решение. Переведем процентную концентрацию в молярную: в 1 литре данного раствора содержится 4 г едкого натра (плотность раствора считаем равной единице), т.е. 0,1 моль. Каждому молю гидроксида натрия (сильного основания) соответствует один моль гидроксид-ионов, следовательно, концентрация их в растворе также будет равна 0,1 М. Применим формулу (11): pOH = - lg 0,1 = 1; pH = 14 - pOH = 14 - 1 = 13.
2.Рассчитать pH 0,01 М раствора цианида натрия.
Решение. Цианид натрия - основание, так как катионы натрия протолизу не подвергаются, а цианид-ионы связывают протоны, образуя слабую синильную кислоту. По справочнику находим pKaдля перехода HCN / CN–= 9,21. Рассчитываем значение pKbцианида: = 14 - 9,21 = 4,79. Для данного раствора pC = - lg0,01 = 2,0. Выполняется условие pKb > pC +2, т.е. цианид можно считать очень слабым основанием. Расчет производим по приближенной формуле (13):
pOH
=
![]() = 0,5 (4,79 + 2,0)1,7 ; pH = 14
- pOH = 12,3.
= 0,5 (4,79 + 2,0)1,7 ; pH = 14
- pOH = 12,3.
3.Рассчитать pH 0,001 М раствора муравьиной кислоты.
Решение. По справочнику находим pKa= 3,8, кислота слабая,
pC = - lg 0,001 = 3, условие pKa > pC +2 не выполняется, считать по приближенной формуле нельзя.
Составляем уравнение:
HA = H + A (заряды опускаем)
Ka=![]() =
=![]() .
.
Отсюда
[H]
= -Ka/2 +![]() =
-10-3,8/2 +
=
-10-3,8/2 +![]() 3,3·10-4;
3,3·10-4;
pH = -lg 3,3.10-4= 3,48 (3,5. При вычислении рН по упрощенной формуле мы получили бы значение pH = 3,4.
4.Вычислить pH 0,01 % -го раствора гидрокарбоната натрия.
Решение.Гидрокарбонат-ион может как отдать протон (превращаясь в карбонат), так и принять его от молекулы воды, превращаясь в угольную кислоту. Поэтому гидрокарбонат- ион следует считать амфотерной частицей, а в растворе одновременно находятся все три формы угольной кислоты. Для угольной кислоты в справочнике находим: pKa1 = 6,35 (переход Н2СО3/ HCO3), pKa2= 10,32 (переход НСО3/ CO3). Общая концентрация карбонатов в данном случае значения не имеет. Расчет производится по формуле (14):
pH = 0,5 (6,35 + 10,32) = 8,34.
5.Рассчитать pH 0,01 М раствора серной кислоты.
Решение.Запишем уравнение диссоциации серной кислоты: H2SO4 = 2H++ SO42–. Серная кислота - сильная, в водном растворе она подвергается 100 %-му протолизу по первой ступени, а степень протолиза по второй ступени также близка к 100%, следовательно, в растворе концентрация ионов водорода равна молярной концентрации кислоты, умноженной на 2, т.е. 0,02 и pH = - lg 0,02 = 1,7. Более точный расчет, учитывающий неполный протолиз по второй ступени, дает величину рН 1,8.
6.Рассчитать pH 0,1 М HCl в присутствии 0,01 моль/л сульфата алюминия.
Решение. HCl - сильная кислота, в растворе полностью подвергается протолизу (диссоциирует), следовательно, [H+] = CHCl= 0,1. Но в растворе присутствует значительное количество сильного многозарядного электролита - Al2(SO4)3, и активность ионов водорода значительно отличается от концентрации. Рассчитаем ионную силу раствора: I [Al2(SO4)3] = 0,5 (0,02·32+ 0,03·22) = 0,15.
Следует учесть ионную силу, создаваемую самой хлористоводородной кислотой. Для нее I = СHCl = 0,1. Общая ионная сила раствора, таким образом, равна 0,25. При такой ионной силе коэффициент активности однозарядных ионов водорода лучше взять по справочнику [8, с.87]: fH = 0,80. Поэтому активность Н+–ионов равна 0,080, а pH1,1.
7.Рассчитать pH раствoра, в 150 мл которого имеется 15 г KCN и 10 г HCN.
Решение. Раствор содержит одновременно слабую кислоту и ее сопряженное основание - цианид-ионы. С учетом молярных масс компонентов вычисляем молярные концентрации компонентов буфера:
[HCN] = 2,47 (моль/л); [KCN] = 1,54 (моль/л).
Применяя формулу (15) для вычисления pH буферных растворов, получим pH = pKa+ lg 1,54 / 2,47 = 9,21 - 0,21 = 9,00.
8.Требуется приготовить 2 л 0,25 М буферного раствора с pH 5,0. Предложить методику приготовления такого буфера.
Решение. Выбираем сопряженную пару «кислота - основание» (по Бренстеду) так, чтобы pH буфера отличался бы от pKaпары менее чем на единицу. По таблице констант ионизации находим кислотно-основную пару, удовлетворяющую этому условию: для перехода HAc / Ac–значение pKa= 4,74, причем компоненты буфера (уксусная кислота и ее соли) достаточны инертны, растворимы и доступны. Расчет проводим по формуле (15), но заменяя в ней отношение концентраций отношением числа молей обеих форм:
pH = pKa + lg Ac /HAc.
Так как в 2 л 0,25 М буфера содержится 0,50 моля суммы (HAc + Ac-):
Ac + HAc = 0,50 ; pH = 5 = 4,74 + lg (0,5 - Hac) / HAc.
Отсюда после простых преобразований получается HAc= 0,177;
Ac-= 0,5 - 0,177 = 0,323.
Переведем число молей HAc и Ac-в массы:
mHAc = Hac. MHAc = 0,177 · 60,0 = 10,6 (г);
mNaAc = Ac. MNaAc= 0,323 · 82,0 = 26,5 (г).
Для приготовления буфера необходимо взять 10,6 г ледяной уксусной кислоты и 26,5 г ацетата натрия, растворить в воде и довести объем раствора до 2 л.
9.Как изменится pH одномолярного аммиачного буфера с pH = 9, если к 150 мл его прилить 20 мл 5%- й соляной кислоты?
Решение.При протекании в среде буфера реакций, сопровождающихся выделением или связыванием протонов, величину рН* следует рассчитывать по формуле (15а). Перед основным расчетом вычислим первоначальное число молей компонентов буфера (до введения HCl), а также число молей НСl. Буфер одномолярный, т.е.
[NH3] + [NH4] = 1;
Взято 150 мл буферного раствора: [NH3] +[NH4] = 0,15.
Из условия задачи известно первоначальное значение pH:
9 = 9,26 + lg [NH3] / [NH4] = 9,26 + lg (0,15 - [NH4]) / [NH4]).
Решая последнее уравнение, получим
(0,15 - [NH4])/[NH4] = 0,55;
[NH4] = 0,097;[NH3] = 0,15 - 0,097 = 0,053.
В 20 мл 5%-й HCl содержится 20·0,05 = 1 г хлористого водорода, т.е. 1/36,5=0,027 моль. Плотность раствора HCl приняли равной единице. Подставляя найденные величины в формулу (15а), получаем:
рН*
= 9,26 + lg![]() = 8,28,
= 8,28,
что и требовалось определить по условию.
Можно было построить следующую цепочку рассуждений (начинающим такой вариант решения понятнее):
При приливании кислоты к буферному раствору идет реакция:
H++ NH3= NH4+,
т.е. расходуется 0,027 моль NH3и образуется 0,027 моль NH4+. После реакции в растворе окажется 0,053 - 0,027 = 0,026 моль NH3. Ионов аммония окажется 0,097 + 0,027, т.е. 0,124 моль. Величину pH полученного раствора рассчитываем по обычной формуле:
pH = 9,26 + lg 0,026/0,124 = 8,58.
Естественно, под действием добавленной соляной кислоты произошло снижение рН буферного раствора, но сдвиг рН относительно невелик - с 9 до 8,6.
10.Составить ионную диаграмму, описывающую состояние пирофосфорной кислоты в водном растворе.
Решение. Поскольку кислота имеет формулу H4P2O7и может находиться в водном растворе в пяти различных формах (молекулы Н4R и анионы H3R; H2R; HR; R, отличающиеся друг от друга не только протонированностью, но и зарядом), необходимо построить пять кривых, изображающих графическую зависимости мольной доли соответствующей формы от рН. Таким образом, диаграмма строится в координатах% = f (pH). При pH = 0 выход молекулярной формы близок к 100%, а по мере повышения pH падает из-за перехода молекул в анионы H3R-. Содержание этих ионов постепенно возрастает с ростом рН, а затем снижается, по мере перехода их в ионы H2R, и т.д., вплоть до сильно щелочной среды, где доминируют анионы R4-. Для построения кривых необходимо найти в справочниках кислотные константы, соответствующие переходам между формами разной протонированности, Их показатели равны: 0,91; 2,10; 6,70;: 9,32. Из формулы расчета рН буферного раствора следует, что величина pH равна pKa.при [Кисл.] = [Осн], что соответствует пересечению кривых на ионной диаграмме. Доля каждой из сопряженных форм при этом рН составляет около 50% (если пренебречь наличием других форм кислоты). Очевидно, молекулы Н4R доминируют при рН < 0,91. Анионы H3R-доминируют при рН от 0,91 до 2,10, причем максимальный выход их, приближающийся к 100%, будет на середине интервала (при рН 1,5) и т.д. Таким способом можно получить ионную диаграмму в целом, хотя нельзя достичь высокой точности.
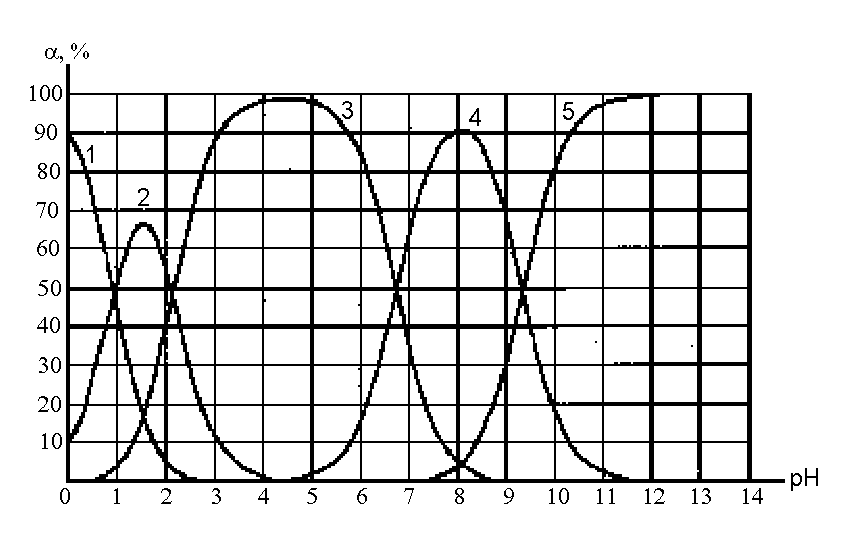
Рис.1. Ионная диаграмма, показывающая состояние пирофосфорной кислоты в водном растворе 1– H4R;2– H3R-;3– H2R2-;4- HR3-;5– R4-
11.В каких формах при pH = 10 находится сероводород в водном растворе? Рассчитать мольные доли каждой из форм. При каком рН достигается максимальный выход гидросульфид-анионов?
Решение. Сероводородная кислота - двухосновная, в растворе она всегда существует в трех формах: H2S, HS-и S2-. Значения показателей кислотных констант (округленно): pKa1= 7,0; pKa2= 12,6. Следовательно, в растворах с рН от 7,0 до 12,6 (в том числе и при рН 10) доминирует форма HS-. Доли всех форм рассчитаем по формулам (16а):
Н2S
=![]() 0,001;
0,001;
HS
=![]() 0,996;
0,996;
S
=![]() 0,003.
0,003.
Наивысший выход гидросульфидов в середине их зоны доминирования, т.е. при рН = (7,0 + 12,6) / 2 = 9, 8.
