
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Саратовский государственный технический университет
Коррозия металлов
Методические указания
к выполнению лабораторной работы
для студентов всех специальностей
-
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Одним из основных показателей могущества государства, прогресса его науки и техники является объём производимого им металла. Однако, создаваемые человечеством металлы и сплавы удаётся использовать далеко не в полной мере. И причиной этого является коррозия.
Коррозия – это процесс самопроизвольного разрушения металла в результате его взаимодействия с окружающей средой. Ущерб, причиняемый коррозией, огромен. Только прямые потери металла из-за коррозии составляют 20% от общего объёма его годового производства. Коррозия металлов всегда есть проявление их термодинамической неустойчивости в рассматриваемых условиях. Результатом коррозионного процесса является образование более устойчивых химических соединений металла, в которых металл Ме – оказывается в окисленном состоянии:
Ме
![]() Меn+
+
Меn+
+
![]()
![]()
здесь n – степень окисленности металла;
![]() – электроны,
отдаваемые металлом при окислении.
– электроны,
отдаваемые металлом при окислении.
По механизму взаимодействия металла со средой различают химическую и электрохимическую коррозию.
ХИМИЧЕСКАЯ КОРРОЗИЯ – процесс самопроизвольного взаимодействия металла с окислительным компонентом коррозионной среды, совершаемый в одном акте окисления-восстановления. Продуктом коррозии в этом случае, как правило, является химическое соединение металла с окислительным компонентом среды, например:
4 Fe + 3 O2 = 2 Fe2O3
Окисление металла при этом происходит путём обмена электронами непосредственно между атомами металла и окислителя. К химической коррозии относятся процессы взаимодействия металлов с сухими газами /например, продуктами сгорания топлива в тепловых двигателях/ или жидкими органическими веществами /нефтепродуктами в резервуарах нефтеналивных судов/.
Как видно, это сравнительно редкие, по существу, частные случаи коррозии, характеризующиеся весьма специфическими условиями. В обычных же условиях, т. е. в подавляющем большинстве реальных случаев /водные среды, влажная атмосфера и т. п./ коррозия, как правило, протекает по электрохимическому механизму, и, таким образом, на практике доминирует электрохимическая коррозия.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ – процесс самопроизвольного взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислителя протекают раздельно, на различных участках корродирующей поверхности, как два сопряжённых электрохимических процесса:
анодного
окисления - Ме→Ме + n![]()
и
катодного восстановления – Ox + n![]() →Red
→Red
Скорости этих сопряжённых процессов равны друг другу (все электроны, генерируемые при анодном окислении, потребляются в катодном процессе) и зависят от потенциала металла. Окислительный компонент при этом может вообще не входить в состав продукта коррозии.
Например,
Fe + 2 H2O = Fe(OH)2 + H2
Возможность такой организации процесса обусловлена тем, что обычно встречающиеся в практике коррозионные среды, наряду с окислительными функциями, как правило, выполняют в той или иной мере и
функции электролитического (ионного) проводника между анодными и катодными участками поверхности корродирующего металла.
В качестве электролитов могут фигурировать растворы солей, кислот, щелочей, природные воды различной минерализации, конденсирующаяся влага со следами растворённых веществ (при коррозии во влажной атмосфере воздуха или др. газов) и т. п.
В таблице 1 дана классификация видов коррозии по условиям протекания.
Таблица 1. Классификация видов коррозии по условиям протекания

Склонность металла к коррозии может быть оценена тем, с какой лёгкостью он отдаёт электроны при взаимодействии с окружающей средой, т. е. какова сила связи электронов с атомом. Ответ на этот вопрос даёт металлохимия элементов, объясняющая различие их физических и коррозионных свойств электронным строением атомов, числом валентных электронов и прочностью связи их с атомным ядром.
Важнейшими металлохимическими свойствами являются: электроотрицательность элементов, валентность и ионизационный потенциал атомов. Чем меньше значения этих параметров, тем легче протекает коррозионный процесс.
Коррозионный процесс подчиняется законам химической термодинамики, позволяющим определить его направление и дать количественную оценку.
Иными словами, условием протекания любого коррозионного процесса является ΔG < 0
Величину ΔG для коррозии того или иного металла можно оценить по уравнению:
ΔG = - nFE
в котором n – число электронов, участвующих в процессе анодного окисления металла, F – число Фарадея (96500 Кл), равное произведению числа Авогадро на величину заряда электрона, а Е – ЭДС коррозионной гальванической микропары. Эта ЭДС равна равновесной разности потенциалов анодного и катодного сопряжённых процессов на поверхности корродирующего металла:
Е = φкат – φанод
Значения потенциалов φкат и φанод в принципе могут быть вычислены по известному уравнению Нернста:
φ
= φо
+
![]() ln
a,
ln
a,
где:
φо – стандартный электродный потенциал металла;
а – активность (“эффективная концентрация”) ионов металла (для φанод) или катодного реагента (вещества, восстанавливающегося на катоде) – для φкат
R – газовая постоянная;
T – абсолютная температура.
Однако, далеко не всегда концентрации, а тем более активности веществ в реальных условиях коррозии доступны непосредственному определению.
Поэтому часто приходится ограничиваться оценкой вероятности протекания коррозионного процесса по величинам стандартных потенциалов φо без учёта реальных концентраций (принимая в качестве грубого, естественно, приближения, что а=1).
Значения стандартных потенциалов (φо) для основных металлов и некоторых неметаллических электрохимических систем приведены в табл.2
Очевидно, что склонность металла к коррозии (ионизации) уменьшается по мере увеличения их потенциалов. Так, из приведенных в табл.2 металлов наименее коррозионностоек литий, обладающий самым отрицательным электродным потенциалом. (φоLi = - 3,045В), а наиболее устойчиво золото (φоАu = + 1,692В).
Необходимо учитывать, что на величину потенциала влияют поверхностные плёнки оксидов и гидроксидов, имеющих высокое удельное сопротивление 10-12…10-14 Ом/м и препятствующих процессу коррозии. Например, наличие оксидной плёнки на Mg повышает значение потенциала на 0,91В, а в случае Al – на 1,12В.
Качество оксидной плёнки характеризуется её сплошностью и скоростью диффузии через неё активных компонентов, например, окислителя.
Таблица 2.
Стандартные электродные потенциалы (о) в водных растворах при t = 25oC и p = 1 атм
|
Электродный процесс |
о, В |
|
Электродный процесс |
о, В |
|
Li = Li+ + e |
- 3,045 |
|
Сo = Co2+ + 2e |
- 0,277 |
|
K = K+ + e |
- 2,924 |
|
Ni = Ni2+ + 2e |
- 0,250 |
|
Ba = Ba2+ + 2e |
- 2,905 |
|
Mo = Mo3+ + 3e |
- 0,200 |
|
Ca = Ca 2+ + 2e |
- 2,866 |
|
In = In+ + e |
- 0,139 |
|
Na = Na+ + e |
- 2,714 |
|
Sn = Sn2+ +2e |
- 0,136 |
|
La = La3+ + 3e |
- 2,522 |
|
Pb = Pb2+ + 2e |
- 0,126 |
|
Nd = Nd3+ + 3e |
- 2,431 |
|
Fe = Fe3+ + 3e |
- 0,037 |
|
Mg = Mg2+ + 2e |
- 2,363 |
|
Ge = Ge2+ + 2e |
0,000 |
|
Al = Al3+ +3e |
- 1,663 |
|
H2 = 2H+ + 2e |
0,000 |
|
Ti = Ti2+ + 2e |
- 1,630 |
|
Bi = Bi2+ + 2e |
0,215 |
|
Zr = Zr4+ + 4e |
- 1,539 |
|
Cu = Cu2+ + 2e |
0,337 |
|
Mn = Mn2+ + 2e |
- 1,179 |
|
Cu = Cu+ + e |
0,520 |
|
V = V2+ +2e |
- 1,175 |
|
2I- = I2 + 2e |
0,536 |
|
Nb = Nb3+ + 3e |
- 1,1 |
|
2Hg = Hg22+ + 2e |
0,789 |
|
Se2- = Se + 2e |
- 0,92 |
|
Ag = Ag+ + e |
0,789 |
|
Cr = Cr2+ + 2e |
- 0,913 |
|
Pt = Pt2+ +2e |
1,188 |
|
Te2+ = Te + 2e |
- 0,84 |
|
2 Br- = Br2 + 2e |
1,065 |
|
Zn = Zn2+ + 2e |
- 0,763 |
|
2H2O = O2 + 4H+ + 4e |
1,228 |
|
Cr = Cr3+ + 3e |
- 0,744 |
|
2Cl- = Cl2 + 2e |
1,359 |
|
Ga = Ga3+ + 3e |
- 0,529 |
|
2F- = F2 + 2e |
1,498 |
|
S22- = 2S + 2e |
- 0,476 |
|
Au = Au3+ + 3e |
1,692 |
|
Fe = Fe2+ + 2e |
- 0,440 |
|
Au = Au+ +e |
2,87 |
|
Cd = Cd2+ + 2e |
- 0,403 |
|
|
|
Металлы s-семейства (Na, К, Са и др.) не образуют сплошной защитной плёнки, так как молекулярный объём образовавшегося оксида меньше объёма металла, израсходованного на его образование. Эти металлы энергично окисляются на воздухе, поэтому их хранят обычно в керосине.
Металлы р- и d- cемейств: (Al, Сr, Ti и др.) образуют сплошные и устойчивые оксидные плёнки, например, Al2O3, Cr2O3, TiO2, поскольку у них отношение объёмов оксида и металла больше единицы. Для таких металлов процесс коррозии зависит от диффузии реагентов через поверхностную плёнку. Для них характерна параболическая зависимость кинетики от окисления металла вида:
y2 = 2DСоt,
где y – толщина оксидной плёнки
D – коэффициент диффузии кислорода
Со – его концентрация
t – время окисления
При электрохимическом механизме коррозии, когда на поверхности металла протекают, по крайней мере, два сопряжённых процесса окисления и восстановления, упрощённо можно представить реальную поверхность металла состоящей из многочисленных пространственно разделённых и электрически замкнутых гальванических микроэлементов. Образующие их анодные и катодные участки поверхности отличаются величиной потенциала, занимаемой площадью, конфигурацией, наличием или отсутствием оксидных плёнок и т. д. Очевидно, что при погружении металла в среду каждый из таких микроскопических участков в начальный момент времени будет характеризоваться энергией, определяемой величиной потенциала.
Согласно рассмотренным положениям термодинамики, с течением времени будет иметь место естественное стремление к выравниванию потенциала на всей поверхности металла.
Установившемуся состоянию системы будет отвечать постоянный, так называемый стационарный потенциал металла – φстац. Следовательно, на анодных участках с начальным потенциалом отрицательнее φстац будет происходить сдвиг потенциала в положительную сторону (анодная поляризация), а на катодных участках – в отрицательную сторону (катодная поляризация). Масса ионизируемого металла определяет количество освобождающихся электронов (силу тока) в рассматриваемой многоэлектродной системе (ток коррозии).
Н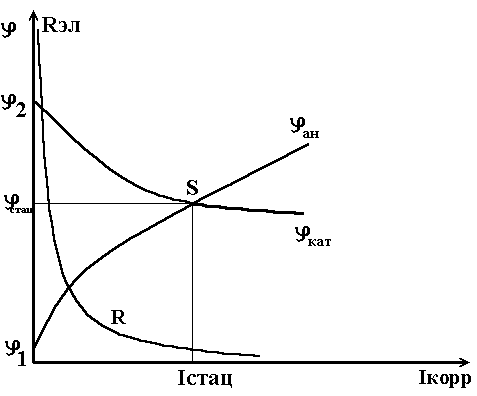 а
рис.1 представлена поляризационная
диаграмма потенциал-ток, поясняющая
электрохимический механизм коррозии.
а
рис.1 представлена поляризационная
диаграмма потенциал-ток, поясняющая
электрохимический механизм коррозии.

Рис.1. Поляризационная (коррозионная) диаграмма 2х электродной системы.
Представим, что корродирующая поверхность образована двумя металлами, имеющими различные электродные потенциалы, причём 1‹2. Из рисунка 1 видно, что разность потенциалов в пределе при бесконечном сопротивлений ( R эл → ∞ ) равна ЭДС системы Ме1 / среда / Me2. По мере уменьшения R эл в системе течёт коррозионный ток Iкорр., происходит увеличение ионной проводимости между Ме1 и Ме2 и выравнивание потенциалов в результате анодной поляризации Ме1 и катодной поляризации Ме2 (см. поляризационные кривые на рис.1). В идеальном случае, при Rэл=0, φ1=2 и соответствует максимальному току коррозии Iстац., которо-
му отвечает стационарный потенциал системы стац. Обе величины опреде-
ляются точкой S на коррозионной диаграмме (рис.1).
Всё сказанное справедливо для многоэлектродной системы, когда поверхность корродирующего металла представляет собой «мозаику» из многочисленных анодных и катодных микроучастков. В этом случае суммарные скорости всех катодных и анодных процессов должны быть равны:
Σia=Σik=Iкорр
Сопоставление потенциалов различных металлов и неметаллических редокс-систем (см.табл.2) показывает, что катодным процессом, сопряжённым с анодным окислением металлов при коррозии в водных растворах электролитов, или, как говорят, деполяризующим процесс анодного окисления, реально может быть восстановление кислорода или водорода (или одновременно и того, и другого). В общем случае под катодной деполяризацией следует понимать процесс «нейтрализации» (связывания) освобождающихся при анодном растворении металла электронов различными способными к катодному восстановлению веществами из окружающей среды. Различают водородную, кислородную и окислительную деполяризацию коррозионных процессов.
В случае водородной деполяризации катодное восстановление водорода протекает по следующим суммарным реакциям:
СРЕДА ЭЛЕКТРОДНЫЙ ПРОЦЕСС о, В
кислая 2H+ + 2![]() = H2
0,0
= H2
0,0
нейтральная H+ + H20 + 2![]() = H2 + OH-
- 0,4
= H2 + OH-
- 0,4
щелочная 2H20 + 2![]() = H2 + 2OH-
- 0,8
= H2 + 2OH-
- 0,8
Кислородная деполяризация чаще всего имеет место при атмосферной коррозии. В процессе ионизации молекул растворённого кислорода на катодных участках поверхности металла образуются гидроксильные ионы OH-, что так же, как и в случае водородной деполяризации, приводит к подщелачиванию среды:
O2
+ 4![]() +2 H2O
= 4OH-
+2 H2O
= 4OH-
К
окислительной деполяризации относят
процессы, связанные с восстановлением
ионов малоактивных металлов (например,
Cu2+
+ 2![]() = Cu) или других ионов, потенциал
восстановления которых выше анодного
потенциала коррозирующего металла,
например, нитрат-ионов:
= Cu) или других ионов, потенциал
восстановления которых выше анодного
потенциала коррозирующего металла,
например, нитрат-ионов:
NO3-
+ H20
+ 2![]() = NO2-
+ 2OH-
= NO2-
+ 2OH-
Рассмотрим
коррозию железа с рассредоточенными
на поверхности включениями меди в
кислой среде (H2SO4).
Образующиеся в зоне включений
гальванические ячейки типа Fe│H2SO4│Cu
включают анод – железо, которое
коррозирует (анодно растворяется) : Fe →
Fe2+
+ 2e и катод – медь, на котором в отсутствие
растворённого кислорода протекает
восстановление водорода (водородная
деполяризация): 2H+
+2![]() =H2.
=H2.
При коррозии того же железа с кислородной деполяризацией (во влажном воздухе) суммарный коррозионный процесс может быть представлен следующими сопряжёнными реакциями:
анодная:
Fe
= Fe2+
+ 2![]() ,
,
катодная:
½ O2
+ H2O
+ 2![]() = 2OH-
= 2OH-
cуммарно: Fe +1/2O2 + H2O = Fe2+ + 2OH- → Fe(OH)2↓
Образующийся гидроксид двухвалентного железа Fe(OH)2 в атмосфере кислорода превращается в гидратированный оксид железа (ІІІ) – Fe2O3·аq (ржавчина):
4Fe(OH)2 + O2 + aq = 2Fe2O3·aq + 4H2O
Процессы катодной деполяризации, протекающие при коррозии металлов в водных средах, ограничиваются, собственно, этими двумя реакциями: восстановлением ионов H+ и молекулярного кислорода O2. Потенциалы этих реакций в стандартных условиях (Т=298К; Pн2=Po2=1атм) определяются из следующих простых уравнений:
1.н2 = - 0,059 рН
2.о2 = 1,228 – 0,059 рН
Как видно, о2 - н2 = 1,228В = соnst, т. е. термодинамически в водных растворах процесс коррозии должен идти с преимущественным восстановлением кислорода. Это характерно для коррозии металлов в речной, морской и пластовых водах, а также во влажных воздушных средах. В кислых средах коррозия протекает преимущественно с выделением водорода.
Состав, структура, внутренние механические напряжения металлов и сплавов определяют их склонность к коррозии и характер разрушения. Практически все металлы содержат примеси. Если они являются катодными по отношению к основе, то она подвержена усиленной коррозии и подчиняется рассмотренным выше кинетическим законам. Например, примесь железа (Fe стац = - 0,35В) в количестве 0,01% увеличивает скорость коррозии магния (Mg стац = - 1,3В) в природных средах в 2-10 раз.
Анодные примеси, как правило, не оказывают существенного влияния на скорость коррозии.
Одним из основных внутренних факторов коррозии является фазовая структура металлов. Например, сплавы системы Al-Mg-Zn могут состоять из восьми фаз. Все фазы отличаются величиной потенциала и поляризационными характеристиками. Потенциал Т-фазы равен – 0,826В; δ-фазы – 1,3В; β-фазы – 0,850В; α-фазы при содержании Zn 0,5% - 0,6В. Очевидно, от соотношения компонентов фаз будут зависеть скорость и характер коррозии.
Механические напряжения способствуют коррозионному процессу. Зоны действия растягивающих усилий обычно являются анодами по отношению к остальной поверхности и подвержены ускоренному растворению. В этом случае наблюдается коррозионная растрескивание и коррозионная усталость.
К внешним факторам, существенно влияющим на скорость коррозии, относятся температура, давление, скорость движения электролита, а также поляризация металла внешним током, блуждающими токами и токами утечки. Кстати, развивающаяся при поляризации металла током так называемая “электрокоррозия” – один из наиболее опасных видов коррозии.
При коррозии двух или нескольких контактирующих друг с другом разнородных металлов более интенсивной анодной поляризации и, соответственно, усиленной коррозии подвержен металл, имеющий более отрицательный потенциал (см. табл.2). Скорость контактной коррозии зависит от разности потенциалов металлов, их удельной электропроводности и соотношения рабочих поверхностей контактирующих фаз. В случае атмосферной коррозии при относительной влажности воздуха более 70% резко увеличивается скорость разрушения чугуна и стали – благодаря образованию рыхлого слоя гигроскопичной ржавчины со структурой геля. Суммарно процесс с кислородной деполяризацией сводится к образованию Fe(OH)2, который, в свою очередь ещё дальше окисляется воздухом до оксида трехвалентного железа Fe2O3.
В сухом воздухе конечными продуктами коррозии стали являются плотные остатки FeO или Fe3O4. Наличие в воздухе агрессивных примесей (сероводород, сернистый газ, хлор и т. д.) и пыли стимулирует коррозию.
