
Анализ и решение
Поскольку Q2 = L·мл (где мл - масса льда, образовавшаяся при изъятии теплоты из холодного резервуара при температуре кристаллизации воды, то есть при 273 К) и Q1 = r·м (где м - искомая масса пара, образовавшегося в горячем резервуаре при температуре 373 К в результате получения им теплоты Q1), то в силу очевидного из формулы для КПД соотношения
Q1/ Q2 = Т1/ Т2, получаем, что м = LмлТ1/ rТ2 = 0,2 кг.
Тепловая машина Карно работает в данном случае как тепловой насос, перекачивающий теплоту из более холодного резервуара в более горячий. Производительность теплового насоса определяется как отношение количества теплоты, переданной за цикл в горячий резервуар, к затраченной при этом работе. Из уравнения для КПД видно, что это отношение κ = Q1/А = =1/обратно КПД цикла Карно. Осталось выразить теплоту Q1, отданную нагревателю, и теплоту Q2, взятую из холодильника, через данные в условии задачи, и можно вычислить производительность теплового насоса κ.
Задача 2.3.
Теоретический цикл бензинового двигателя внутреннего сгорания (двигателя Отто) состоит из двух адиабат и двух изохор (смотрите Рис.1). Определите коэффициент полезного действия (КПД) этого цикла, если степень сжатия V1/V2 =5, а отношение теплоемкостей Ср /Сv =
Р
3
 Рис.1Анализ и решение.
Рис.1Анализ и решение.
П
V1,4 V2,3 V 1 2 4






 олная
работа тепловой машины за цикл определяется
суммой работ на всех участках цикла,
то-есть в нашем случае работой на участках
(1-2) и (3-4), так как на
участках (2-3) и (4-1) работа равна нулю,
поскольку dA = PdV, а V = const. На участке
(1-2) осуществляется сжатие воздушно-бензиновой
смеси, а в точке 2 - ее воспламенение.
Работу на участке (1-2)
вычисляем через адиабатное сжатие
олная
работа тепловой машины за цикл определяется
суммой работ на всех участках цикла,
то-есть в нашем случае работой на участках
(1-2) и (3-4), так как на
участках (2-3) и (4-1) работа равна нулю,
поскольку dA = PdV, а V = const. На участке
(1-2) осуществляется сжатие воздушно-бензиновой
смеси, а в точке 2 - ее воспламенение.
Работу на участке (1-2)
вычисляем через адиабатное сжатие
и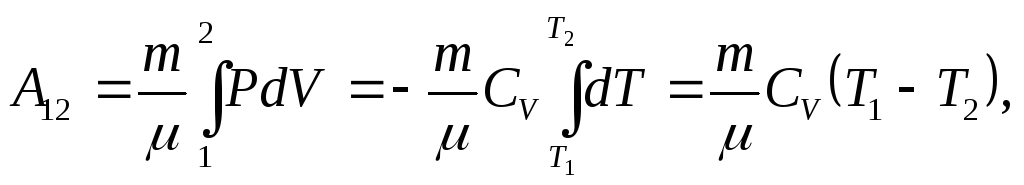 деального
газа, используя соотношениеPdV
= - CVdT
из уравнения (1,2) для случая Q
= 0. Следовательно
деального
газа, используя соотношениеPdV
= - CVdT
из уравнения (1,2) для случая Q
= 0. Следовательно
где m – масса сжимаемой порции воздушно-бензиновой смеси, а - ее молярная масса, практически равная молярной массе воздуха (бензина мало).
Аналогичным образом находят работу на участке (3-4)
![]()
Поскольку на участке (2-3) работа не совершается, то вся выделившаяся в результате сгорания бензина теплота Q идет на увеличение внутренней энергии находящегося в объеме V2 газа. Следовательно,
![]()
Коэффициент полезного действия (теоретический) определится как отношение суммарной (за цикл) работы двигателя к потребленной теплоте.
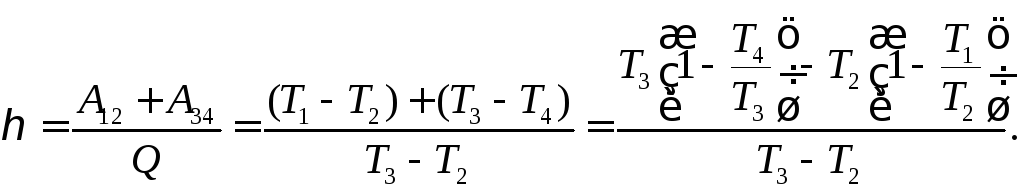
Поскольку в нашем случае V1 = V4 и V2 = V3, то из уравнения адиабаты в координатах температура-объем получаем
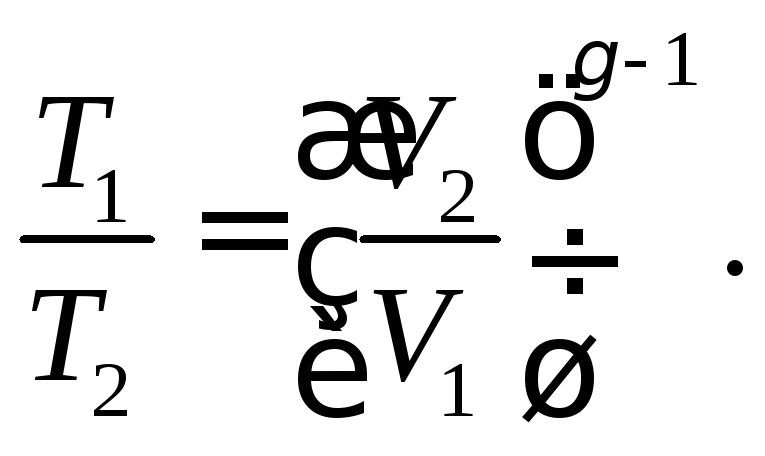
И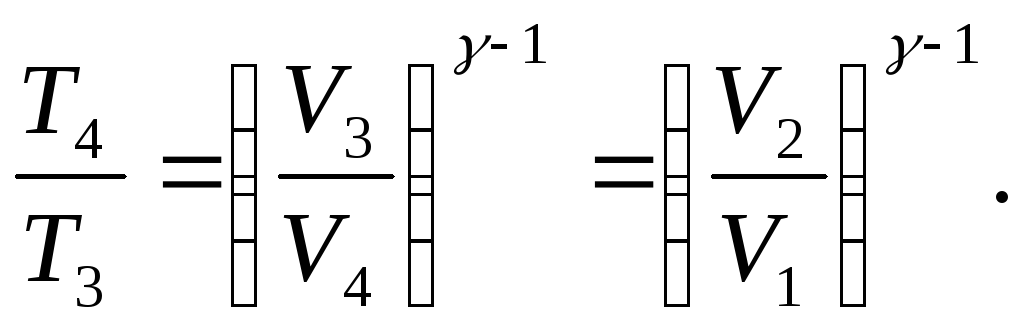 ,
соответственно,
,
соответственно,
Отсюда получаем для коэффициента полезного действия бензинового цикла Отто
![]()
В нашем идеализированном случае КПД оказался зависящим только от степени сжатия V1/V2 и показателя адиабаты горючего . Подстановка чисел дает
Дополнительные вопросы
Для чего тепловые машины должны иметь холодный резервуар («холодильник»)?
Чем определяется максимально достижимый КПД тепловых машин?
Что представляет собой идеальная тепловая машина Карно? Что в ней является рабочим телом? Какие процессы совершает рабочее тело?
Может ли машина Карно работать в обратном направлении? Что собой представляет тепловой насос?
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Рассмотрение цикла Карно показывает, что даже самая совершенная, обратимо работающая тепловая машина не может за цикл превратить в работу всю взятую у нагревателя теплоту, и вынуждена часть ее отдавать холодильнику. При этом уменьшается возможность последующего преобразования теплоты в работу, так как для этого необходима разность температур (именно она определяет КПД цикла), а она в замкнутой системе с каждым циклом будет уменьшаться. В изолированной системе с каждым циклом температура холодильника будет повышаться (а температура нагревателя понижаться), и при полном выравнивании температур нагревателя и холодильника возможность преобразования теплоты в работу будет полностью утрачена.
Таким образом, принципиально новым по сравнению с механикой свойством, обнаруживающимся уже при рассмотрении обратимых термодинамических процессов, оказывается неполная превращаемость теплоты в работу за цикл. Обнаруженное новое свойство термодинамических систем можно сформулировать как невозможность в изолированной термодинамической системе полностью избавиться от хаотического движения микрочастиц, преобразовав все движение этих частиц в упорядоченное (согласованное).
Итак, в замкнутой системе нельзя полностью избавиться от тепловой, хаотической формы движения.
Существует несколько эквивалентных по своему содержанию формулировок второго начала термодинамики (как принято называть то свойство термодинамических систем, которое означает неуничтожимость тепловой формы движения в замкнутой системе).
Если первое начало термодинамики утверждает неуничтожимость движения как такового, что описывается количественно через сохранение энергии как скалярной меры движения в явной (макроскопически-кинетической) или скрытой (потенциальной либо молекулярно-кинетической) формах, то второе начало утверждает принципиальную неустранимость в изолированной системе тепловой, хаотической формы движения. Именно принципиальную, так как частичная возможность преобразования теплоты в работу имеется до тех пор, пока в системе существует разность температур (точнее, пока в системе не наступило тепловое равновесие, то есть выравнивание термодинамических параметров по всему объёму).
Поскольку сформулировано новое свойство, характерное для термодинамических систем, а именно принципиальная неустранимость хаотического движения микрочастиц в замкнутой системе, то становится очевидной необходимость ввести величину, характеризующую эту неустранимую хаотичность. Иными словами, второе начало утверждает, что в замкнутой термодинамической системе нельзя никакими способами уменьшить степень хаотичности состояния этой системы, для количественного определения которой (степени хаотичности состояния) необходима новая функция.
Новое свойство требует введения нового понятия, позволяющего качественно и количественно охарактеризовать это свойство, и, естественно, новой терминологии. Немецкий физик Клаузиус назвал энтропией величину, измеряющую степень хаотичности состояния термодинамической системы.
Модель идеального газа позволяет понять, о чем идет речь. Здесь частицы, участвующие в тепловом движении, хотя и двигаются вполне хаотически, но проявляют, тем не менее, некоторую корреляцию (соответствие) своих состояний, так как существует некоторая согласованность в их движениях (импульсах) и некоторая упорядоченность расположения в пространстве (координатах). При термодинамическом равновесии, несмотря на хаотическое движение микрочастиц, сохраняется средняя величина отклонения импульсов от их (импульсов) среднего значения, а также определенность положения в пространстве (определяемая размерами сосуда с газом). Если под хаотичностью состояния понимать нескоррелированность (несогласованность) состояний отдельных частиц термодинамической системы, то можно ввести величину, являющуюся мерой этой хаотичности и позволяющую количественно оценивать степень несогласованности состояний отдельных частиц системы, то есть степень хаотичности состояния системы (или, по крайней мере, ее изменение при изменении состояния системы).
Поскольку в термодинамике, наряду с необратимыми процессами, в принципе возможны также и обратимые процессы (когда система может вернуться в начальное состояние так, что при этом всё вокруг окажется таким же), то поиск функции, позволяющей измерить степень хаотичности состояния термодинамической системы, естественно, надо начинать с рассмотрения полностью обратимых процессов в изолированных системах. В силу полной обратимости процессов и замкнутости систем степень хаотичности состояния таких систем не должна изменяться, и, следовательно, надо искать функцию, сохраняющуюся в замкнутых системах при всех обратимых тепловых процессах (в том числе при преобразованиях теплоты в работу). Это означает, что изменение этой функции у любого из тел, включенных в замкнутую систему, должно компенсироваться равным по величине, но противоположным по знаку суммарным изменением этой функции у других тел этой, изолированной от внешних влияний системы.
По своему смыслу искомая функция должна быть функцией состояния системы. В противном случае, проводя циклически (в нужном направлении цикла) термодинамическую систему в начальное состояние с другим, меньшим значением этой функции, можно было бы, многократно повторяя цикл, свести к нулю хаотичность состояния системы, что противоречит невозможности всю теплоту преобразовать в работу.Следовательно, в циклических процессах при возвращении термодинамической системы в первоначальное состояние (вне зависимости от пути возвращения и даже без требования замкнутости системы и обратимости процессов) полное изменение этой функции должно быть равно нулю.
Гениальность Клаузиуса проявилась в том, что он увидел связь изменения искомой функции состояния – энтропии (общепринято обозначаемой символом S) с поступлением в термодинамическую систему теплоты (то есть энергии, передаваемой через хаотическое движение микрочастиц). По Клаузиусу, для обратимых процессов это изменение определяется соотношением
![]() (3.1) Из этого соотношения (где Т -
абсолютная температура) сразу следует,
что при обратимых процессах без
теплообмена с внешними телами энтропия
системы сохраняется (система не
обязательно изолирована и может
обмениваться энергией с окружением, но
через работу). Так, например, адиабатное
расширение или сжатие газа изоэнтропно,
и степень хаотичности состояния
сохраняется.
(3.1) Из этого соотношения (где Т -
абсолютная температура) сразу следует,
что при обратимых процессах без
теплообмена с внешними телами энтропия
системы сохраняется (система не
обязательно изолирована и может
обмениваться энергией с окружением, но
через работу). Так, например, адиабатное
расширение или сжатие газа изоэнтропно,
и степень хаотичности состояния
сохраняется.
Возможность (по крайней мере, теоретическая) переводить систему из одного состояния в другое обратимым способом через подведение или отведение теплоты (например, в квазистатическом и поэтому полностью обратимом процессе), имеет принципиальное значение, так как позволяет вычислять разность значений энтропии между двумя любыми состояниями термодинамической системы интегрированием дифференциала поступающей в систему приведенной теплоты (дифференциала энтропии) по формуле
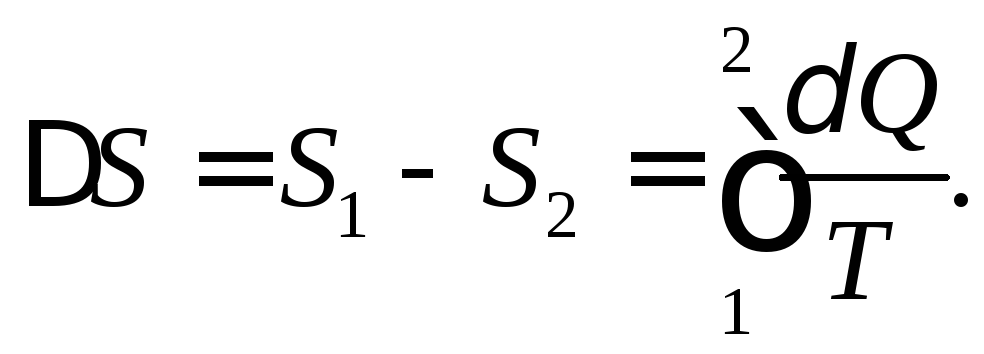 (3.2)
(3.2)
Этот прием вычисления изменения энтропии универсален, поскольку не связан с реально осуществляемым путем перехода системы из одного равновесного состояния в другое. Дело в том, что, хотя разность энтропий находится через вычисления, относящиеся к обратимому, идеализированному переходу, но сама система может переходить из начального (равновесного) в конечное (равновесное) состояние любым, в том числе самопроизвольным и, следовательно, необратимым способом.
Возможность написать Q в обобщенном законе сохранения энергии (1.1) через дифференциал энтропии как TdS позволяет представить первое начало термодинамики в виде
ТdS = dU + dA, (3.3) получившего название термодинамическое тождество, которое для газообразных тел записывается в виде
TdS = СvdT + PdV. (3.3’)
Задача 3.1
Определите изменение энтропии одного моля идеального газа при процессах: адиабатном, изохорном, изотермическом и изобарном.
Анализ и решение
Изменение энтропии может быть найдено по формуле (3.2), но при этом всегда надо помнить, что термодинамическая система должна быть переведена из состояния 1 в состояние 2 обратимым путем. Для этого мы можем считать, что любой из рассматриваемых процессов осуществляется равновесным квазистатическим, то есть бесконечно медленным и, следовательно, обратимым способом. Теперь для вычисления энтропии во всех перечисленных процессах осталось вычислить интеграл в выражении (3.2), заменив Q на (СvdT + PdV) и используя уравнение состояния идеального газа для одного моля PV = RT.
Для адиабатного процесса Q = 0, следовательно,
![]()
Для изохорного процесса в силу dV = 0 и, следовательно, Q = СvdT получаем
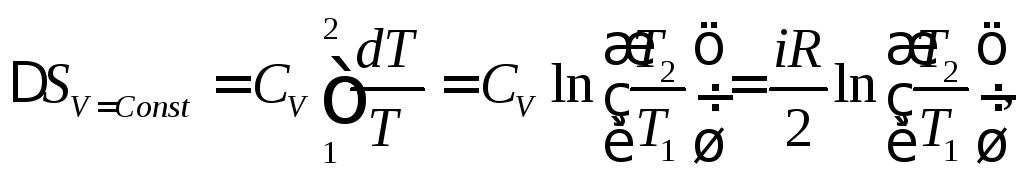
поскольку теплоемкость идеального газа в изохорном процессе постоянна и равна iR/2, где i –число степеней свободы одной молекулы.
Для изотермического процесса dT = 0 и, следовательно, Q = PdV, поэтому
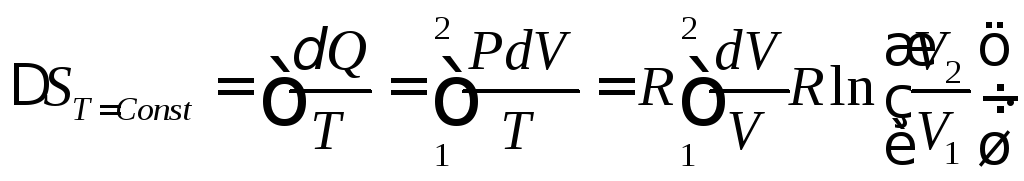
Для изобарного процесса аналогичным образом вычисляем
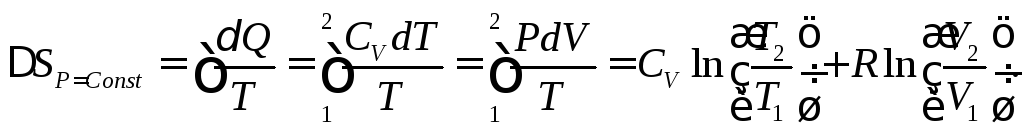
Необходимо помнить, что все полученные формулы справедливы только при полностью обратимых переходах из начального состояния 1 в конечное состояние 2.
Задача 3.2
Определите изменение энтропии при замерзании 1 г воды при 273ОК. Удельная теплота кристаллизации воды L = 3,33∙105 Дж/кг.
Анализ и решение
Процесс кристаллизации вещества является обратимым (равно как и процессы плавления, испарения и конденсации), поэтому для вычисления изменения энтропии надо прямо воспользоваться формулой Клаузиуса (3.1), точнее - ее интегральным эквивалентом (3.2), откуда сразу следует (в силу сохранения температуры при фазовом переходе)
![]()
где через Q = mL обозначена теплота, выделившаяся при кристаллизации. Здесь m - масса льда, образовавшегося при замерзании воды. Осталось подставить в полученную формулу численные значения и учесть, что при кристаллизации вещества теплота уходит из системы, то есть необходимо результат взять с отрицательным знаком. Следовательно, S = mL/T = -1,22 Дж/К.
Задача 3.3
Определите изменение энтропии при выравнивании температур двух одинаковых количеств воды, находившихся первоначально при разных температурах Т1 > Т2, но помещенных внутри общей теплоизолирующей оболочки.
Анализ и решение
Чтобы воспользоваться формулой Клаузиуса (3.2), будем считать, что теплота передается от более горячей воды к более холодной достаточно медленно. Удельную теплоемкость воды с и смешиваемые массы м1 = м2 = м считаем известными. Тогда суммарное изменение энтропии (убыль энтропии у горячей воды и прибыль у холодной)
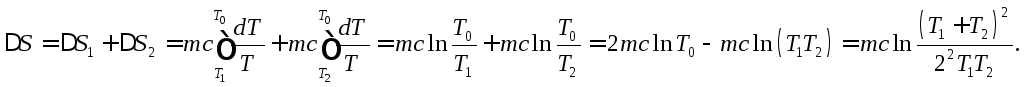
Здесь символом Тообозначена окончательная температура, от которой в нашем случае результат не зависит (массы одинаковы). Очевидно, что в нашем случае То = (Т1+ Т2)/2. Поскольку Т1 и Т2 положительны, то в результате выравнивания температур суммарная энтропия двух масс воды может только возрасти, что подтверждает в данном частном случае общее свойство энтропии возрастать при самопроизвольных (пусть даже бесконечно медленно идущих) процессах, например, при выравнивании температур благодаря тепловому контакту.
Дополнительные вопросы
1. Можно ли в циклическом процессе всю теплоту, взятую у нагревателя, преобразовать в работу?
Что измеряет функция состояния, получившая название энтропия?
Напишите формулу Клаузиуса для вычисления изменения энтропии при обратимом переходе системы из одного состояния в другое.
Почему адиабатные процессы называют изоэнтропными? Всегда ли это утверждение справедливо? Если есть ограничения, то какие?
