
- •1.Расчет горения топлива
- •1.1. Расчет рабочей массы топлива
- •2.Время нагрева металла
- •2.1 Определение времени нагрева металла в методической зоне
- •2.2 Определение времени нагрева металла в I сварочной зоне
- •2.3 Определение времени нагрева металла в II сварочной зоне
- •2.3 Определение времени томления металла
Министерство образования и науки Российской федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Магнитогорский государственный технический университет им. Г.И.Носова»
Кафедра теплотехнических и энергетических систем
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА
|
по дисциплине |
Теплофизика |
|
на тему: |
Тепловой и аэродинамический расчёт методической толкательной печи |
|
Исполнитель: студент 2 курса, группа Тоб- 12 |
Березанская К.А. |
|
Руководитель: доц. к.т.н., доцент |
Сеничкин Б.К. |
"_
|
Работа допущена к защите |
|
| |
|
Работа защищена |
|
с оценкой |
|
(подпись)
Магнитогорск, 2014
Министерство образования и науки Российской федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Магнитогорский государственный технический университет им. Г.И. Носова»
Кафедра теплотехнических и энергетических систем
ЗАДАНИЕ НА РАСЧЕТНО-ГРАФИЧЕСКУЮ РАБОТУ
|
Тема: |
Тепловой и аэродинамический расчёт методической толкательной печи с вращающимся подом |
|
Студенту |
Березанской К.А. |
Исходные данные:
|
№ варианта |
СОСТАВ СУХОГО ГАЗА, объемные % |
Коэф-ент расхода воздуха,n |
Температура подогрева воздуха,0С | |||||||||||
|
СО2 |
СО |
Н2 |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
Н2S |
О2 |
N2 |
|
| |||
|
4 |
5,5 |
28 |
30 |
20,2 |
0 |
0 |
|
0,2 |
0,2 |
15,9 |
1,1 |
400 | ||
|
Марка стали |
Размер заготовки, δxbxl,мм |
|
Р, т/ч |
dв, г/м3 |
dг, г/м3 |
tме, 0С |
Тип печи |
|
Ст.40 |
D300х800 |
1200 |
30 |
32 |
15 |
20 |
МВР |
|
Руководитель: |
|
Сеничкин Б.К. |
|
Задание получил: |
|
Березанская К.А. |
Магнитогорск, 2014
1.Расчет горения топлива
1.1. Расчет рабочей массы топлива
Рассчитать расход воздуха, количество и состав продуктов горения природного газа следующего состава:
Влагосодержание сухого газа dГ = 15 г/м3, температура tВ = 30°С.
Пересчет состава сухого газа на влажный проводится по формулам:
 =1,832%
=1,832%
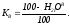 =0,982%
=0,982%
Аналогично рассчитываем:
CO2 =5,5*0,982=5,401%;
CO=28*0,982=27,496%;
H2=30*0,982=29,46%;
CH4=20,2*0,982=19,8364%;
N2=15,9*0,982=15,6138%;
H2S=0,2*0,982=0,1964%;
O2=0,2*0,982=0,1964%.
1.2. Теплота сгорания топлива
В
практических расчетах обычно пользуются
величиной
 ,
поскольку в тепловых устройствах пары
воды, содержащиеся в продуктах горения,
удаляются из рабочего пространства в
газообразном состоянии.
,
поскольку в тепловых устройствах пары
воды, содержащиеся в продуктах горения,
удаляются из рабочего пространства в
газообразном состоянии.
Низшая теплота сгорания газового топлива определяется как сумма тепловых эффектов реакции горения каждого компонента, содержащегося в одном кубическом метре топлива:

Q = 127,7*27,496+108*29,46+358*19,8364+234*0,1964=3511,2392+3181,68+7101,4312+45,9576=13840,308 кДж/кг
1.3. Определение расхода воздуха
Количество окислителя (кислорода), необходимого для полного горения единицы топлива, определяется на основе стехиометрических соотношений горючих компонентов и окислителя. Рассчитанное количество окислителя по стехиометрическим уравнениям представляет собой теоретически необходимое количество кислорода (Vо2) для полного сжигания единицы топлива до СО2 и Н2О.
Для сжигания 1 м3 газового топлива требуется кислорода
Vo2= 0.01· [0.5(H2+CO) + Σ (m + n/4) ·2Cm Hn ]=[0,01(0,5(27,496+29,46)+(3*0,1964)]= =0,01(28,7726+39,4764)=0,68249 %
В атмосферном воздухе содержится 79% N2 и 21% O2. Таким образом, азота по объему в 79/21 = 3,762 раза больше, чем кислорода. Учитывая это, теоретически необходимый расход атмосферного воздуха (Lo) можно определить из выражения
 =(1+3,762)0,68249=3,24995
м3/
м3
=(1+3,762)0,68249=3,24995
м3/
м3
Принимаем, что газ сжигается горелками внешнего смешивания . Тогда коэффициент расхода воздуха принимаем равным n = 1,1. Фактический расход воздуха Ln составит
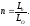
Ln=n*Lo=1,1*3,24995=3,57495м/м3
1.4. Определение выхода и состава продуктов горения
Количество составляющих продуктов горения топлива рассчитывается в соответствии с формулами
VRO2= 0,01( CO+ H2+Σm CmHn)= 0,01[5,401+0,1964+27,496+(1*19,8364)]=0,5293%
VH2O= 0,01(H2O+ H2+Σn/2 CmHn)+0,001244dBLn=0,01[1,832+29,46+0,1964+(2*19,8364) +0,001244*32*3,57495= 0,85392161%
 =0,01*15,6138+1.1*3,76*0,68249=2,97892%
=0,01*15,6138+1.1*3,76*0,68249=2,97892%
 =(1,1-1)0,68249=0,06825%
=(1,1-1)0,68249=0,06825%
Объем продуктов полного горения единицы топлива представляет собой сумму всех четырех составляющих
Vn = VRO2 + VN2 + VH2O +VO2изб =0,5293+0,85392161+2,97892+0,06825=4,43039161%
Состав продуктов горения определяется как отношение содержания каждого компонента к объему продуктов полного горения единицы топлива, выраженное в процентах:

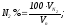
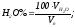

Состав влажных продуктов горения определяется по формуле :
CO2=11,94%
N2= 67,23%
H2O= 19,27%
O2изб= 1,54%
Плотность рассчитывается по правилу аддитивности в соответствии с составом продуктов горения
 =1,25кг/м3
=1,25кг/м3
Исходя из величины общей теплоты продуктов горения, отнесенного к 1м3 их объема iобщ, тогда:
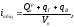
где qB, qT - физическая теплота подогретых, соответственно,
воздуха и топлива.
Расчет физической теплоты, вносимой влажным воздухом, расходуемым на окисление единицы топлива, проводится по формуле (20). Данная величина определяется по фактическому расходу Ln, энтальпии при соответствующей температуре его подогрева iB и влажности dB
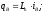
 =0,039808%
=0,039808%
tB =400°
 =
537,9624602кДж/м3
=
537,9624602кДж/м3
При нагреве газа свыше 500°С расчет физической теплоты газа qТ может быть выполнен по выражению

qT =1788,054кДж/кг
Теплота, вносимая в зону горения твердым и жидким топливом, весьма мала и ею можно пренебречь.
Содержание свободного воздуха в продуктах горения при n = 1,1 составит
 =7,335694643%
=7,335694643%
Рассчитать теоретическую температуру горения Тт, в зависимости от сорта топлива, можно по формулам:
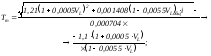
Tm=1999,501295K
По it–диаграмме, при i = 3767,68 кДж/м3 и tTa = 1474,75°C.

