
органика для медиков
.pdfБорисова Т.Н., Варламов А.В., Сорокина Е.А., Воскресенский Л.Г., Никитина Е.В.
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
ДЛЯ СТУДЕНТОВ МЕДИЦИНСКОГО ФАКУЛЬТЕТА СПЕЦИАЛЬНОСТИ “ФАРМАЦИЯ”
Москва
2007

ОСНОВНЫЕ ПОНЯТИЯ
I.Типы связей в органических соединениях
1.Ковалентная – это связь, образованная за счет обобществления электронов двух атомов. Имеется два механизма образования ковалентной связи:
а) при ковалентном механизме образования каждый из атомов, образующих связь предоставляет по одному электрону:
1ē + 1ē (ē - электрон)
Примеры Н-Н – ковалентная неполярная
Н-Cl – ковалентная полярная;
Полярность связи (поляризация связи) обозначается в органической химии с помощью частичных зарядов ( δ ) и соответствует разнице в электроотрицательности элементов (см. ниже соответствующую таблицу). Например, CH3+δ→Br-δ, H+δ→Br-δ
б) при донорноакцепторном механизме образования один из атомов предоставляет неподеленную пару электронов (НПЭ), а другой – вакантную орбиталь.
2 ē + ( - вакантная орбиталь)
Примеры
NH3 + H |
NH |
|
4 |
CH3NH2 + 
 H
H
 CH3NH3
CH3NH3
2. Семиполярная – ковалентная связь, дополненная электростатическим взаимодействием атомов (образована по донорно-акцепторному механизму).
(CH ) N + |
BF |
(CH3)3N BF3 |
||
3 |
3 |
3 |
|
|
CH3O CH3 + |
BF3 |
CH3 |
O CH3 |
|
|
|
|
|
BF3 |
(CH3)3N + |
O |
(CH3)3N O |
||
|
атом кислорода |
|
|
|
3. Ионная – электростатическая связь между противоположно заряженными ионами.
В органических соединениях из-за значительной разницы в электроотрицательности элементов ионными являются связи между атомами углерода (в sp-гибридизации), кислорода, азота, серы и щелочными и щелочноземельными металлами.
3

Примеры
H |
C C Na |
CH3 |
O |
Na |
CH3 |
C |
O |
|
O K |
||||||||
ацетиленид натрия |
метилат натрия |
ацетат калия |
||||||
CH3 |
O |
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
||
|
O Ca+2 |
CH3 |
NH Na |
|
CH3 |
S K |
||
CH3 |
O |
|
метиламид натрия |
метилтиолат калия |
||||
C |
|
|||||||
|
|
|
|
|
|
|||
|
O |
|
|
|
|
|
|
|
(CH3COO)2Ca |
|
|
|
|
|
|
||
ацетат кальция |
|
|
|
|
|
|
||
Электроотрицательность элементов по Полингу.
Li |
1,0 |
Be |
1,5 |
B |
2,0 |
H 2,1 C |
2,5 |
N |
3,0 |
O |
3,5 |
F |
4,0 |
Na 0,9 |
Mg |
1,2 |
Al |
1,5 |
Si |
1,8 |
P |
2,1 |
S |
2,5 |
Cl 3,0 |
||
K |
0,8 |
Ca |
1,0 |
|
|
|
|
|
|
Se 2,5 |
Br 2,8 |
||
Rb |
0,8 |
Sr |
1,0 |
|
|
|
|
|
|
|
|
I |
2,5 |
Cs |
0,7 |
Ba |
0,9 |
|
|
|
|
|
|
|
|
|
|
Данные по атому углерода: Csp3 |
2,5 |
Csp2 |
2,8 |
Csp |
3,1 |
II. Типы гибридизаций атомов, участвующих в образовании органических соединений
Для атома углерода.
1. Исходное невозбужденное состояние (ИНС) 1s22s22p2
Атом С имеет четыре валентных ē.
 2s 2p 1s
2s 2p 1s
2. Варианты перераспределения валентных электронов атома углерода за счет гибридизации
Гибридизация – выравнивание валентных электронных облаков по форме и энергии. Гибридные орбитали изображаются в виде несимметричных гантелей.
1) sp3 |
Валентные ē sp3-гибридизованного атома углерода участвуют в |
образовании четырех равноценных σ- связей с помощью 4-х неспаренных ē.
4
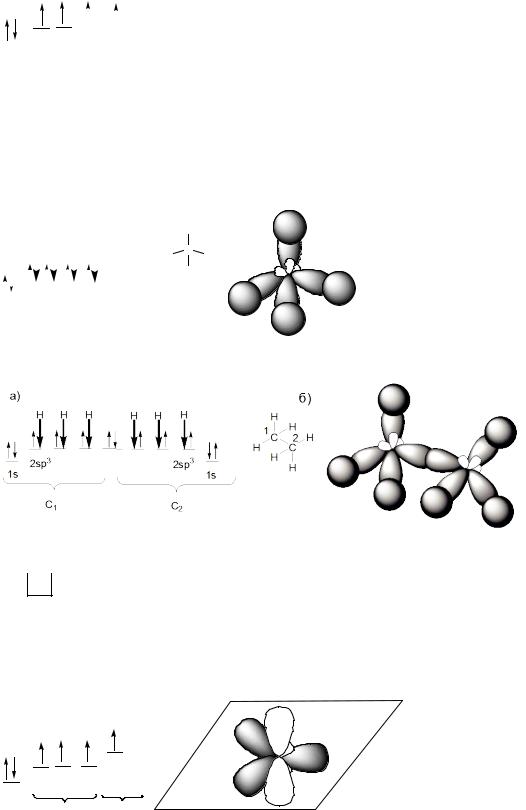

 Оси четырех sp3 – орбиталей направлены к вершинам
Оси четырех sp3 – орбиталей направлены к вершинам
|
2sp3 |
тетраэдра, валентные углы равны 109о 28′. |
|
||
1s |
|
|
Для изображения СН-связей в молекуле метана (СН4) возможны два варианта: а) схема заполнения подуровней; б) объемная модель.
Модели молекул метана и этана.
|
а) H H H H |
|
H |
|
|||||||||||||||
|
|
б) H C |
H |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
2sp3 |
|
|
|||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|||||||||||||||
1s |
|
|
|||||||||||||||||
2) |
|
Валентные ē sp2-гибридизованного атома углерода участвуют в |
sp2 |
образовании трёх равноценных σ-связей, четвертая π-связь осуществляется за счет электронов рz-орбитали.
pz |
Оси трех sp2 – орбиталей |
|||
|
расположены на плоскости, |
|||
pz |
угол -1200. |
|
|
|
Орбиталь pz |
расположена |
|||
2sp2 |
||||
1s |
перпендикулярно |
этой |
||
σ-связи π-связь |
плоскости. |
|
|
|
|
|
|
||
5

Модель молекулы этена (этилена) СН2 = СН2
|
|
π |
H |
σ |
H |
|
C |
C |
H |
|
H |
π-Связь перпендикулярна плоскости, в которой лежат sp2 – гибридные орбитали и образована за счет бокового (латерального) перекрывания р- орбиталей. Это перекрывание менее эффективно (имеет меньшую площадь),
чем при образовании σ-связей (в этом случае гибридные облака перекрываются по линии, связывающей центры атомов).
3) |
sp |
Валентные ē sp-гибридизованного атома углерода участвуют в |
образовании двух равноценных σ-связей, образование двух π-связей осуществляется за счет рy и pz – орбиталей. Оси sp – орбиталей представляют собой линию, угол 180°.
Py Pz
1s 2sp
|
π |
|
π |
H |
H |
C |
C |
Модель молекулы этина (ацетилена) СН≡СН имеет палочковую (цилиндрическую) симметрию, облака π – связей взаимно перпендикулярны.
6

Модели некоторых более сложных молекул
sp2 sp2 sp3 sp3 |
H |
H |
|
|
H C CH CH |
CH |
3 |
бутен-1 |
|
3 |
4 |
||||
2 |
1 |
2 |
3 |
2 4 |
|
|
||||
|
|
|
|
|
π |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
H |
H |
|
|
|
|
|
|
|
H |
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
4 |
π |
π |
|
3 |
|
||
H |
|
|
π |
|
|
|
|
|
|
2 |
1 |
|
|
|
H |
sp |
sp sp2 |
sp2 |
бут-1-ен-3-ин |
|
H C |
C CH CH |
2 |
||
4 |
3 2 |
1 |
(винилацетилен) |
|
|
|
|
|
H |
Варианты распределения валентных электронов для атома азота.
1. |
N |
2 |
2 |
3 |
|
ИНС: 1s |
2s 2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атом азота имеет пять валентных электронов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
|
|
|
|
|
||||
|
|
|
|
|
2s |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
1s |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. а) |
|
|
sp3 |
|
|
Валентные ē sp3-гибридизованного атома азота образуют три |
||||||||||||
ковалентные |
|
σ-связи за счёт неспаренныхē или четыре связи с участием |
||||||||||||||||
неподеленной пары электронов (НПЭ) по донорно-акцепторному механизму.

 2sp3 1s
2sp3 1s
Модели молекулы аммиака NH3 и иона аммония NH4+
7
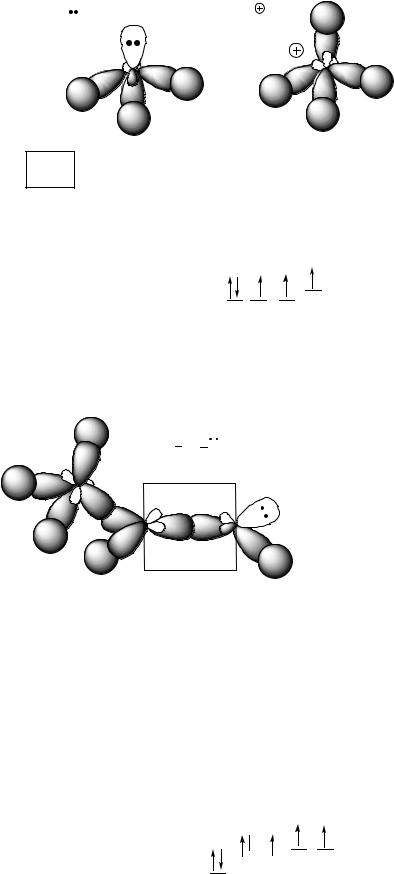
NH3 |
|
NH4 |
|
|
НПЭ |
|
|
N |
|
N |
|
|
|
||
|
H |
H |
|
H |
H |
||
|
|||
H |
|
H |
б) sp2 В sp2 гибридизованном атоме азота четыре валентных электрона, включая НПЭ, располагаются на гибридных орбиталях. Два
неспаренных электрона участвуют в образовании 2-х σ-связей, пятый валентный электрон, находящийся на 2pz участвует в образовании π-связи.
 2sp2 2pz 1s
2sp2 2pz 1s
Модель молекулы имина этаналя
|
|
H |
2 |
1 |
π |
NH |
|
|
|
H3C CH |
|
||
H |
|
C |
sp3 |
sp2 |
σsp2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НПЭ |
|
|
|
C |
σ |
|
N |
|
H |
H |
|
π |
|
H |
|
|
|
|
|||
|
|
|
|
|
|
|
Возможен второй вариант распределения валентных электронов в атоме азота, кроме приведенного выше. В этом случае НПЭ располагается на 2pz – орбитали (см. тему “Пятичленные гетероциклы с одним гетероатомом”).
в) |
sp |
В sp-гибридизованном атоме |
азота три валентных электрона, включая |
|
|
НПЭ, располагаются на |
sp-гибридных орбиталях. Неспаренный |
|
|
электрон участвуют в образовании 1-ой σ-связи, ещё два электрона находятся на py и pz-орбиталях и принимают участие в образовании двух π-связей.

 2pz 2py 2sp
2pz 2py 2sp
1s
8

Модель молекулы синильной кислоты
H C  N
N
H
|
π |
|
π |
C |
N |
Примеры моделей других молекул
H |
H3C NH2 метиламин |
|
2 |
1 |
|
|
H |
H3C C |
N |
π |
|||
|
sp3 sp3 |
|
sp3 |
sp |
sp |
π |
|
|
|
|
|
|
|
C |
|
N |
|
2 |
1 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||
H |
|
|
H |
|
|
|
N |
|
|
|
|
C |
σ |
||
H |
H |
H |
H |
|
нитрил этановой (уксусной) кислоты, |
||
|
|
|
ацетонитрил |
|
|||
Варианты распределения валентных электронов для атома кислорода.
1. О ИНС: 1s2 2s2 2p4
2s 2p
|
|
Атом кислорода имеет шесть валентных электронов. |
|
1s |
|||
|
|||
а) sp3 |
Валентные электроны sp3- гибридизованного атома кислорода |
участвуют в образовании двух σ-связей, две неподеленные пары располагаются на оставшихся sp3-гибридизованных орбиталях.
 2sp3 1s
2sp3 1s
9

Модели молекул воды и метанола
|
H |
|
H O H |
H3C O H |
|
O |
C |
O |
|
|
|
H |
H |
|
H |
H |
H |
|
|
Возможно образование трех ковалентных связей, третья связь строится по донорно-акцепторному механизму.
Модели ионов гидроксония и метилгидроксония
H O H |
H H O H |
CH3 O H H CH3 |
O H |
|
H |
H |
H |
|
|
|
|
|
O |
C |
|
|
|
O |
|
|
H |
|
|
H |
H |
|
|
|
|
||
|
|
|
|
|
H |
H |
H |
|
H |
||
|
|
||
б) sp2 |
В sp2-гибридизованном атоме кислорода на гибридных орбиталях |
||
находятся пять электронов, |
включая две НПЭ. Шестой валентный электрон |
||
расположен на 2pz и участвует в образовании π-связи.
Модель молекулы метаналя (формальдегида)
|
|
|
π |
|
H |
|
σ |
|
pz |
|
|
1s |
2sp2 |
C |
O |
H |
|
|
|
|
|
|
H
sp2HC
 O
O  sp2
sp2
Второй вариант распределения валентных электронов атома кислорода предполагает наличие на 2pz одной НПЭ (аналогично атому азота) (см. тему “Пятичленные гетероциклы с одним гетероатомом”).
10
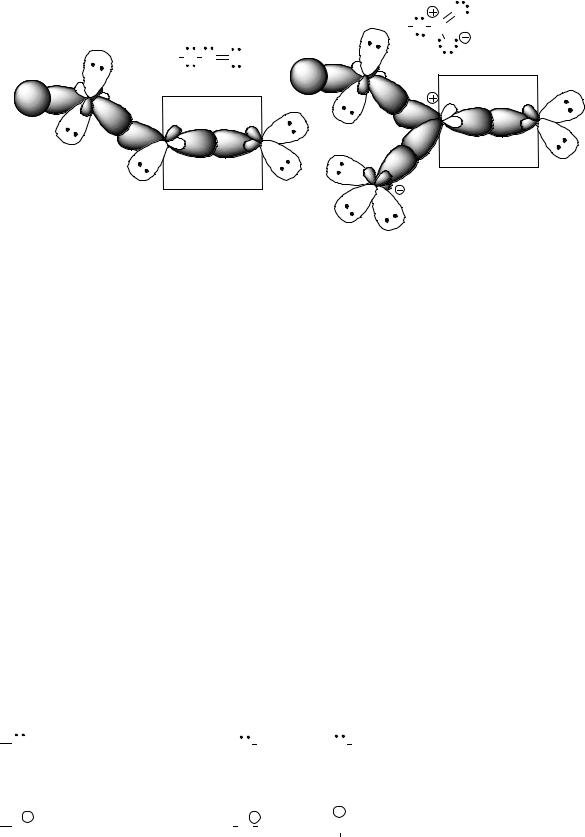
Примеры моделей других молекул |
|
|
|
|
||||
Модели молекул азотистой (HNO2) и |
азотной (HNO3) кислот |
|
||||||
|
|
|
|
|
|
H O N O- одна из резонансных структур |
||
|
H |
O N |
O |
H |
O |
O |
|
|
|
|
|
|
|||||
|
O |
sp3sp2 |
sp2 |
|
|
|
|
|
H |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
s |
O |
|
N |
s |
|
O |
|
O |
p |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
sp-Гибридизация не характерна для атома О.
Структуры Льюиса
Изображение молекулы (или иона), в котором наибольшее возможное число атомов (за исключением водорода) получает восемь внешних электронов (октет) (т.е. указываются все НПЭ и имеющиеся формальные заряды). Структура Льюиса является прекрасным способом изображения распределения электронов в молекулах, и применяется, прежде всего, при описании строения молекул методом резонанса (см. далее).
Определение формального заряда(ф.з.) элемента в молекулах органических соединений.
Ф.З. = V – (1/2 X + У)
V – число валентных электронов, соответствующих номеру группы элемента в периодической системе; Х – общее число электронов всех ковалентных связей;
У – общее число электронов неподелённых пар.
Примеры определения формального заряда для атома азота:
N |
|
примеры: |
H |
|
N H |
; |
H C |
|
|
N H |
|
метиламин |
|||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
V = 5, X = 6, Y = 2, Ф.З.= 0 |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
; |
CH |
|
|
|
|
|
|
|
|
CH |
|
катион триметиламмония |
|||
|
|
|
|
|
примеры: |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|||||||
|
|
|
|
|
H N |
H |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
N |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
CH3 |
3 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
V = 5, X = 8, Y = 0, Ф.З.= +1 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
11
