
- •Методические указания
- •1. Основные классы неорганических соединений
- •Лабораторная работа 1
- •2. Концентрация растворов и способы ее выражения
- •Способы выражения концентрации растворов
- •Лабораторная работа 2
- •3. Скорость химических реакций. Химическое равновесие
- •Химическое равновесие
- •Лабораторная работа 3
- •4. Ионное произведение воды. Водородный показатель
- •Расчет рН растворов электролитов
- •5. Гидролиз солей
- •Лабораторная работа 4
- •6. Строение атомов и молекул
- •7. Комплексные соединения
- •Лабораторная работа 5
- •8. Окислительно-восстановительные реакции (овр)
- •Лабораторная работа 6
- •9. Титриметрический анализ
- •9.1. Кислотно-основное титрование
- •Лабораторная работа 7 Приготовление и стандартизация раствора соляной кислоты
- •Лабораторная работа 8 Определение карбонатной жесткости воды
- •Лабораторная работа 9 Контрольное определение содержания щелочи в растворе
- •9.2. Окислительно-восстановительное титрование (оксидиметрия)
- •Перманганатометрия
- •Лабораторная работа 10 Приготовление рабочего раствора перманганата калия и стандартизация его по оксалату натрия
- •Лабораторная работа 11 Определение железа (II) в растворе соли Мора
- •9.3. Комплексонометрическое титрование
- •Лабораторная работа 12 Приготовление и стандартизация раствора комплексона III
- •Лабораторная работа 13 Определение общей жесткости воды
- •10. Основы качественного анализа неорганических ионов
- •Классификация ионов в различных схемах анализа
- •Лабораторная работа 14 Реакции обнаружения катионов s-элементов
- •Лабораторная работа 15 Реакции обнаружения катионов р-элементов
- •Реакции катиона олова(IV)
- •Лабораторная работа 16 Реакции обнаружения катионов d-элементов
- •Лабораторная работа 17 Реакции обнаружения анионов важнейших кислот Реакции сульфат-аниона (so42–)
- •Реакции сульфит-аниона (so32–)
- •Реакции карбонат-аниона (сo32–)
- •Реакции фосфат-аниона (рo43–)
- •Реакции оксалат-аниона (с2o42–)
- •Реакции хлорид-аниона (Сl–)
- •Реакции бромид-аниона (Br–)
- •Реакции йодид-аниона (I–)
- •Реакции сульфид-аниона (s2–)
- •Реакции нитрат-аниона (nо3–)
- •Реакции нитрит-аниона (nо2–)
- •Реакции ацетат-аниона (сн3соо–)
- •Библиографический список
- •Содержание
- •Методические указания
Лабораторная работа 11 Определение железа (II) в растворе соли Мора
Определение содержания железа (II) в растворах является одним из важнейших применений перманганатометрии, которое осуществляют прямым методом титрования. Соль Мора (NH4)2Fe(SO4)2 6Н2О окисляется перманганатом калия в среде серной кислоты согласно уравнению:
2KMnO4 + 10(NH4)2Fe(SO4)2 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + + 10(NH4)2SO4 + K2SO4 + 8H2O.
В отличие от титрования оксалат-иона, данное определение проводят на холоде, так как при нагревании железо (II) окисляется кислородом воздуха до железа (III).
Ход определения. Исследуемый раствор соли Мора в мерной колбе доводят дистиллированной водой до метки. В колбу для титрования мерной пипеткой отбирают 10,0 мл анализируемого раствора, подкисляют 10–15 мл раствором H2SO4 с молярной концентрацией эквивалента 2 моль/л и титруют рабочим раствором перманганата калия до появления устойчивой бледно-розовой окраски. Повторяют титрование 23 раза, результаты записывают в таблицу 8 и определяют содержание железа (II) по формулам:
Таблица 8
|
№ опыта |
V (соли Мора), мл |
V (KMnO4), мл |
|
1 |
10 |
|
|
2 |
10 |
|
|
3 |
10 |
|
|
Среднее значение |
10 |
|
С(соли
Мора) =
![]() (моль/л);
(моль/л);
Т(соли
Мора/Fe)
=
![]() (г/мл);
(г/мл);
m(Fe) = Т(соли Мора/Fe) . Vколбы (г).
Железо (II) окисляется до железа (III), теряя один электрон. Поэтому молярная масса эквивалента железа равна его атомной массе 55,85.
9.3. Комплексонометрическое титрование
Метод основан на реакции образования прочных комплексных соединений ионов металлов с рядом комплексообразующих органических реагентов, получивших название комплексонов. Связывание определяемого катиона в комплекс происходит тем полнее, чем прочнее образующийся комплекс. Для этого титрование комплексонами проводят при строго определенных условиях, из которых наибольшее значение имеет рН титруемого раствора.
Наибольшее значение из комплексонов имеет двунатриевая соль этилендиаминтетрауксусной кислоты ЭДТА, которую называют также комплексоном III или трилоном Б.
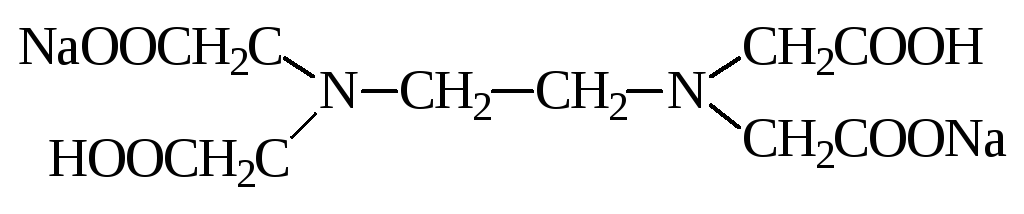
Комплексон III образует со многими катионами достаточно прочные и растворимые в воде внутрикомплексные соли в результате замещения атомов водорода функциональных групп органического реагента, на катион металла. Одновременно катион металла взаимодействует с атомами азота аминогруппы посредством координационной связи:
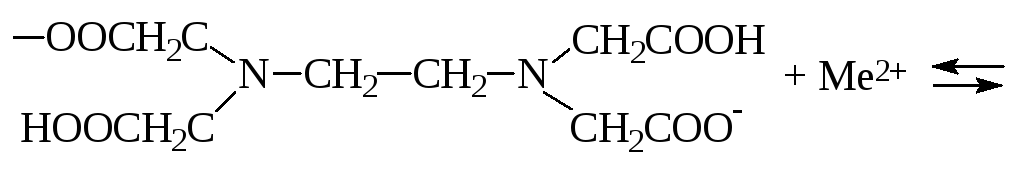

или
H2Y2 + Me2+ MeY2 + 2H+.
Со всеми ионами металлов (кроме одновалентных) ЭДТА реагирует в отношениях 1:1. В умеренно кислых растворах эти реакции могут быть записаны в следующем виде:
H2Y2 + Ме2+ MeY2 + 2Н+,
H2Y2 + Ме3+ MeY + 2Н+,
H2Y2 + Ме4+ MeY + 2Н+.
Таким образом, молярная масса эквивалента любого металла будет равна 1/2 его атомной массы. Поскольку степень комплексообразования зависит от рН, титрование раствором ЭДТА проводят при постоянном рН, которое достигается добавлением буферного раствора.
В качестве индикаторов применяют интенсивно окрашенные красители (металлоиндикаторы), образующие с титруемыми ионами металлов комплексы различной окраски. Чаще всего в практике используют эриохром черный Т, мурексид, ксиленоловый оранжевый и др.
В зависимости от рН раствора эриохром черный Т существует в трех окрашенных формах:
|
|
pH < 6 |
|
pH 7 11 |
|
pH > 11 |
|
|
|
H2Ind |
|
HInd2 |
|
Ind3 |
|
|
|
Винно- красный |
|
Синий |
|
Оранжевый |
|
В слабощелочном растворе при добавлении индикатора ионы металла связываются в комплекс винно-красного цвета:
|
|
Me2+ |
+ |
HInd2 |
|
MeInd |
+ H+ |
|
|
|
|
|
|
Винно- красный |
|
В точке эквивалентности комплекс металла с индикатором разрушается, то есть образуется более прочный комплекс иона металла с ЭДТА, анионы индикатора освобождаются и переходят в раствор, сообщая ему синюю окраску:
|
MeInd |
+ |
H2Y2 |
= |
MeY2 |
+ |
HInd2 |
+ |
H+ |
|
Винно-красный |
|
Бесцветный |
|
Бесцветный |
|
Синий |
|
|
