
- •176 Программа блока гетерофункциональные углеводороды.
- •Конспект лекций гетерофункциональные углеводороды
- •Углеводы
- •1.1 Моноуглеводы
- •Химическое строение моносахаридов
- •1. Реакции карбонильных форм моносахаридов
- •2.2 Реакции с участием всех гидроксильных групп
- •Олигосахариды
- •1.2.1 Дисахариды
- •1.2.3 Несахароподобные полисахариды
- •1.2.3.1 Гомополисахариды
- •1.2.3.2 Гетерополисахариды
- •2. Аминокислоты
- •(Nh2)m r(cooh)n,
- •2. Получение β-аминокислот
- •3.2.Перегруппировка оксимов (перегруппировка Бекмана):
- •1,1-Амидные группы
- •Оксикислоты
- •7. Синтез из альдегидов
- •1.3 Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
- •4. Гетероциклические соединения
- •4.1 Пятичленные гетероциклы с одним гетероатомом
- •6. Реакция диенового синтеза с малеиновым ангидридом
- •2. Пиролизом:
- •1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
- •3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300с:
- •4. При перегонке сукцинимида с цинковой пылью:
- •5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы:
- •3. Реакция электрофильного замещения (механизм и ориентация замещения):
- •1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий:
- •4.2 Пятичленные гетероциклы с несколькими гетероатомами
- •4.3 Шестичленные гетероциклы с одним гетероатомом
- •4.4 Шестичленные гетероциклы с несколькими гетероатомами
- •1. Основные свойства:
- •2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
- •4.4 Шестичленные гетероциклы с двумя разными гетероатомами
- •Нобелевские премии по органической химии
2. Пиролизом:
2.1
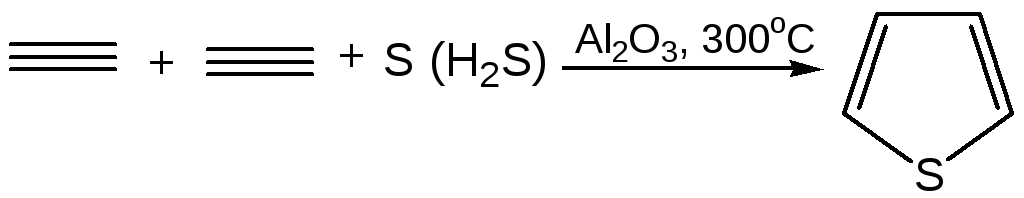
2.2
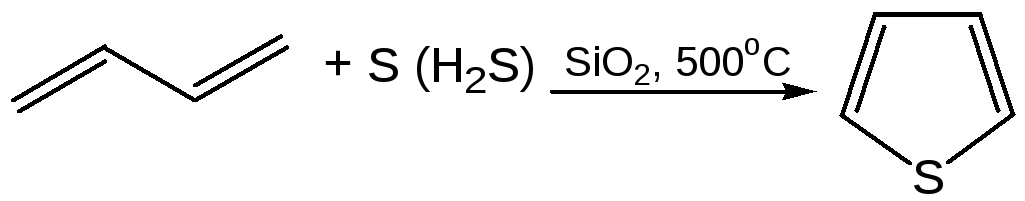
2.3

Практическое применение тиофена и его производных
Циклическая система тиофена встречается в природе в некоторых продуктах растительного происхождения, но гораздо большее значение имеет это соединение в составе синтетических лекарственных препаратов и красителей.
Производные тиофена находят практическое применение в производстве различных красителей, пластификаторов, пластмасс, аналитических реагентов, инсектицидов. Уже давно начала успешно развиваться и приобрела большое промышленное значение химия тиоиндигоидных красителей. В основе этого класса красителей лежит сернистый аналог индиго – тиоиндиго.
Тиоиндиго – кубовый краситель красного цвета. Синтез тиоиндиго проводится по методам, очень близким к методам синтеза самого индиго. Класс тиоиндигоидных красителей включает красители разнообразных цветов и оттенков. На примере этих красителей изучается зависимость глубины окраски и изменения цвета от электронного взаимодействия тиоиндигоидного скелета с различными заместителями.
Используют тиофен в органическом синтезе.
Пиррол. Важнейший представитель пятичленных гетероциклов с одним гетероатомом. Он является родоначальником важных природных соединений, к которым принадлежат гем (компонент гемоглобина крови) и хлорофилл.

История открытия пиррола. Пиррола был обнаружен в костяном масле (продукт сухой перегонки костей) и в небольшом количестве в каменноугольной смоле (Рунге, 1834 г.). Строение его установлено А. Байером в 1870 г.
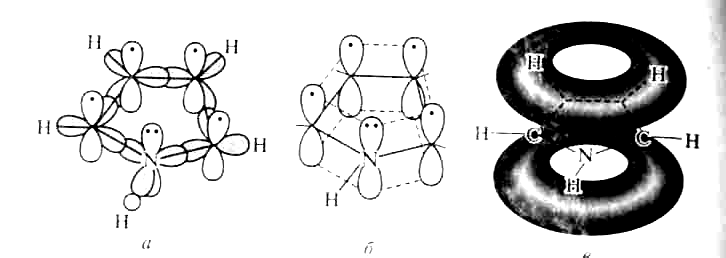
Рисунок 2 – Строение молекулы пиррола
Таким образом, пиррол, как и бензол, и пиридин, подчиняется правилу ароматичности Хюккеля для п = 1.
Рассчитанное π-электронное распределение в молекуле пиррола показывает, что рассматриваемая система электроноизбыточна (шесть электронов перераспределены между пятью атомами кольца) и четыре атома углерода обладают большей π-электронной плотностью, чем атомы углерода бензола, хотя наибольшая электронная плотность сосредоточена на азоте.
Физические свойства. Пиррол легко растворяется в большинстве органических растворителей; на воздухе темнеет и постепенно осмоляется. При действии на пиррол минеральных кислот образуется полимерная масса темного цвета, не имеющая практического применения. Такая неустойчивость пиррола в сильнокислой среде называется ацидофобностью (что означает «кислотобоязнь»). Эту особенность следует учитывать при экспериментальной работе с пирролом.
|
Свойства пиррола |
Показатели |
|
агрегатное состояние |
жидкость |
|
температура плавления |
– 18 оС |
|
температура кипения |
130 оС |
|
растворимость в воде |
слабо растворим |
|
растворимость в спирте и эфире |
легко растворим |
|
запах |
хлороформа |
|
цвет |
бесцветный |
Прототропная таутомерия пиролла – изомеризация, сопровождаю-щаяся миграцией протонизированного атома водорода от одного атома молекулы к другому (нуклеофильному) атому молекулы с одновременным перемещением кратной связи:
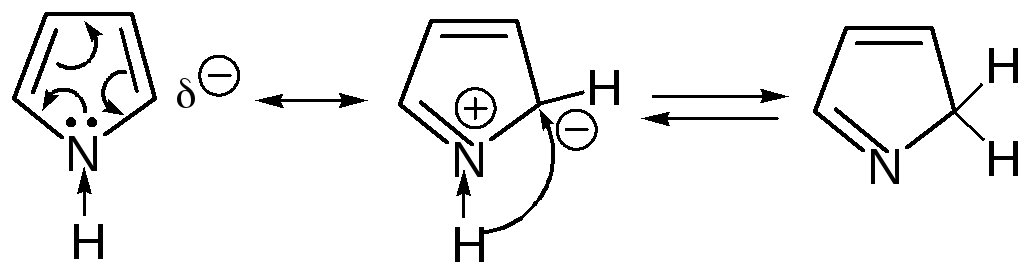
Основные способы получения
