
- •8.2 Алкены
- •3. Дегалогенирование вициальных дигалогеналканов:
- •5. Восстановление алкадиенов и алкинов:
- •7.2.4 Реакция Хека:
- •8. Реакции окисления.
- •10.1 Катионная полимеризация:
- •10.2 Анионная полимеризация:
- •10.3 Радикальная полимеризация:
- •8.3 Алкадиены
- •2. Получение алкадиенов-1,2 (аллены)
- •2.2.1 Присоединение галогенводорода:
- •2.2.2 Присоединение галогена:
- •2.2.3 Присоединение воды:
- •8.3.1 Каучук
- •8.3.2 Природные изопреноиды. Терпены
- •8.4 Алкины
- •4. Реакции отщепления.
- •1. Реакции присоединения.
- •1.1 Реакции электрофильного присоединения.
- •1.1.3 Гидрогалогенирование:
- •1.2 Реакции нуклеофильного присоединения:
- •2. Реакции окисления.
8.3 Алкадиены
Алкадиены – углеводороды с открытой цепью углеродных атомов, содержащих две двойные связи. Общая формула СnH2n-2.
В зависимости от взаимного расположения двойных связей различают три типа алкадиенов:
кумулированные, двойные связи располагаются у одного углеродного атома – аллены;
сопряженные, двойные связи разделены одной σ-связью;
изолированные, двойные связи разделены несколькими σ-связями.
Аллены очень неустойчивы и легко изомеризуются в ацетиленовые углеводороды. Изолированные диены являются типичными непредельными углеводородами и проявляют все свойства алкенов. Наибольший теоретический и практический интерес представляют сопряженные алкадиены.
Номенклатура алкадиенов. Простейшим соединением ряда алкадиенов является пропадиен С3Н4.
Для названия алкенов используют следующие номенклатуры:
тривиальную;
систематическую.
Тривиальная. Как и в ряду других углеводородов, для первых членов гомологического ряда широко используются тривиальные названия: аллен, дивинил СН2=СН–СН=СН2, изопрен СН2=С(СН3)–СН=СН2.
Систематическая (заместительная, международная, ИЮПАК). Систематическое название строят, принимая за главную цепь самую длинную углеродную цепь, содержащую двойные связи, которые обозначают суффиксом -диен. Нумерация цепи начинается со стороны, к которой ближе расположена двойная связь.
Изомерия. Для алкадиенов характерны следующие виды изомерии:
Структурная:
скелетная
изомерия взаимного положения
метамерия.
Пространственная:
геометрическая.
оптическая (аллены)
Способы получения.
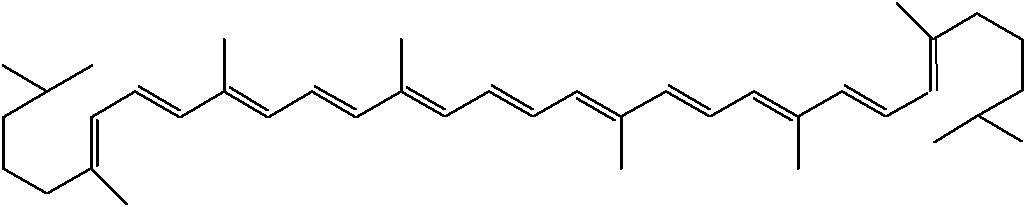
1. Из природных веществ. Соединения с сопряженными связями вследствие большой стабильности чаще встречаются среди природных веществ и содержатся в различных растениях. Например, полиены образуют большую группу терпеновых углеводородов (С5Н8)m, входящих в состав эфирных масел:
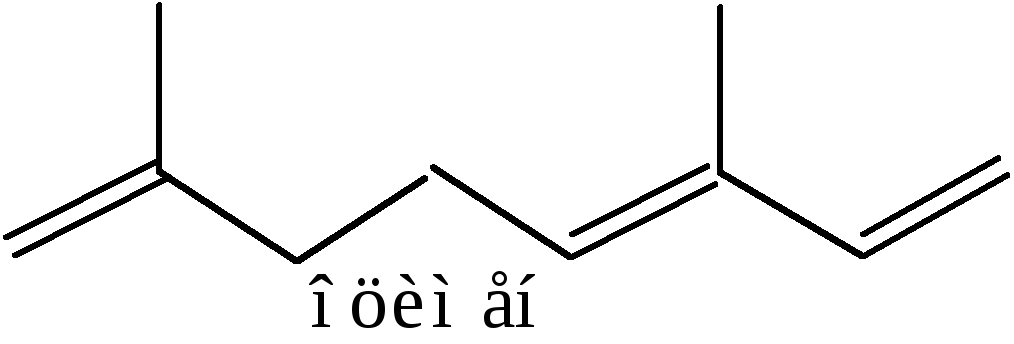
С опряженные
системы двойных связей содержат красящие
вещества помидора и моркови. Желтый
цвет моркови обусловлен присутствием
полиенаβ–каротина
С40Н56:
опряженные
системы двойных связей содержат красящие
вещества помидора и моркови. Желтый
цвет моркови обусловлен присутствием
полиенаβ–каротина
С40Н56:
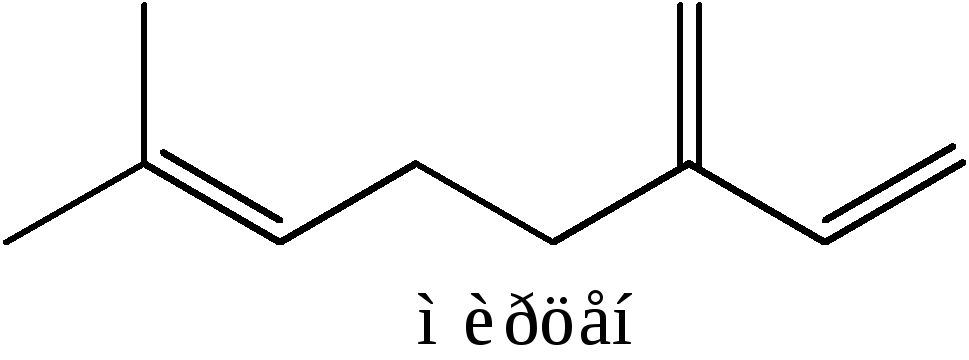
Помидору придает красный цвет полиен ликопин С40Н56:
Реакции получения непредельных углеводородов в большинстве случаев основываются на реакциях отщепления или распада алканов или их производных.
2. Получение алкадиенов-1,2 (аллены)
2.1 Отщепление галогена из дигалогеналкенов:
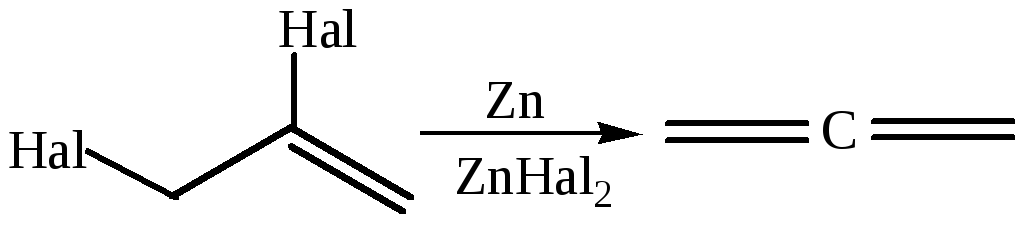
2.2 Изомеризация ацетиленовых углеводородов:
![]()
3. Получение алкадиенов-1,3 (сопряженные).
3.1 Пиролиз нефти:
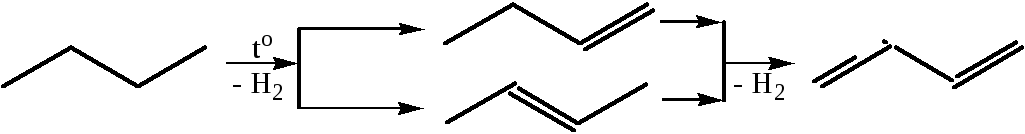
3.2 Дегидрирование алканов и алкенов:
3.3 Дегидратация гликолей и оксаланов (синтез В.Реппе):
![]()
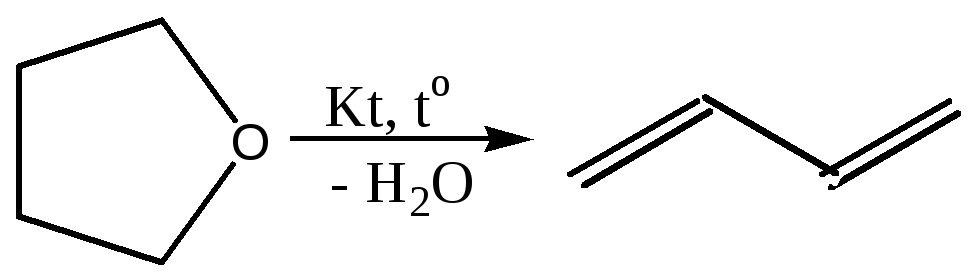
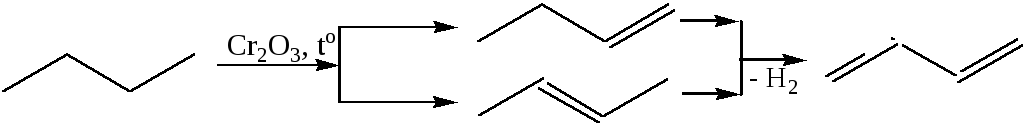
3.4 Каталитическое превращение этилового спирта (синтез С.В. Лебедева, 1927 г., осуществляеся на смешанном катализаторе (ZnO, MgO):
![]()
3.5 Метод Принса:
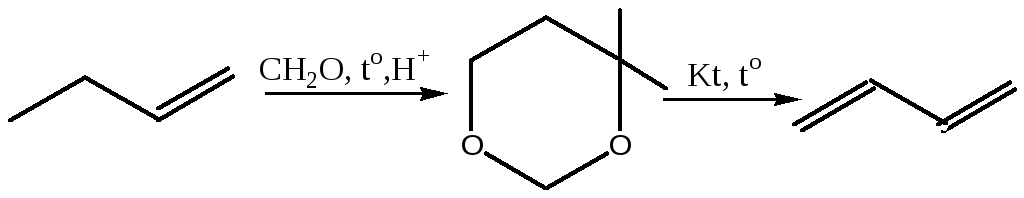
3.6 Метод А.Е.Фаворского:
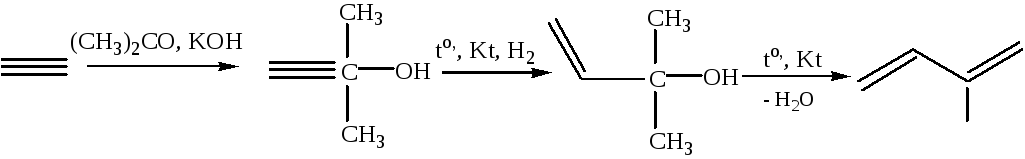
Физические свойства и строение алкадиенов. Аллены представляют собой бесцветные газы (С3, С4) или бесцветные жидкости со слабым запахом. Четыре атома водорода молекулы аллена находятся в двух взаимно перпендикулярных плоскостях:
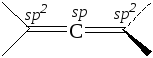
Углеродные атомы в молекуле аллена находятся в различных состояниях гибридизации – sp2, sp, sp2. Благодаря строению двузамещенных алленов для них возможна стереоизомерия, например:
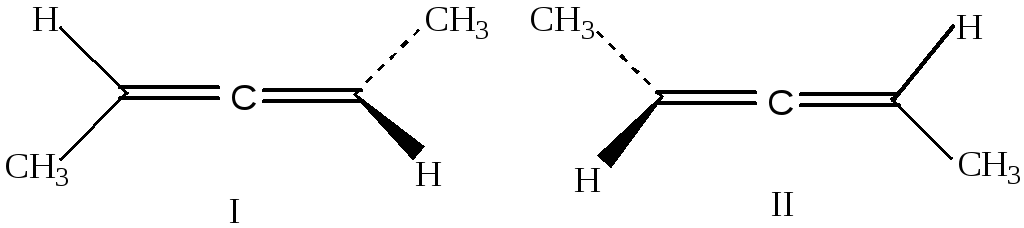
Структура I является зеркальным изображением структуры II. Эти молекулы хиральны.
Алкадиены-1,3 представляют собой бесцветные вещества. Первые члены гомологического ряда являются газами или низкокипящими жидкостями (табл. 22).
Таблица 22 – Физические свойства некоторых алкадиенов
|
Соединение |
|
Формула |
Т, °С |
Плотность,
| |
|
пл. |
кип. | ||||
|
бутандиен-1,3 |
54 |
СН2=СНСН=СН2 |
–108,4 |
–4,5 |
0,6206 |
|
2-метилбутандиен-1,3 |
68 |
СН2=С(СН3)СН=СН2 |
–136 |
34,1 |
0,6810 |
|
2,2-диметилбутандиен-1,3 |
82 |
СН2=С(СН3)2СН=СН2 |
–76 |
68,6 |
0,7262 |
Для алкадиенов-1,3 характерна повышенная молекулярная рефракция. Экзальтация рефракции связана с увеличением поляризуемости электронной системы, что характерно для сопряженных систем двойных связей.
При сравнении экспериментальных значений теплоты образования с полученной суммированием термохимических энергий связей для молекул алкадиенов-1,3 экспериментальная величина получается больше на 13. . .16 кДж/моль. Т. е. при образовании сопряженной системы выделяется больше энергии, чем при образовании несопряженной системы и, следовательно, сопряженные системы являются более стабильными. Эта энергия называется энергией сопряжения (делокализации, резонанса).
Молекула бутадиена планарная, наиболее вероятным расположением двойных связей является транс-расположение по отношению к ординарной связи. Длины С–С-связей отличаются от таковых в этилене (0,133 нм) и этане (0,154 нм).
![]()
Сопряженные алкадиены обнаруживают ряд заметных отличий в параметрах молекулы, строении и свойствах в сравнении с алкадиенами двух других классов и классическими алкенами.
Химические свойства.
1. Аллены активны в различных химических реакциях, главным образом в реакциях присоединения и полимеризации. Центром электрофильной атаки являются «боковые» углеводные атомы. Ниже приведена схема превращений аллена:
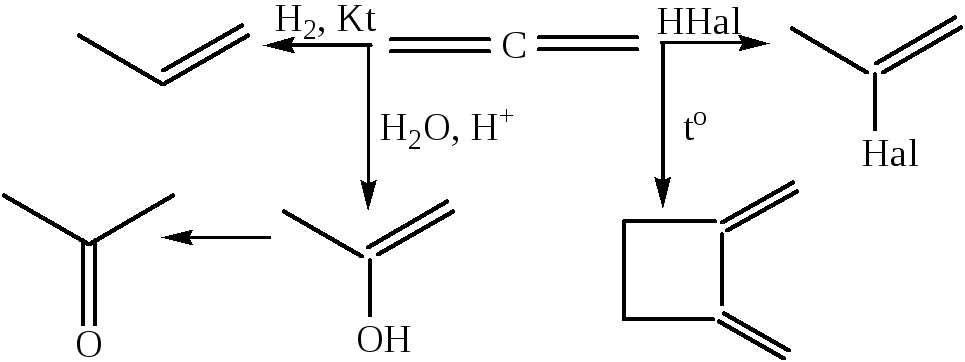
2. Алкадиены-1,3, присоединение происходит в двух направлениях: 1,2- и 1,4-присоединение, соотношение определяется температурой реакции, полярностью растворителя, характером реагента.
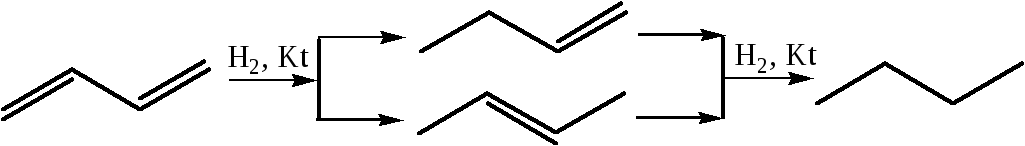
2.1 Гидрирование:
2.2 Присоединение электрофильных реагентов:
