- •1.Предмет и задачи патофизиологии. Роль патофизиологии в системе медицинских знаний.
- •3.Основные этапы развития патофизиологии. Ведущая роль ученых в ее становлении и развитии.(херня)
- •5.Понятие о патогенезе. Причинно-следственные отношения в патогенезе.
- •6.Ведущие звенья в патогенезе, «порочные круги». Патогенетическая терапия.(есть выше) 7.Виды реактивности. Структура индивидуальной реактивности.
- •10.Роль конституции в реактивности организма.
- •11.Основные принципы классификации конституциональных типов.
- •12.Приобретенная реактивность: биологические и социальные факторы, влияющие на ее формирование.
- •13.Механизмы формирования приобретенной реактивности.
- •14.Роль исходного функционального состояния в реактивности организма. 15.Роль нервной системы в механизмах реактивности организма.
- •16.Роль эндокринной системы и обмена веществ в механизмах реактивности организма.
- •17.Роль иммунологических механизмов в реактивности организма.
- •18.Понятие о наследственности. Методы изучения наследственных болезней.
- •19.Классификация наследственных болезней: а) по соотносительной роли наследственности и окружающей среды; б) в зависимости от уровня поражения аппарата наследственности.
- •20.Врожденные болезни. Фенокопирование и ее причины.
- •21.Этиология наследственных болезней. Мутации и их причины.
- •22.Закономерности передачи по наследству доминантных признаков.
- •23.Закономерности передачи по наследству рецессивных признаков.
- •24.Закономерности передачи по наследству сцепленных с полом заболеваний.
- •25.Общий патогенез наследственных заболеваний молекулярного уровня.
- •28.Хромосомные болезни и механизмы их развития.
- •29.Изоляты, имбридинг и их роль в патологии наследственности.
- •30.Принципы профилактики и возможные методы лечения наследственной болезни.
- •Патогенное действие низкой температуры на организм. Характеристика форм и стадий переохлаждения.
- •Патогенное действие электрического тока на организм. Факторы, определяющие исход электротравмы. Причины смерти при электротравме.
- •Понятие о радиорезистентности и радиопоражаемости ткани. Механизмы действия ионизирующей радиации на системном и организменном уровнях.
- •Формы лучевой болезни.
- •Патогенез острой (гемической) формы лучевой болезни.
- •Отдаленные эффекты ионизирующей радиации.
- •Этиология боли.
- •Патогенез острой боли.
- •Патогенез хронической боли.
- •Изменение в организме при боли. Общие принципы лечения боли.
- •Общие феномены нарушения микроциркуляции.
- •Артериальная гиперемия. Виды, особенности микроциркуляции.
- •Венозная гиперемия. Причины возникновения, механизмы развития.
- •Ишемия. Причины возникновения, классификация. Механизмы развития и проявления.
- •Общие клинические проявления ишемии. Их генез.
- •Особенности нарушений микроциркуляции при ишемии. Исходы ишемии.
- •Тромбоз и эмболия. Причины, механизмы развития, исходы.
- •Понятие о воспалении. Этиология воспаления.
- •Классификация воспаления (по этиологии, длительности, характеру экссудата, превалированию процессов в очаге воспаления).
- •По превалированию процессов
- •Морфологические признаки воспаления. Их генез.
- •Общие клинические признаки воспаления. Их генез.
- •Первичная и вторичная альтерация, механизмы развития.
- •Медиаторы воспаления, их общие биологические эффекты.
- •Экссудация и ее механизмы.
- •Эмиграция лейкоцитов в очаге воспаления и ее механизмы. Роль фагоцитоза в патогенезе воспаления.
- •Нарушение микроциркуляции и гемореологии в очаге воспаления.
- •Пролиферация в очаге воспаления и ее механизмы.
- •Исходы воспаления
- •Условия, необходимые для развития гнойного воспаления. Состав гноя.
- •Условия, необходимые для развития хронического воспалиня.
- •Общие реакции при воспалении.
- •Биологическое значение воспаления.
- •Общие принципы патогенетической терапии воспаления и их обоснование.
- •Определение понятия «Лихорадка». Этиология лихорадки.
- •Пирогены. Их виды и механизмы действия.
- •Особенности теплообмена на разных стадиях лихорадки.
- •Механизмы повышения температуры тела при лихорадке.
- •Механизмы дрожи при лихорадке.
- •Механизмы жара при лихорадке.
- •Механизмы потоотделения при лихорадке.
- •Основные отличия механизмов развития лихорадки и эндогенного перегревания.
- •Изменения обмена веществ и физиологических функций при лихорадке.
- •Патофизиологические принципы жаропонижающей терапии. Понятие пиротерапии.
- •Нарушение энергетического обмена. Причины, механизмы развития, последствия.
- •Нарушение расщепления и всасывания углеводов. Причины, механизмы развития, последствия.
- •Нарушение межуточного обмена углеводов. Причины, механизмы развития, последствия.
- •Этиология и патогенез гипергликемии.
- •Этиология и патогенез гипогликемии.
- •Нарушение расщепления и всасывания белков. Причины, механизмы развития, последствия.
- •Расстройства межуточного обмена белков. Нарушение синтеза и катаболизма белков, нарушение превращения аминокислот.
- •Нарушение конечных этапов метаболизма белков. Расстройства связывания и выделения токсических продуктов азотистого обмена.
- •Основные проявления нарушения азотистого баланса, их механизмы.
- •Нарушение расщепления и всасывания жиров. Причины, механизмы развития, последствия.
- •Общее ожирение и его механизмы.
- •Повышение мобилизации жира из депо, ожирение печени, нарушение превращения жирных кислот.
- •Роль свободно-радикального окисления липидов в патологии.
- •Нарушение обмена холестерина. Гиперхолестеринемия. Роль нарушений липидного обмена в патогенезе атеросклероза.
- •Ацизод. Виды, причины, механизмы развития, компенсаторные реакции в организме, последствия для организма.
- •Нарушение электролитного обмена.
- •Определение понятия «Гипоксия». Гипоксия как патогенетический фактор различных заболеваний.
- •Стресс. Этиология, стадии, общий патогенез стресса.
- •Понятие об опухолях. Этиология опухолей.
- •Роль нарушения реактивности организма в возникновении и развитии опухолей (значение наследственных факторов, изменения со стороны нервной, эндокринной и иммунной систем).
- •Инициальные (клеточные) механизмы канцерогенеза.
- •Биологические особенности опухолей.
- •Автономность роста опухолей и ее механизмы.
- •Инвазивность роста опухолей, ее механизмы. Метастазирование, пути, механизмы.
- •Опухолевая прогрессия. Системное действие опухоли на организм (влияние на нервную, эндокринную систему).
- •Понятие об эритроне. Нарушение регуляции эритропоэза. Патологические формы эритропоэза.
- •Эритроцитозы и эритремия. Этиология, виды и механизмы развития.
- •Анемии. Определение, патологическая классификация.
- •Острая постгеморрагическая анемия. Этиология, патогенез, картина крови.
- •Железодефицитные анемии. Этиология, патогенез, картина крови.
- •Анемия при недостатке витамина в12 и фолиевой кислоты. Этиология, патогенез, картина крови.
- •Приобретенные гемолитические анемии. Этиология, патогенез, картина крови.
- •Врожденные гемолитические анемии. Этиология, патогенез, картина крови.(выше есть ответ)
- •Гипо- и апластические анемии. Этиология, патогенез, картина крови.
- •Нарушение физиологических функций и компенсаторно-приспособительные реакции при анемиях.
- •Лейкоцитарная формула и ее нарушения в условиях патологии.
- •Лейкоцитозы, его виды. Причины.
- •Фазы лейкоцитарной реакции при инфекционном процессе.
- •Лейкопении. Причины и механизмы развития.
- •Понятие о лейкозе. Классификация и этиология лейкозов.
- •Общий патогенез лейкозов. Общие проявления лейкозов. Механизм их развития.
- •Особенности кроветворения и клеточного состава периферической крови при разных видах лейкозов.
- •Механизмы гемостаза. Классификация расстройств гемостаза.
- •Ангиопатии. Виды, этиология, патогенез.
- •Тромбоцитопатии. Виды, этиология, патогенез.
- •Коагулопатии. Виды, этиология, патогенез.
- •Тромбофилический диатез. Причины, проявления.
- •Фибринолитическая система. Нарушения фибринолиза.
- •Диссеминированное внутрисосудистое свертывание крови (тромбогеморрагический синдром). Этиология, патогенез.
- •Изменение общего объема крови: гипер- и гиповолемия. Этиология, патогенез.
- •Острая кровопотеря и постгеморрагический синдром. Ведущие звенья патогенеза.
- •Защитно-приспособительные и компенсаторные реакции при кровопотере.
- •Принципы патогенетической терапии кровопотери.
- •Сердечные аритмии. Их виды, этиология.
- •Аритмии вследствие расстройств автоматизма сердца. Виды, механизмы развития.
- •Аритмии вследствие сочетанных расстройств возбудимости и проводимости. Виды, общий патогенез.
- •Экстрасистолия и пароксизмальная тахикардия. Виды, механизмы развития.
- •Трепетание предсердий. Этиология, механизм развития. Изменения экг.
- •Фибрилляция предсердий и желудочков. Механизм развития. Последствия для организма. Изменения экг.
- •Блокада проводимости сердца. Виды, механизмы развития.
- •Нарушения сократимости сердца. Проявления, механизмы развития.
- •Недостаточность кровообращения. Ее формы, проявления.
- •Сердечная недостаточность. Этиология, механизмы развития, основные проявления.
- •Механизмы компенсации сердечной недостаточности.
- •Гипертрофия миокарда. Механизмы развития. Недостаточность гипертрофированного сердца.
- •Нарушения коронарного кровообращения. Этиология и патогенез инфаркта миокарда. Экспериментальное воспроизведение.
- •Недостаточность сердца при патологии перикарда. Механизмы развития, проявления.
- •Артериальные гипертензии. Патогенетическая классификация гипертензивных состояний.
- •Гемодинамические показатели и формы артериальной гипертензии.
- •Роль нарушений нервной регуляции в патогенезе артериальной гипертензии.
- •Роль нарушений эндокринной системы в патогенезе артериальной гипертензии.
- •Роль почечных прессорных и депрессорных механизмов в патогенезе артериальной гипертензии.
- •Роль изменения состояния сосудистой стенки в патогенезе артериальной гипертензии.
- •Роль ренин-ангиотензин-альдостероновой системы в патогенезе артериальной гипертензии.
- •Экспериментальное воспроизведение артериальной гипертензии.
- •Принципы лечения гипертензии.
- •Артериальная гипотензия (острая и хроническая). Этиология, патогенез.
- •Понятие о дыхательной недостаточности. Формы и этиологические факторы дыхательной недостаточности.
- •Показатели дыхательной недостаточности.
- •Патологические формы дыхания и их механизмы: одышка, периодическое и терминальное дыхание.
- •Расстройства альвеолярной вентиляции. Обструктивный и рестриктивный типы нарушения вентиляции. Нарушения альвеолярно-капиллярной диффузии.
- •Нарушение перфузии легких. Неравномерность вентиляционно-перфузионных отношений. Недостаточность легочной перфузии. Отек легких.
- •Недостаточность пищеварительных систем. Понятие, этиология, основные механизмы, проявления.
- •Расстройства пищеварения в ротовой полости.
- •Нарушение пищеварения в 12-перстной кишке и тонком кишечнике.
- •Нарушение внешнесекреторной функции поджелудочной железы.
- •Понятие о печеночной недостаточности. Этиология, общие проявления.
- •Нарушения обмена веществ при печеночно-клеточной недостаточности.
- •Нарушения белкового обмена при печеночно-клеточной недостаточности.
- •Нарушения углеводного обмена при печеночно-клеточной недостаточности.
- •Нарушения жирового обмена при печеночно-клеточной недостаточности.
- •Нарушения барьерной и детоксикационной функции печени.
- •Нарушение портального кровообращения (синдром портальной гипертензии).
- •Печеночная кома. Основные механизмы развития.
- •Надпеченочная желтуха. Этиология, патогенез расстройств билирубинового обмена.
- •Печеночная желтуха. Этиология, патогенез расстройств билирубинового обмена.
- •Подпеченочная желтуха. Этиология, патогенез расстройств билирубинового обмена.
- •Экстраренальные и ренальные причины нарушения функции почек.
- •Расстройства клубочковой фильтрации в почках.
- •Расстройства канальцевой реабсорбции, секреции и экскреции в почках.
- •Основные нарушения функции почек и их проявления.
- •Изменения диуреза и состава мочи при патологии почек.
- •Ренальные проявления патологии почек.
- •Экстраренальные проявления патологии почек.
- •Этиология и патогенез нефротического синдрома. Механизмы формирования основных проявлений нефротического синдрома.
- •Этиология и патогенез остронефритического синдрома. Механизмы формирования основных проявлений остронефритического синдрома.
- •Этиология и патогенез острой почечной недостаточности (опн). Механизмы формирования основных проявлений опн.
- •Этиология и патогенез хронической почечной недостаточности (хпн). Механизмы формирования основных проявлений хпн.
- •Характеристика нейро-гуморального регуляторного механизма как функциональной системы и его нарушения при эндокринной и неэндокринной патологии.
- •Нарушения гипоталамо-гипофизарной регуляции функции желез внутренней секреции. Повреждение механизма саморегуляции в нейроэндокринной системе.
- •Транс- и парагипофизарные механизмы регуляторных расстройств.
- •Первичные нарушения синтеза гормонов в периферических эндокринных железах. Генетически обусловленные дефекты биосинтеза гормонов.
- •Периферические (внежелезистые) формы эндокринных расстройств нарушения связывания, утилизации и метаболизма гормонов. Изменение реактивных свойств гормональных рецепторов.
- •Патология гипоталамо-аденогипофизарной системы. Парциальная и тотальная гипо- и гиперфункция передней доли гипофиза.
- •Патология гипоталамо-нейрогипофизарной системы.
- •Патология коры надпочечников. Парциальная и тотальная гиперфункция.
- •Гиперкортизолизм. Этиология, патогенез, основные проявления.
- •Альдостеронизм. Этиология, патогенез, основные проявления.
- •Острая и хроническая недостаточность коры надпочечников. Этиология, патогенез, основные проявления.
- •Гипертиреоз. Этиология, патогенез, основные проявления.
- •Патология околощитовидных желез: гипер- и гипопаратиреоз. Этиология, патогенез, основные проявления.
- •Патология половых желез: гипо- и гипергонадизм у женщин. Этиология, патогенез, основные проявления.
- •Патология половых желез: гипо- и гипергонадизм у мужчин. Этиология, патогенез, основные проявления.
- •Этиология и патогенез сахарного диабета.
- •Нарушения обмена веществ при сахарном диабете. Патогенез диабетической комы.
- •Возможные проявления при сахарном диабете, связанные с нарушениями углеводного обмена.
- •Возможные проявления при сахарном диабете, связанные с нарушениями белкового обмена.
- •Возможные проявления при сахарном диабете, связанные с нарушениями липидного обмена.
- •Механизм формирования атеросклероза при сахарном диабете.
- •Механизмы формирования ангиопатий при сахарном диабете.
- •Возможные осложнения сахарного диабета.
Алкалоз. Виды, причины, механизмы развития, компенсаторные реакции в организме, последствия для организма.
Нарушение электролитного обмена.
- Гипонатриемия — снижение концентрации натрия в крови до 135 ммоль/л и ниже, - Гиперкальциемия (содержание кальция в крови выше 2,63 ммоль/л). - Гипокалиемия — уменьшение концентрации калия в крови ниже 3,5 ммоль/л. - Гиперкалиемия — увеличение концентрации калия выше 5,5 ммоль/л. - Гипомагниемия — снижение уровня магния ниже 0,5 ммоль/л.
Основными причинами нарушений водно-электролитного баланса являются внешние потери жидкостей и патологические перераспределения их между главными жидкостными средами.
Основными причинами гипокальциемии являются: — травма паращитовидных желез; — терапия радиоактивным йодом; — удаление паращитовидных желез; — псевдогипопаратиреоз.
Наиболее частая причина гиперкальциемии — первичный или вторичный гиперпаратиреоз. К основным причинам гипонатриемии относят: — тяжелые изнуряющие болезни, сопровождающиеся снижением диуреза; — посттравматические и послеоперационные состояния; — внепочечные потери натрия; — избыточное поступление воды в антидиуретическую фазу посттравматического или послеоперационного состояния; — бесконтрольное применение диуретиков.
Причинами гипокалиемии являются: — смещение калия в клетки; — превышение потерь калия над его поступлением сопровождается гипокалийгистией; — сочетание указанных выше факторов; — алкалоз (респираторный, метаболический); — альдостеронизм; — периодический гипокалиемический паралич; — применение кортикостероидов.
Основными причинами гиперкалиемии являются: — выход калия из клетки вследствие ее повреждения; — задержка калия в организме, чаще всего из¬за избыточного поступления катитона в организм пациента. Причинами гипомагниемии может быть: — хронический алкоголизм; — поражение печени; — резекция тонкой кишки; — диарея, наличие свищей; — гипопаратиреоз; — введение инсулина.
Основные механизмы формирования отеков.
Голодание и его причины. Социальные причины голода. Изменение обмена веществ и физиологических функций при голодании.
Определение понятия «Гипоксия». Гипоксия как патогенетический фактор различных заболеваний.
Гипоксия, или кислородное голодание, – типовой патологический процесс, возникающий в результате снижения содержания или использования О2 в тканях, а также чрезмерной нагрузки.
Патогенез коллапса: фактор патогенности вазодилатация падение АД, уменьшение ОЦК уменьшение венозного возврата и УО уменьшение МОК гипоксия повышение сосудистой проницаемости прогрессирующее падение АД коллапс.
Патогенез шока (н/р травматический): вазоконстрикция снижение кровотока, нарушение микроциркуляции гипоксия ацидоз повреждение мембран клеток выход жидкости в интерстиций сладж, уменьшение ОЦК ВСД образование микроэмболов.
Патогенез воспаления: гипоксия активация эндотелия выработка селектинов, компонентов комплемента, тканевого тромбопластина, сокращение ЭЦ отложение фибрина, повышение проницаемости сосудов ишемия, интерстициальный отек, неоангиогенез.
Этиология, виды гипоксии.
. Классификация гипоксии, этиология, патогенез гипоксии.
Этиопатогенетическая классификация:
аноксическая – возникает вследствие недостаточной оксигенации Нb из-за снижения рО2 во вдыхаемом воздухе, альвеолярном воздухе и артериальной крови);
анемическая – возникает в результате уменьшения количества Нb либо его способности переносить О2;
циркуляторная – возникает вследствие нарушения циркуляции крови по сосудам.
Этиопатогенетическая классификация:
1. Гипоксическая (дыхательная) гипоксия.
при затруднении проникновения кислорода в кровь через дыхательные пути и при расстройствах дыхания.
2. Гемическая (кровяная) гипоксия.
количественные (анемии) и качественные (карбоксигемоглобин, метгемоглобин) изменениями гемоглобина.
3. Циркуляторная гипоксия.
общие (сердечная и сосудистая недостаточность, цирроз печени) и местные (ишемия, венозная гиперемия) расстройствами кровообращения.
4. Тканевая (гистотоксическая) гипоксия.
неспособность клеток утилизировать кислород в результате ферментопатий (отравление) или поражением мембран клеток (гипероксическая гипоксия).
5. Смешанная гипоксия.
сочетание двух и более типов гипоксии (например, при шоке, кровопотере, коме)
Общий патогенез:
1) расстройства функций дыхательной, сердечно-сосудистой систем, системы крови расстройства доставки О2 к тканям нарушения поддержания оптимального газового состава и рН (2)
2) дефицит субстратов окисления/угнетение или разобщение процессов окисления и фосфорилирования/чрезмерная активация процессов анаэробного гликолиза недостаточность процессов биологического окисления О2 клеточные расстройства энергетического и пластического обменов накопление продуктов неполного окисления ацидоз протеолиз повреждением лизосом аутолиз клеток.
3) дефицит О2 снижение ресинтеза макроэргов дефицит этих соединений в клетках недостаток энергообеспечения уменьшается окислительное фосфорилирование и свободное окисление ( уменьшаются основной обмен, теплопродукция) активация анаэробных процессов накапливаются недоокисленные метаболиты.
4) дефицит макроэргов активизируется генетический аппарат увеличивается активность клеток повышается биогенез митохондрий устранение дефицита АТФ уменьшение интенсивности функционирования структур ликвидации нарушений жизнедеятельности адаптация к недостатку О2.
* чем выше обменные процессы в тканях и органах, тем ниже их устойчивость к кислородному голоданию. Важную роль в обеспечении устойчивости играет мощность гликолитической системы.
3. Этиология, патогенез, изменение содержания кислорода в артериальной крови при гипоксической гипоксии.
Причина: снижение рО2 во вдыхаемом воздухе (горная болезнь (при гипобарии), высотная болезнь, дыхание газовыми смесями с недостаточным pО2, дыхание в замкнутых помещениях).
Патогенез: снижение рО2 во вдыхаемом воздухе приводит к уменьшению рО2 в альвеолах, артериальной крови уменьшение содержания в крови связанного с гемоглобином и растворенного в плазме О2 увеличение возбудимости дыхательного центра развитие гипервентиляции уменьшение рСО2 в артериальной крови и тканях (развивается алкалоз) уменьшение диссоциации оксигемоглобина (повышение сродства кислорода и Hb) компенсаторное увеличение экскреции бикарбонатов затем Na+ и воды почками расстройства КОС и снижение ОЦК падение тонуса сердечно-сосудистого и дыхательного центров ослаблению кровообращения в мозге, сердце и других органах гипоксия с ростом лактата.
Изменение содержания кислорода:
кислородная емкость нормальная или даже повышена.
содержание кислорода, кислородное насыщение, напряжение кислорода в артериальной крови снижены.
насыщение кислородом венозной крови обычно снижено
артериовенозная разница по кислороду остается нормальной или может быть сниженной.
4. Этиология, патогенез, изменение содержания кислорода в артериальной крови при гемической гипоксии.
Причина: уменьшения кислородной емкости крови, обусловленного снижением количества эритроцитов и функционально активного гемоглобина крови.
* является результатом: острой или хронической кровопотери, разрушения эритроцитов крови, деструкция или инактивация гемоглобина, угнетение эритропоэза.
Патогенез:
1) при отравлениях окислителями и восстановителями (нитратами и нитритами) образуется метгемоглобин трехвалентное железо не способно присоединять и переносить к тканям О2.
2) накопление в организме NO, ионов NO2 и NO3.
NO образуется в результате восстановления в крови и тканях NO2 в NO (с участием НАДФ, НАДФН, цитохрома Р-450) увеличивается содержание комплексов HbNO, HbNO2 и HbNO3.
накопление NO, NO2 и NO3 (CРВ) сопровождается: повреждением белков, ЖК; ферментопатиям, разобщением окислительного фосфорилирования; уменьшением количества тканевых и кровяных макрофагов; нарушением целостности клеточных мембран и органелл, а также окислением гемоглобина.
3) Накопление других веществ
при избытке СО2 во вдыхаемом воздухе или крови образуется довольно прочное соединение – карбогемоглобин.
наследственно обусловленные дефекты строения гемоглобина (образование НbS)
Изменение содержания кислорода:
снижение кислородной емкости крови (гипоксемия),
снижение содержания кислорода в артериальной и венозной крови, напряжения кислорода в венозной крови.
артериовенозная разница по кислороду обычно в пределах нормы или повышена.
5. Этиология, патогенез, изменение содержания кислорода в артериальной крови тканевой гипоксии.
Причина: снижение способности клеток утилизировать кислород в результате нарушения биологического окисления.
Патогенез:
1) отравление цианидами, недостатке рибофлавина, лучевой болезни, ацидозе блок цитохромоксидазной системы нарушение переноса электронов на кислород блокируется тканевое дыхание, окислительное фосфорилирование и энергообразование уменьшается образование макроэргов, активизируется анаэробный гликолиз накопление метаболитов и свободных радикалов закисление среды активизация фосфолипаз повреждение мембран клеток и органелл.
2) при токсическом действии повышенного давления кислорода повреждение биологических мембран (например, МТХ) нарушение их свойств в поддержании гомеостаза изменению их проницаемости разобщение дыхания и окислительного фосфорилирования, дефицит макроэргических соединений расстройства обмена.
* функциональные расстройства нарастают при угнетении антиоксидантных систем (СОД, каталазы, пероксидазы, глутатионовой системы и др.)
Изменение содержания кислорода:
повышается содержание кислорода, напряжение и насыщение гемоглобина кислородом венозной крови.
снижается артериовенозная разница и парциальное давления кислорода.
6. Этиология, патогенез, изменение содержания кислорода в артериальной крови циркуляторной гипоксии.
Причина: при абсолютной и при относительной недостаточности кровоснабжения органов как большого, так и малого круга (расстройств деятельности сердца, кровеносных сосудов, лимфатических сосудов, уменьшения ОЦК).
Патогенез: ишемия, ВГ, стаз (нормальное насыщение крови O2) замедление кровотока в сосудах МКЦ русла кровь дольше контактирует с клетками отдает мало кислорода относительно метаболической активности клеток.
Изменение содержания кислорода:
снижено содержание кислорода в венозной крови
повышена артерио-венозная разница по содержанию и парциальному давлению кислорода.
7. Этиология гипоксии при разобщении дыхания и окислительного фосфорилирования. Последствия для клетки.
Гиперметаболические гипоксии или гипоксии нагрузки.
Причины: при неадекватности доставки кислорода тканям организма при резко возросшем потреблении его последними.
Патогенез:
1) Латентная степень: усиленно работающие ткани потребляют из притекающей к ним крови большое количество кислорода, что сопровождается временным снижением насыщения кислородом венозной крови (венозная гипоксемия)
2) Компенсированная степень: в результате активизации компенсаторно-приспособительных реакций и механизмов в организме отмечают усиление доставки кислорода к тканям, соответствующее их кислородным запросам ослабление венозной гипоксемии и тканевой гипоксии поддержание достаточного рО2, но превышающего критический его уровень (высокая скорость его доставки)
* к-п реакции: увеличение ДО, МОД, МОК, централизация кровотока, увеличение УО, ЧСС.
3) Субкомпенсированная степень: ослабляются компенсаторные механизмы нарушается кровоток в легких (усиливается активность шунтирования крови) развивается артериальная гипоксемия при дальнейшем увеличении мышечной нагрузки скорость поэтапной доставки кислорода снижается, потребность организма в кислороде растет активизация анаэробного гликолиза накапливаются недоокисленные метаболиты гипоксия нарастает, увеличивается дефицит макроэргов.
4) Декомпенсированная степень: ДО, МОД, УО, МОК уменьшаются, количество дыхательных движений и ЧСС увеличивается кислород расходуется неэффективно и неэкономично растет кислородный долг усиления тканевой гипоксии повреждаются, погибают органеллы и клетки неспособность организма к восстановлению без оказания помощи – смерть.
Оксигенация крови при различных видах гипоксии.
Нарушение обмена веществ и физиологических функций при гипоксии.
Патогенез: функциональные изменения нейронов (гипертрофия митохондрий, ЭПС, сдвиг рН в кислую сторону, фрагментация клетки) высокая чувствительность, малая устойчивость (особенно центральных ее отделов) ослабление процессов торможения развитие эйфории снижение самокритики (оценка состояния)/двигательное возбуждение расстройства координации и активности мышечных сокращений вплоть до развития судорог нарушения и потери сознания.
Расстройства функций эндокринной системы возникают:
Патогенез: изменение скорости и степени нарушений кровообращения расстройства различных звеньев внежелезистого отдела (гормон-рецепторного взаимодействия) железистого отдела (расстройства синтеза гормонов) центрального отдела эндокринных комплексов.
Расстройства функций иммунной системы обусловлены:
Патогенез: стресс-фактор вызывает увеличение продукции АКТГ увеличение секреции кортизола снижает количество эозинофилопения и лимфоцитопения атрофия лимфоидной ткани уменьшение выброса Т-клеток и антител снижается иммунитет.
* кортизол повышает продуцирование красных клеток крови
Расстройства функций системы кровообращения обусловлены:
Патогенез: нарушения функционирования сердца (нарушений возбудимости, автоматизма, проводимости и сократимости сердца), тонуса сосудов (торможение СДЦ), реологических свойств крови усиление расстройства кровообращения микроциркуляторного русла и снижение способности гемоглобина эритроцитов переносить как О2, так и СО2.
Расстройства функций дыхательной системы обусловлены:
Патогенез: нарушения активности дыхательного центра нарушение внешнего дыхания (вентиляции, диффузии и перфузии) снижение O2 повышения СО2 и недоокисленных метаболитов повышение возбудимости дыхательного центра одышка в результате перевозбуждения происходит снижение лабильности ДЦ дезинтеграция деятельности дыхательных нейронов, нарушение эфферентации к дыхательным мышцам нарастание дыхательной недостаточности остановка дыхания.
Расстройства функций системы пищеварения сопровождаются:
Патогенез: развитие и усиление нарушений моторики, секреции соков, образования ФАВ, всасывания недостаточности системы пищеварения.
Расстройства деятельности метаболических систем и состояния метаболических процессов обусловлены:
Патогенез: нарушение процессов митохондриального окисления, снижение биосинтеза, транспорта, утилизации макроэргов активизация катаболических и торможением анаболических процессов накопление в тканях недоокисленных веществ и дефицит буферных оснований метаболический ацидоз, накопление метаболитов повреждение структур и функций клеток.
Механизмы срочной адаптации к гипоксии.
Экстренные компенсаторно-приспособительные реакции:
Изменения функций дыхательной системы проявляются:
развитием одышки в виде глубокого частого дыхания, сопровождающегося гипервентиляцией.
Изменения функций сердечно-сосудистой системы характеризуются:
тахикардией, увеличением сердечного выброса и минутного объема крови (МОК)
централизацией кровообращения
выбросом крови из органов депо
Изменения состояния системы крови проявляются:
ускорением процесса связывания Hb с О2 крови
активизацией процесса диссоциации HbО2 в капиллярной крови тканей
появлением в крови фетального Hb (способен выполнять дыхательную функцию при относительно низком напряжении О2 в циркулирующей крови)
Мощные компенсаторно-приспособительные реакции:
Изменения функций эндокринной системы проявляются:
повышенный синтез АКТГ, кортизола, тиреотропина (ТТГ)
сниженной секрецией трийодтиронина (Т3) и тироксина (Т4).
* эти сдвиги позволяют тканям организма экономнее использовать кислород, облегчать работу сердца и обеспечивать выполнение значительной физической работы.
Изменения функций иммунной системы характеризуются:
ослабление гуморального и клеточного звеньев иммунитета;
снижением устойчивости организма к бактериальной и паразитарной инфекциям
повышением в крови количества Т-супрессоров, Ig А, Ig G
* гипореактивность можно рассматривать как механизм, отражающий более экономное ее функционирование в условиях недостатка кислорода.
Изменения функций системы крови проявляются:
активизацией кроветворения (главным образом эритропоэза).
* сопровождается увеличением количества эритроцитов в крови, улучшением переноса О2 и снабжения им различных клеточно-тканевых структур организма.
Изменения состояния метаболических систем и процессов направлены на:
сначала активируются процессы анаэробного обмена (анаэробного гликолитического обеспечения жизненных функций), а затем и аэробного обмена.
стимулируется синтез дыхательных ферментов, РНК, ДНК, митохондрий, рибосом, обеспечивающих длительную акклиматизацию организма,
* далее обмен веществ перестраивается, становится более экономным
Изменения состояния систем утилизации кислорода тканями проявляются:
увеличением способности тканевых ферментов утилизировать кислород (активация цитохромоксидаз; увеличение их сродства к кислороду)
повышением эффективности и сопряжения процессов окисления и фосфорилирования, активизацией анаэробного гликолиза.
Механизмы долговременной адаптации к гипоксии.
См выше
Патофизиологические основы профилактики и терапии к гипоксии.
Противогипоксические средства:
1. Улучшающие доставку кислорода к тканям и его утилизацию за счет стимуляции дыхания, кровообращения (аналептики, кардиотонические средства), повышения диссоциации оксигемоглобина (углекислота, молочная кислота), усиление эритропоэза.
2. Вещества, повышающие устойчивость организма к гипоксии за счет снижения потребления кислорода (наркотические, снотворные, транквилизаторы, антиадренэргические средства).
угнетение функции симпато-адреналовой системы уменьшает кислородный запрос тканей и резко повышает устойчивость организма к гипоксии.
3. Средства, способствующие сохранению или образованию макроэргов:
а) вещества с электронно-акцепторными или электронно-донаторными свойствами (цитохром С, НАД, НАДФ, аскорбиновая кислота, глютатион, цистеин, АТФ, АДФ, АМФ);
б) вещества, активирующие ферментные и коферментные системы (кокарбоксилаза, никотинамид, тиамин, аскорбиновая кислота, аминокислоты типа метионина, триптофана, цистеина), вещества, содержащие тиоловые группы (глютатион, унитиол), производные пиримидина (пентоксил, метацил);
в) АТФ или фосфорилированные углеводы (глюкозо-1-фосфат, глюкозо-6-фосфат, фруктозо-1,6-фосфат) способствуют пополнению и сохранению АТФ, которая обычно используется для фосфорилирования глюкозы
4. Средства, нормализующие мембраны клеток, рН, электролитный обмен.
ощелачивающие вещества и хлористый калий.
стабилизация мембран клеток достигается назначением глюкокортикоидов и хлористого магния.
* в настоящее время важным фактором профилактики и лечения гипоксии является гипербарическая оксигенация.
Вопрос №70 Нарушение в системе факторов естественной резистентности и их связь с иммунологической реактивностью. Патология фагоцитоза. Нарушение фагоцитоза является первичным иммунодефицитом. Дефициты системы фагоцитов в основном касаются нарушений фагоцитарной функции нейтрофильных гранулоцитов. Выделяют следующие механизмы их формирования:
• нейтропения в связи с дефицитом, нарушением пролиферации и созревания гранулоцитарных клеток-предшественниц в костном мозгу (циклическая нейтропения, болезнь Костманна (или инфантильный агранулоцитоз), семейная доброкачественная нейтропения, ретикулярный дисгенез, синдром Швахмана-Даймонда-Оски, врожденный дискератоз и др.), вследствие нарушения высвобождения нейтрофилов из костного мозга в кровь, укорочения срока жизни качественно неполноценных (с цитогенетическими аномалиями) нейтрофилов (миелокахексия);
• нарушение хемотаксиса нейтрофильных гранулоцитов, обусловленное дисфункцией актина и неспособностью клеток образовывать псевдоподии (синдром «ленивых лейкоцитов»);
• дефицит молекул адгезии (от лат. adhaesio - прилипание) нейтрофилов вследствие дефекта гена β2-цепи интегринов (CD18) или утраты клетками способности синтезировать молекулы селектинов, что приводит, в частности, к нарушению взаимодействий сиалогликопротеина Sgp50 с CD62L (лиганд для L-селектина лейкоцитов) и сиалил-Lewisх-олигосахарида с CD62E (лиганд для Е-селектина эндотелиальных клеток). В результате нейтрофилы утрачивают способность к адгезии и связанным с ней функциям - миграции и эндоцитозу;
• утрата нейтрофилами способности к киллингу при включении в их цитоплазму аномальных гранул (синдром Чедиака-Хигаси, аномалия Альдера-Рейли), дефиците вторичных (специфических) цитоплазматических гранул или нарушениях продукции факторов респираторного взрыва - активных метаболитов кислорода (супероксидного анион-радикала, перекиси водорода и др.) вследствие недостаточности синтеза внутриклеточных ферментов (НАДФН-оксидазы, миелопероксидазы, глюкозо-6-фосфатдегидрогеназы), обусловленной аномалиями генов в Х, 1-й, 7-й или 16-й хромосомах. Примером такого рода иммунодефицита является хроническая гранулематозная болезнь, при которой в результате дефекта киллинговой функции нейтрофилов микробы формируют хронические инфекционные гранулемы в лимфатических узлах, печени и легких.
Вопрос №71.Иммунодефицитные состояния (первичные, вторичные). Патогенетическая классификация приобретенных иммунодефицитов.
Иммунодефициты подразделяются на:
Первичные (Врожденные)
Специфические
Неспецифические (дефект на уровне фагоцитарных клеток) (Вопрос №70)
Вторичные (Приобретенные)
Нарушения иммунитета могут проявляться:
в снижении иммунологических реакций (иммунодефицит);
активации иммунологических реакций (аллергия);
дисфункции (гаммапатия);
толерантности.
Нарушения иммунитета:
Активация:
- Повышение иммунитета (вакцинация, воспаление, лихорадка). - Активация иммунитета (аллергия).
Снижение иммунитета (иммунодефицит): - врожденный (гумормальный и клеточный): - Агаммаглобулинемия
- Недостаточный синтез IgG, IgA.
Последствия – склонность к инфекцмм у детей.
Врожденный клеточный – склонность к опухолям, вирусным, грибковым процессам.
При поражении стволовой клетки – нарушается клеточный и гуморальный иммунитет – плод нежизнеспособный, завершается выкидышем или гибель в раннем постнатальном периоде.
Классификация Врожденных специфических иммунодефицитов:
-Комбинированные (Синдром Вискотта-Олдрича) – дефект на уровне полипотентной стволовой клетки и стволовых клеток лимфоидного ростка, на уровне пре-Т и и пре-В клеток. Характеризуются нарушением активации CD4 CD8, нарушением продукции IgМ и недостаточной активацией Т-лф из-за отсутствия гликозилтрансферазы. По идее нарушения на уровне костного мозга???
- Нарушение клеточного иммунитета (Синдром Ди-Джоржи) – дефект на уровне Т-клеток. Гипо-/Аплазия тимуса.
- Нарушение гуморального иммунитета (Болезнь Брутона) – дефект на уровне В-клеток. Агамма (Гипогамма) глобулинемия.
- Уменьшение числа плазмоцитов, синтезирующих IgA.
Гаммапатия классифицируется на:
- Моноклональные (IgG, IgA) – увеличивается один класс иммуноглобулинов. - Поликлональные (более часто). При этом образуется много участков плазмоклеточного перерождения костного мозга.
Следствие: повышение вязкости крови, протеинурия, возможныепереломы и склонность к инфекции.
Классификация вторичных (приобретенных) иммунодефицитов
По механизму развития:
Поражение органов иммунитета (СККД, цитостатики, облучение)
Опосредованное подавление иммунитета (стресс, сахарный диабет, опухоли)
При недостатке белка (обширные ожоги, голодание, нефротический синдром, гепато-ренальная недостаточность).
Вопрос №72.Понятие об аллергии. Классификация аллергических реакций.
Аллергия – состояние измененной реактивности организма в виде повышения чувствительности его к повторным воздействиям аллергенов, в основе чего лежат иммунологические механизмы.
Понятие с патолога:
Аллергия – типовой патологический процесс, при контакте с антигеном и сопровождающийся повреждением структуры и функций собственных клеток, тканей организма.
Аллергия – состояние повышенной чувствительности организма по отношению к определенному веществу или веществам, развивающиеся при повторном воздействии этих веществ.
В формировании любой аллергической реакции выделяют 3 стадии (А.Д. Адо).
Иммунологическая стадия – ее основу составляют иммунологические сдвиги и взаимодействие аллергена с материальным субстратом сенсибилизации (антителами и Т-лимфоцитами).
Патохимическая стадия – возникает в результате повреждения клеток комплексом аллерген-антитело или аллерген-Т-лимфоцит. Сопровождается нарушением активности ферментных систем и образованием медиаторов аллергии.
Патофизиологическая стадия – включает нарушения специфических функций органов и систем под влиянием медиаторов аллергии или в результате прямого воздействия на клетки комплекса аллерген-антитело.
Общей особенностью взаимодействия аллергических антител с антигеном при его повторном внедрении в организм является:
Фиксация антител (IgE) на мембранах клеток;
Отложение иммунных комплексов (IgG + антиген), образовавшихся в биологических жидкостях, на поверхности сосудистой стенки;
Фиксация антигена (гаптена), например, лекарственного соединения, на клетках, с последующим взаимодействием с циркулирующими антителами (IgG, IgM) на поверхности клеток.
Классификация аллергических реакций:
По скорости их развития:
Немедленного типа – реакции, протекающие преимущественно в жидких средах организма, с участием реакций аллерген-антитело.
Замедленного типа – реакции, протекающие на клеточном уровне, преимущественно с участием сенсибилизированных Т-лф (киллеров).
А также 3 тип – стимулирующий тип реакций гиперчувствительности.
Механизмы аллергии немедленного типа:
- Анафилактический – IgE, IgG + аллерген. Вызывает Анафилактический шок, полинозы.
- Цитотоксический – IgG, IgМ + аллерген + комплемент. Вызывает Аллергические цитопении, гемолитическая болезнь новорожденных, отторжение трансплантата, нефрит, миокардит.
- Иммунокомплексный – IgG, IgМ + аллерген. Вызывает Аутоиммунный гломерулонефрит, феномен Артюса, сывороточная болезнь, геморрагический шок при инфекции вирусом Денге.
Механизм аллергии замедленного типа заключается во взаимодействии аллергена с сенсибилизированными Т-лф в результате чего образуются медиаторы замедленной аллергии – лимфокины, которые обладают выраженным цитотоксическим действием.
Аллергические реакции замедленного типы вызывают инфекционную аллергию (туберкулез, сифилис, вирусные процессы, шовный материал, инвазия паразитов, грибковые процессы), контактный дерматит, отторжение трансплантата, кожная базофильная гиперчувствительность.
Механизм стимулирующего типа заключается в стимуляции аллергеном функций клеток, при соединении с их клеточными рецепторами.
Вызывает Диффузный токсический зоб.
Вопрос №73.Классификация аллергенов.
Аллергены разделяют на экзо- и эндогенные. Среди экзогенных аллергенов выделяют:
инфекционные: бактерии, вирусы, грибы;
пыльцевые: пыльца растений, пух тополя, одуванчик, амброзия, хлопок;
поверхностные (эпиаллергены);
бытовые: домашняя и библиотечная пыль, продукты жизнедеятельности домашнего клеща;
пищевые: коровье молоко, куриные яйца, шоколад, цитрусовые, земляника, рыбы, крабы, омары, злаковые;
лекарственные: лечебные сыворотки, антибиотики;
химические.
Эндогенные аллергены подразделяются на следующие:
естественные (первичные): хрусталик и сетчатка глаза, ткани нервной системы, щитовидной железы, мужских половых желез;
вторичные (приобретенные), индуцированные из собственных тканей вследствие повреждений или связанные с действием на клетку микроорганизмов (например, комплекс вирус–клетка).
Аллергенами могут быть полные антигены и неполные (гаптены). Последние вызывают аллергию, соединяясь с макромолекулами или клетками организма.
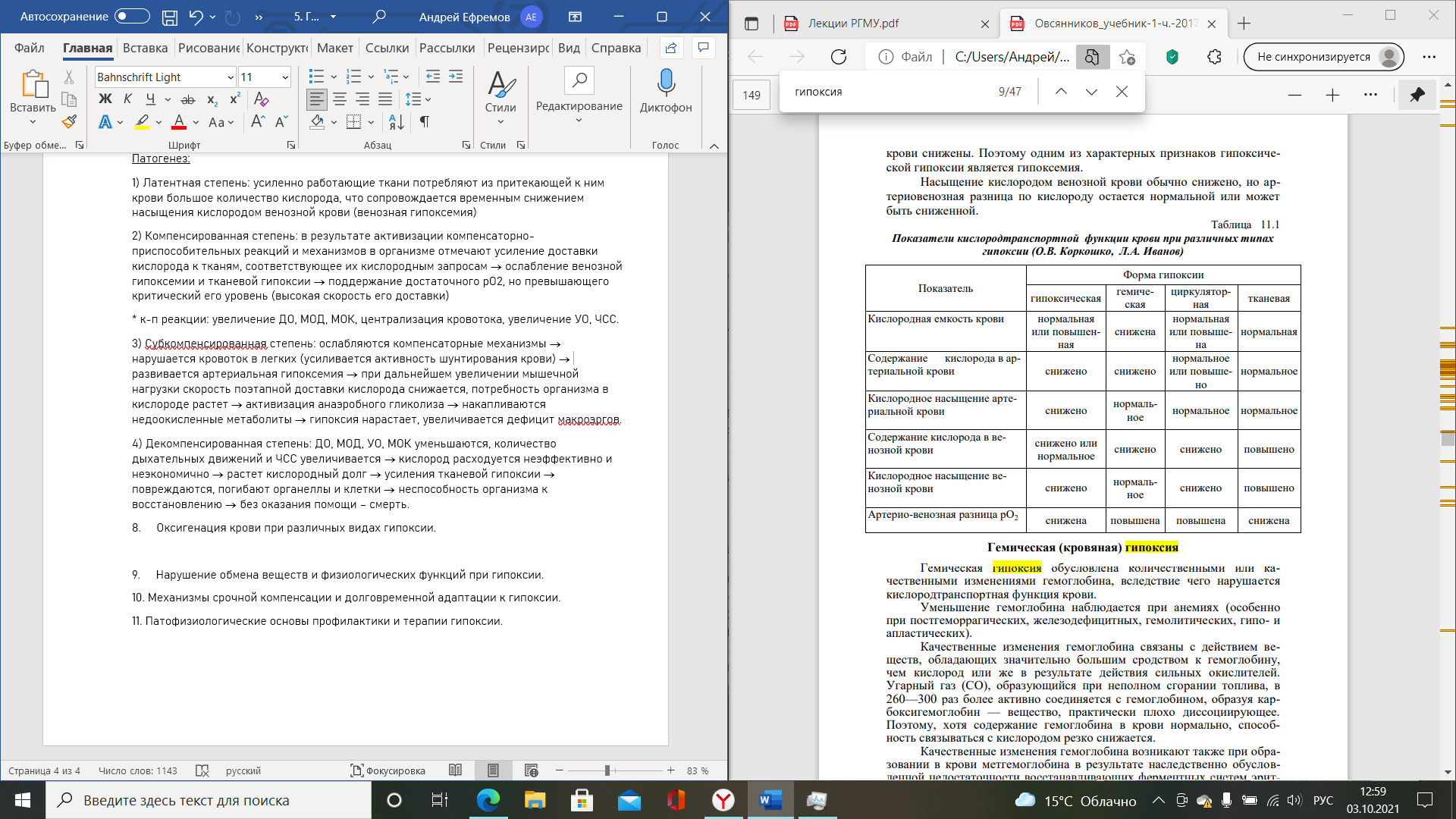
Вопрос №74.Сенсибилизация и ее механизмы при аллергии немедленного типа.
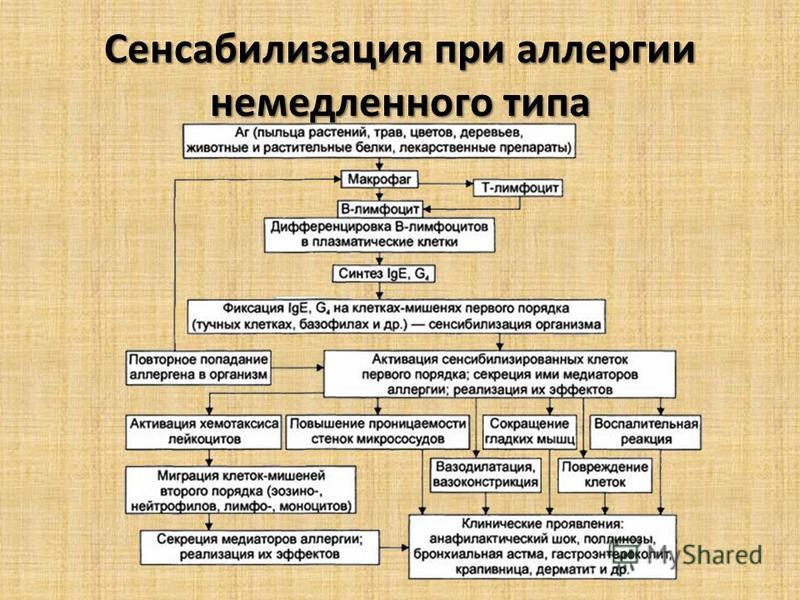
Механизмы аллергии немедленного типа:
Анафилактический – IgE, IgG + аллерген. Вызывает Анафилактический шок, полинозы.
Цитотоксический – IgG, IgМ + аллерген + комплемент. Вызывает Аллергические цитопении, гемолитическая болезнь новорожденных, отторжение трансплантата, нефрит, миокардит.
Иммунокомплексный – IgG, IgМ + аллерген. Вызывает Аутоиммунный гломерулонефрит, феномен Артюса, сывороточная болезнь, геморрагический шок при инфекции вирусом Денге.
Вопрос№75.Сенсибилизация и ее механизмы при аллергии замедленного типа.
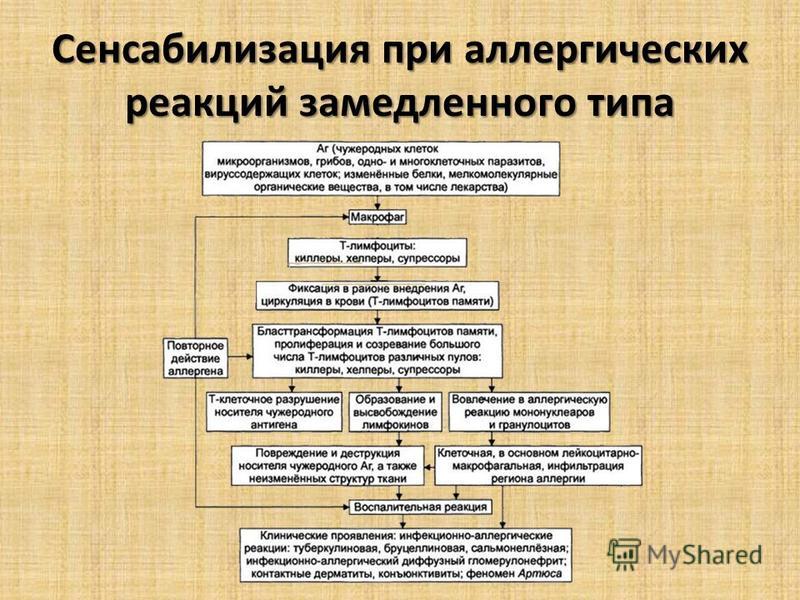
Аллергические реакции замедленного типа развиваются при бактериальной аллергии, контактном дерматите, аллергии к высокоочищенным белкам, аутоаллергии, а также при отторжении трансплантата.
Механизм аллергии замедленного типа заключается во взаимодействии аллергена с сенсибилизированными Т-лф в результате чего образуются медиаторы замедленной аллергии – лимфокины, которые обладают выраженным цитотоксическим действием.
Аллергические реакции замедленного типы вызывают инфекционную аллергию (туберкулез, сифилис, вирусные процессы, шовный материал, инвазия паразитов, грибковые процессы), контактный дерматит, отторжение трансплантата, кожная базофильная гиперчувствительность.
Вопрос№76.Стадии аллергических реакций. Их краткая характеристика.
В формировании любой аллергической реакции выделяют 3 стадии (А.Д. Адо).
Иммунологическая стадия – ее основу составляют иммунологические сдвиги и взаимодействие аллергена с материальным субстратом сенсибилизации (антителами и Т-лимфоцитами).
Патохимическая стадия – возникает в результате повреждения клеток комплексом аллерген-антитело или аллерген-Т-лимфоцит. Сопровождается нарушением активности ферментных систем и образованием медиаторов аллергии.
Патофизиологическая стадия – включает нарушения специфических функций органов и систем под влиянием медиаторов аллергии или в результате прямого воздействия на клетки комплекса аллерген-антитело.
Вопрос№ 77.Патогенез аллергических реакций немедленного типа
Тип Анафилактический
Иммунная стадия. Первое проникновение в организм аллергена вызывает синтез антител IgE (реагинов), которые сорбируются на мембранах базофилов/тучных клеток. При повторном попадании в организм специфического аллергена, последний связывается с IgE на мембране базофила/тучной клетки, что приводит к дегрануляции этих клеток с высвобождением БАВ.
Патохимическая стадия. В результате дегрануляции базофилов/тучных клеток высвобождаются: гистамин, серотонин, гепарин, хемотаксические факторы, ферменты (триптаза, пероксидаза, кислые гидролазы).
Выделение медиаторов приводит к увеличению проницаемости сосудов, усиливает хемотаксис нейтрофилов, эозинофилов. Кроме того, синтезируются метаболиты арахидоновой кислоты (лейкотриены, простагландины, тромбоксан), фактор активации тромбоцитов, активируется калликреин-кининовая система. Включение гемокоагуляционных механизмов и образование тромбов микрососудистого ложа локализует очаг проникновения аллергена в организм. Действие БАВ сопровождается разрушением эпителия, развитием отека и серозного воспаления, гиперсекрецией слизи, сокращением бронхов.
К этому типу реакций относят анафилаксию общую и местную. Общая бывает при анафилактическом шоке. Местная может проявляться в форме крапивницы, бронхиальной астмы, сенной лихорадки, отека Квинке.
Тип Цитотоксический
Иммунная стадия. При гиперчувствительности II типа повреждение клеток-мишеней обусловлено взаимодействием антител с антигенами, которые являются компонентами клетки или сорбированы на ней. Аллергическая реакция начинается в результате прямого повреждающего действия на клетки антител (IgМ и IgG), комплексы антиген–антитело активируют систему комплемента и эффекторные клетки (нейтрофилы, макрофаги).
Патохимическая стадия. Активация комплемента сопровождается опсонизацией, усилением фагоцитоза, высвобождением гистамина под влиянием С3а, С5а, образованием кининов, разрушением мембраны клеток. Активация нейтрофилов, моноцитов, эозинофилов приводит к выделению из них лизосомальных ферментов, образованию супероксидного анион-радикала, синглетного кислорода. Все эти вещества участвуют в развитии повреждения мембраны клеток, в активации свободнорадикального окисления липидов клеточных мембран.
В качестве клинических примеров аллергических реакций II типа можно привести аутоиммунную гемолитическую анемию, аутоиммунный тиреоидит, аллергический лекарственный агранулоцитоз, тромбоцитопению, нефротоксический нефрит и др.
Тип Иммунокомплексный
Иммунная стадия. Комплекс антиген–антитело образуется в крови и межклеточной жидкости. Роль преципитирующих антител выполняют IgM и IgG. Микропреципитаты сосредоточиваются вокруг сосудов и в сосудистой стенке. Иммунные комплексы активируют комплемент, а посредством него — выработку других активных веществ, хемотаксис и фагоцитоз, в результате образуется лейкоцитарный инфильтрат. Гиперчувствительность III типа развивается при появлении большого количества иммунных комплексов или при нарушении их элиминации ретикулоэндотелиальной системой.
Патохимическая стадия. В результате соединения антигена и антитела образуется циркулирующий иммунный комплекс, который при его фиксации в микроциркуляторном русле приводит к активации комплемента, высвождению лизосомальных ферментов, образованию кининов, супероксидных радикалов, высвобождению гистамина, серотонина, повреждению эндотелия и агрегации тромбоцитов. Нарушение микроциркуляции усиливает повреждение ткани, вплоть до некроза. При этом типе реакций в очаге воспаления вначале преобладают нейтрофилы, затем макрофаги и, наконец, лимфоциты.
Примером реакций III типа является сывороточная болезнь, местные реакции по типу феномена Артюса, экзогенные аллергические альвеолиты (легкие фермера), гломерулонефрит, некоторые варианты лекарственной и пищевой аллергии, аутоиммунная патология.
Вопрос № 78.Общие биологические эффекты медиаторов немедленной аллергии.

Вопрос № 79.Патогенез аллергических реакций замедленного типа.
Тип Замедленной гиперчувствительности.
Иммунная стадия. Главная особенность реакций замедленного типа состоит в том, что они не зависят от наличия антител. С антигеном взаимодействуют Т-лимфоциты, которые распознают антигенные детерминанты с высокой степенью специфичности с помощью рецепторов, в состав которых входит антиген ГКГС. Реакция замедленной гиперчувствительности не менее специфична по отношению к антигену, чем реакция с иммуноглобулинами, благодаря наличию у Т-лимфоцитов рецепторов, способных специфически взаимодействовать с антигеном. Однако в ткани, где происходит эта реакция, среди множества клеток, разрушающих антиген и ткань, обнаруживается только несколько процентов Т-лимфоцитов, способных специфически реагировать с антигеном. Данный факт стал понятен после открытия особых веществ, выделяемых Т-лимфоцитами, — лимфокинов.
Благодаря им, иммунные Т-лимфоциты даже в небольшом количестве становятся организаторами разрушения антигена другими лейкоцитами крови.
Патохимическая стадия. Во время повторного контакта с антигеном (аллергеном) цитотоксические (сенсибилизированные) Т-лимфоциты выделяют БАВ (лимфокины), которые управляют функцией других лейкоцитов и оказывают цитотоксическое действие на клетки-мишени.
К таким БАВ относятся:
Фактор, угнетающий миграцию макрофагов (обладает способностью усиливать фагоцитоз и участвует в образовании гранулем);
Митогенные факторы (вызывают пролиферацию клеток);
Хемотаксические факторы;
Гранулоцитарно-моноцитарные колониестимулирующие факторы;
Лимфотоксины (повреждают клетки-мишени);
Интерфероны.
Выделяющиеся из сенсибилизированных Т-лимфоцитов цитокины активируют и привлекают в очаг воспаления клетки моноцитарно-макрофагального ряда. Повреждение клеток и тканей обусловлено:
Прямым цитотоксическим действием Т-лимфоцитов на клеткимишени (через образование пор в клеточной мембране, что вызывает набухание и гибель клетки, или посредством инициации апоптоза);
Цитотоксическим действием Т-лимфоцитов за счет неспецифических факторов: провоспалительных цитокинов, лизосомальных ферментов и иных цитотоксических веществ (NO, оксиданты), продуцируемых активированными клетками моноцитарно-макрофагального ряда.
Все эти процессы приводят к формированию очага воспаления, в результате чего аллерген отграничивается от окружающих тканей гранулемой.
При аллергических реакциях IV типа среди клеток, инфильтрирующих очаг воспаления, преобладают макрофаги, затем следуют Т-лимфоциты и, в последнюю очередь, нейтрофилы.
Примером гиперчувствительности замедленного типа являются: аллергия, формирующаяся при некоторых инфекционных заболеваниях (туберкулез, лепра, бруцеллез), микозах, протозойных инфекциях; контактный дерматит, некоторые аутоиммунные заболевания.
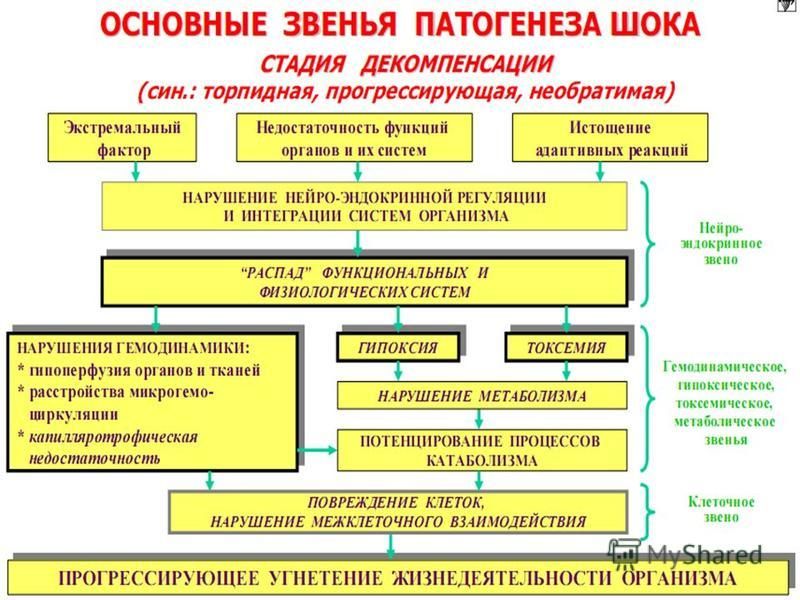
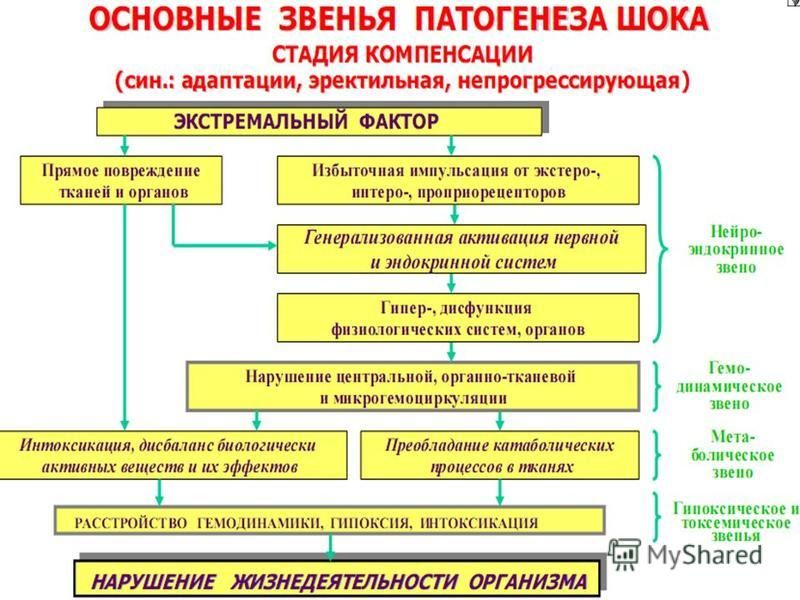
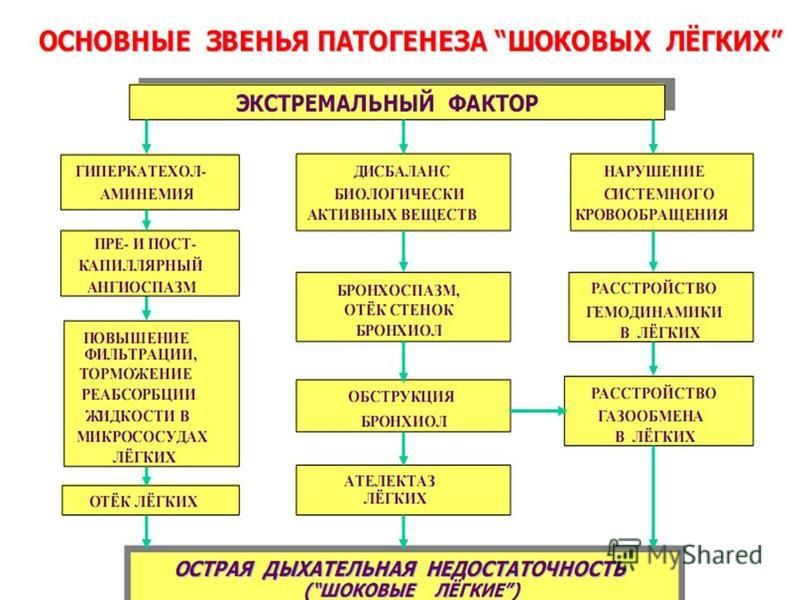
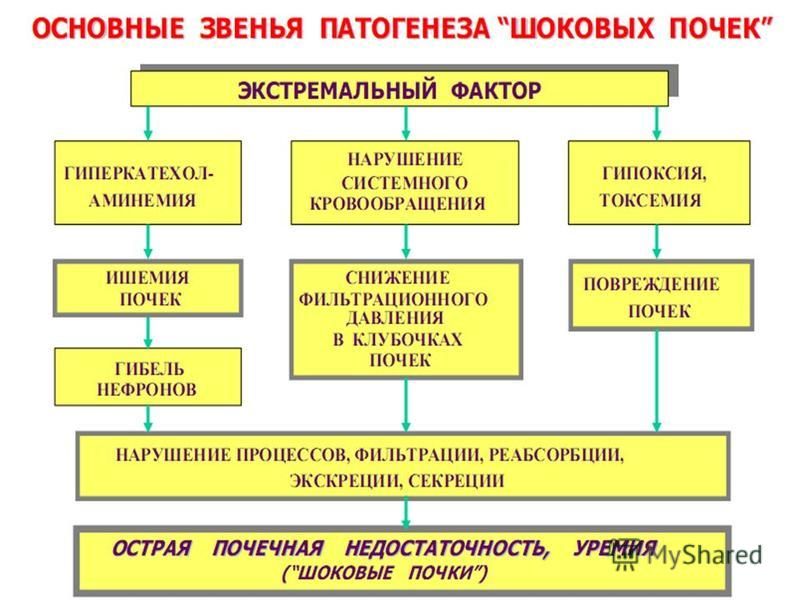
Вопрос № 80.Клинические стадии шока.
Шок – типовой патологический процесс, возникающий при действии на организм экстремальных факторов внешней или внутренней среды, которые, наряду с первичным повреждением вызывают чрезмерные и неадекватные реакции адаптивных систем, особенно симпато-адреналовой, стойкие нарушения нейроэндокринной регуляции гомеостаза, особенно гемодинамики, микроциркуляции, кислородного режима организма и обмена веществ.
По этиологии различают следующие виды шоков: 1) геморрагический; 2) травматический; 3) дегидратационный; 4) ожоговый; 5) кардиогенный; 6) септический; 7) анафилактический.
Классификация шока по стадиям:
Компенсированный (Ранняя). Клинические проявления: тахикардия, тахипноэ, диурез снижен или нормальный, умеренная гипоксемия и гипокарбия, метаболический ацидоз, возбуждение/угнетение сознания, летаргия
Декомпенсированный (Поздняя). Клинические проявления: Артериальная гипотензия, холодные конечности, слабый частый пульс, олигоанурия, нарастающая гипоксемия, метаболический и респираторный ацидоз, нарушения метаболизма глюкозы, гипокальциемия. Проявления органной дисфункции: ДВС-синдром, респираторный дистресс-синдром, кома, парез кишечника, повышение АЛТ и АСТ, острый тубулярный некроз.
С необратимыми нарушениями. Клинические проявления: Клиника быстро прогрессирующего СПОД.
За основной критерий определения стадии шока можно принять АД. При компенсированном шоке АД нормальное или даже повышенное, при декомпенсированном — сниженное. Стадия необратимых клеточных нарушений не имеет отличий в клинической симптоматике со стадией декомпенсации и может быть определена с помощью лабораторных методов исследования, в частности, по артериовенозному градиенту по О2 при условии восстановления периферической перфузии.
Вопрос №81.Патогенетическая классификация ведущих звеньев патогенеза шоковых состояний.
В зависимости от характера действующей причины и особенностей развивающегося повреждения основными ведущими патогенетическими звеньями становятся:
гиповолемия (абсолютная или относительная),
болевое раздражение,
инфекционный процесс на стадии сепсиса.
Их соотношение и выраженность при каждом виде шока различны. Вместе с тем в механизмах развития всех видов шока можно выделить и общее звено. Им становится последовательное включение двух типов компенсаторно-приспособительных механизмов.