
- •Вопросы для подготовки к экзамену
- •Виды хеморецепторов
- •Симпатический и парасимпатический отделы и их различия
- •Функции
- •Функции
- •Функции ретикулярной формации
- •Основные ритмы на ээг
- •Альфа-ритм
- •Бета-ритм
- •Дельта-ритм
- •Тета-ритм
- •Симпатическую
- •Парасимпатическую
- •Метасимпатическую
- •Стволовые центры
- •Гипоталамические центры
- •Общие свойства нервных центров
- •I. По характеру психической активности:
- •По характеру целесообразности деятельности:
- •III. По использованию дополнительных средств:
- •IV. По продолжительности сохранения материала:
- •V. По участию наследственных механизмов:
- •Внешний и внутренний гемостаз
- •Регуляция деятельности дыхательного центра
- •Выделение слюны по механизму условного рефлекса
Регуляция деятельности дыхательного центра
Механизм первого вдоха новорожденного. В организме матери газообмен плода происходит через пупочные сосуды, тесно контактирующие с плацентарной кровью матери. После рождения ребенка и отделения плаценты указанная связь нарушается. Метаболические процессы в организме новорожденного приводят к образованию и накоплению углекислого газа, который, так же как и недостаток кислорода, гуморально возбуждает дыхательный центр. Кроме того, изменение условий существования ребенка приводит к возбуждению экстеро- и проприорецепторов, что также является одним из механизмов, принимающих участие в осуществлении первого вдоха новорожденного.
Влияние клеток коры большого мозга на активность дыхательного центра.
Учащение и углубление дыхания, которые наступают до начала физической работы или спортивных состязаний, осуществляются по механизму условных рефлексов. Эти изменения в дыхательных движениях отражают сдвиги в активности дыхательного центра и имеют приспособительное значение, способствуя подготовке организма к выполнению работы, требующей большой затраты энергии и усиления окислительных процессов.
По мнению М.Е. Маршака, корковая регуляция дыхания обеспечивает необходимый уровень легочной вентиляции, темп и ритм дыхания, постоянство уровня углекислого газа в альвеолярном воздухе и артериальной крови.
По М.В. Сергиевскому, регуляция активности дыхательного центра представлена тремя уровнями.
Первый уровень регуляции — спинной мозг. Здесь располагаются центры диафрагмальных и межреберных нервов, обусловливающие сокращение дыхательных мышц.
Второй уровень регуляции — продолговатый мозг. Здесь находится дыхательный центр, который перерабатывает разнообразные афферентные импульсы, идущие от дыхательного аппарата, а также от основных рефлексогенных сосудистых зон
Третий уровень регуляции — верхние отделы головного мозга, включающие и корковые нейроны. Только при участии коры большого мозга возможно адекватное приспособление реакций системы дыхания к изменяющимся условиям окружающей среды.
Локализация и функциональные свойства дыхательных нейронов продолговатого мозга.
Нейроны дыхательного центра локализованы в дорсомедиальной и вентролатеральной областях продолговатого мозга и образуют так называемые дорсальную и вентральную дыхательную группу.
Дыхательные нейроны, активность которых вызывает инспирацию или экспирацию, называются соответственно инспираторными и экспираторными нейронами. Инспираторные и экспираторные нейроны иннервируют дыхательные мышцы. В дорсальной и вентральной дыхательной группах продолговатого мозга обнаружены следующие основные типы дыхательных нейронов: 1) ранние инспираторные, которые разряжаются с максимальной частотой в начале фазы вдоха; 2) поздние инспираторные, максимальная частота разрядов которых приходится на конец инспирации; 3) полные инспираторные с постоянной или постепенно нарастающей активностью в течение фазы вдоха; 4) постинспираторные, которые имеют максимальный разряд в начале фазы выдоха; 5) экспираторные с постоянной или постепенно нарастающей активностью, которую они проявляют во вторую часть фазы выдоха; 6) преинспираторные, которые имеют максимальный пик активности непосредственно перед началом вдоха. Тип нейронов определяется по проявлению его активности относительно фазы вдоха и выдоха.
Дыхательные нейроны спинного мозга и варолиевого моста, их роль в регуляции вентиляции легких.
В мосту находятся два ядра дыхательных нейронов: медиальное парабрахиальное ядро и ядро Келликера—Фюзе. Иногда эти ядра называют пневмотаксинеским центром. В первом ядре находятся преимущественно инспираторные, экспираторные, а также фазовопереходные нейроны, а во втором — инспираторные нейроны. Предполагают, что дыхательные нейроны моста регулируют смену фаз дыхания и скорость дыхательных движений. В сочетании с двусторонней перерезкой блуждающих нервов разрушение указанных ядер вызывает остановку дыхания на вдохе.
Диафрагмальные мотонейроны своими аксонами образуют диафрагмальный нерв. Нейроны расположены узким столбом в медиальной части вентральных рогов от С3 до С4. Диафрагмальный нерв состоит из 700—800 миелиновых и более 1500 безмиелиновых волокон. Подавляющее количество волокон является аксонами а-мотонейронов, а меньшая часть представлена афферентными волокнами мышечных и сухожильных веретен, локализованных в диафрагме, а также рецепторов плевры, брюшины и свободных нервных окончаний самой диафрагмы.
Мотонейроны сегментов спинного мозга, иннервирующие дыхательные мышцы. На уровне С1—С2 вблизи латерального края промежуточной зоны серого вещества находятся инспираторные нейроны, которые участвуют в регуляции активности межреберных и диафрагмальных мотонейронов (см. рис. 7.14).
Мотонейроны, иннервирующие межреберные мышцы, локализованы в сером веществе передних рогов на уровне от Тh4 до Тh10.
Мотонейроны, иннервирующие мышцы брюшной стенки, локализованы в пределах вентральных рогов спинного мозга на уровне Th4-L3.
Генерация дыхательного ритма. Классификация инспираторных и экспираторных нейронов дыхательного центра продолговатого мозга.
Ритмическое сокращение и расслабление дыхательных мышц обеспечивается циркуляцией возбуждения в дыхательных нейронах продолговатого мозга, а также взаимодействием импульсации нейронов продолговатого мозга с импульсацией дыхательных нейронов моста. Дыхательный цикл подразделяют на фазу вдоха и фазу выдоха относительно движения воздуха из атмосферы в сторону альвеол (вдох) и обратно (выдох). Двум фазам внешнего дыхания соответствуют три фазы активности нейронов дыхательного центра продолговатого мозга: инспираторная, которая соответствует вдоху; постинспираторная, которая соответствует первой половине выдоха и называется пассивной контролируемой экспирацией; экспираторная, которая соответствует второй половине фазы выдоха и называется фазой активной экспирации (рис. 24).
Дыхательный цикл начинается с возбуждения ранних инспираторных нейронов, которые полностью освобождаются от сильного торможения со стороны постинспираторных нейронов. Полное растормаживание ранних инспираторных нейронов происходит в момент, когда активируются преинспираторные нейроны дыхательного центра, которые окончательно блокируют разряд экспираторных нейронов. Далее возбуждение переходит на полные инспираторные нейроны, которые способны совозбуждать друг друга. Полные инспираторные нейроны, благодаря этому свойству, поддерживают и увеличивают частоту генерации потенциалов действия в течение фазы вдоха. Именно этот тип дыхательных нейронов создает нарастающую активность в диафрагмальном и межреберных нервах, вызывая увеличение силы сокращения диафрагмы и наружных межреберных мышц.
Ранние инспираторные нейроны в силу особых физиологических свойств их мембраны прекращают генерировать потенциалы действия к середине фазы вдоха. Это моносинаптически растормаживает поздние инспираторные нейроны, поэтому их активность появляется в конце вдоха.
Поздние инспираторные нейроны способны дополнительно активировать в конце вдоха сокращение диафрагмы и наружных межреберных мышц. Одновременно поздние инспираторные нейроны выполняют функцию начального выключения инспирации. В период своей активности они получают возбуждающие стимулы от легочных рецепторов растяжения, которые измеряют степень растяжения дыхательных путей во время вдоха. Максимальный по частоте разряд поздних инспираторных нейронов приходится на момент прекращения активности других типов инспираторных нейронов дыхательного центра.
Прекращение активности всех типов инспираторных нейронов дыхательного центра растормаживает постинспираторные нейроны. Причем процесс растормаживания постинспираторных нейронов начинается гораздо раньше, а именно в период убывания разрядов ранних инспираторных нейронов. С момента появления активности постинспираторных нейронов выключается инспирация и начинается фаза пассивной контролируемой экспирации. Постинспираторные нейроны регулируют степень расслабления диафрагмы в первую половину фазы выдоха. В эту фазу заторможены все другие типы нейронов дыхательного центра. Однако в постинспираторную фазу сохраняется активность респираторно-связанных нейронов дыхательного центра, которые регулируют тонус мышц верхних дыхательных путей, прежде всего гортани.
Вторая половина фазы выдоха, или фаза активной экспирации, полностью зависит от механизма ритмогенеза инспираторной и постинспираторной активности. Например, при быстрых дыхательных движениях постинспираторная фаза может непосредственно переходить в фазу следующей инспирации.
Активность дыхательных мышц в течение трех фаз нейронной активности дыхательного центра тоже изменяется (рис. 24). В инспирацию мышечные волокна диафрагмы и наружных межреберных мышц постепенно увеличивают силу сокращения. В этот же период активируются мышцы гортани, которые расширяют голосовую щель, что снижает сопротивление воздушному потоку на вдохе. Работа инспираторных мышц во время вдоха создает достаточный запас энергии, которая высвобождается в постинспираторную фазу, или в фазу пассивной контролируемой экспирации. В постинспираторную фазу дыхания объем выдыхаемого из легких воздуха контролируется медленным расслаблением диафрагмы и одновременным сокращением мышц гортани. Сужение голосовой щели в постинспираторную фазу увеличивает сопротивление воздушному потоку на выдохе. Это является очень важным физиологическим механизмом, который препятствует спадению воздухоносных путей легких при резком увеличении скорости воздушного потока на выдохе, например при форсированном дыхании или защитных рефлексах кашля и чиханья.
Во вторую фазу выдоха, или фазу активной экспирации, экспираторный поток воздуха усиливается за счет сокращения внутренних межреберных мышц и мышц брюшной стенки. В эту фазу отсутствует электрическая активность диафрагмы и наружных межреберных мышц.
Координация деятельности правой и левой половин дыхательного центра является еще одной функцией дыхательных нейронов. Дыхательный центр имеет дорсальную и вентральную группу нейронов как в правой, так и в левой половине продолговатого мозга и таким образом состоит из двух симметричных половин. Эта функция выполняется за счет синаптического взаимодействия различных типов дыхательных нейронов. Дыхательные нейроны взаимосвязаны как в пределах одной половины дыхательного центра, так и с нейронами противоположной стороны. При этом наибольшее значение в синхронизации деятельности правой и левой половин дыхательного центра имеют проприобульбарные дыхательные нейроны и экспираторные нейроны комплекса Бетцингера.


Рефлексы регуляции дыхания с рецепторов слизистой полости носа, гортани, трахеи, бронхиол и J-рецепторов.
Рефлекторные механизмы.
Рефлексы со слизистой оболочки носа. Раздражение ирритантных рецепторов слизистой оболочки носа вызывает сужение бронхов, голосовой щели, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Защитный рефлекс проявляется у новорожденных при кратковременном погружение в воду.
Рефлексы с глотки. Механическое раздражение рецепторов вызывает сильнейшее сокращение диафрагмы, наружных межреберных мышц, вдох, который открывает дыхательный путь через носовые ходы (аспирационный рефлекс). Этот рефлекс выражен у новорожденных.
Рефлексы с гортани и трахеи. Раздражение нервных окончаний вызывает кашлевой рефлекс, проявляющийся в резком выдохе на фоне сужения гортани, и сокращение гладких мышц бронхов, которые сохраняются долгое время после рефлекса. Кашлевой рефлекс - основной легочной рефлекс блуждающего нерва.
Рефлексы с рецепторов бронхиол. Многочисленные миелинизированные рецепторы находятся в эпителии внутрилегочных бронхов и бронхиол. Их раздражение вызывает гиперпноэ, бронхоконстрикцию, сокращение гортани, гиперсекрецию слизи, но никогда не сопровождается кашлем.
Рефлексы с J-рецепторов. В альвеолярных перегородках в контакте с капиллярами находятся особые J-рецепторы, которые чувствительны к интерстициальному отеку, легочной венозной гипертензии, раздражающим газам и ингаляц наркотическим веществам. Стимуляция J-рецепторов вызывает вначале апноэ, затем поверхностное тахипноэ, гипотензию и брадикардию.
Рефлексы регуляции дыхания с рецепторов растяжения легких (Геринга-Брейера) и проприорецепторов грудной клетки.
Различают постоянные и непостоянные (эпизодические) рефлекторные влияния на функциональное состояние дыхательного центра.
Постоянные рефлекторные влияния возникают в результате раздражения рецепторов альвеол (рефлекс Геринга—Брейера), корня легкого и плевры (пульмоторакальный рефлекс), хеморецепторов дуги аорты и сонных синусов (рефлекс Гейманса), проприорецепторов дыхательных мышц.
Наиболее важным рефлексом является рефлекс Геринга—Брейера. В альвеолах легких заложены механорецепторы растяжения и спадения, являющиеся чувствительными нервными окончаниями блуждающего нерва. Рецепторы растяжения возбуждаются при обычном и максимальном вдохе, т. е. любое увеличение объема легочных альвеол возбуждает эти рецепторы. Рецепторы спадения становятся активными только в условиях патологии (при максимальном спадении альвеол).
Пульмоторакальный рефлекс возникает при возбуждении рецепторов, заложенных в легочной ткани и плевре. Проявляется этот рефлекс при растяжении легких и плевры. Рефлекторная дуга замыкается на уровне шейных и грудных сегментов спинного мозга. Конечным эффектом рефлекса является изменение тонуса дыхательной мускулатуры, благодаря чему происходит увеличение или уменьшение среднего объема легких.
К дыхательному центру постоянно поступают нервные импульсы от проприорецепторов дыхательных мышц. Во время вдоха происходит возбуждение проприорецепторов дыхательных мышц и нервные импульсы от них поступают в инспираторную часть дыхательного центра. Под влиянием нервных импульсов тормозится активность вдыхательных нейронов, что способствует наступлению выдоха.
Непостоянные рефлекторные влияния на активность дыхательных нейронов связаны с возбуждением разнообразных экстеро- и интерорецепторов. К непостоянным рефлекторным воздействиям, оказывающим влияние на деятельность дыхательного центра, относятся рефлексы, возникающие при раздражении рецепторов слизистой оболочки верхних дыхательных путей, слизистой носа, носоглотки, температурных и болевых рецепторов кожи, проприорецепторов скелетных мышц.
При раздражении эпителия дыхательных путей накопившейся пылью, слизью, а также попавшими химическими раздражителями и инородными телами наблюдается чиханье и кашель. Чиханье возникает при раздражении рецепторов слизистой оболочки носа, кашель — при возбуждении рецепторов гортани, трахеи, бронхов.
Гуморальная регуляция вентиляции легких. Влияние изменений рО2, рСО2, рН крови на вентиляцию легких.
Регуляция деятельности дыхательного центра осуществляется с помощью гуморальных, рефлекторных механизмов и нервных импульсов, поступающих из вышележащих отделов головного мозга.
Гуморальные механизмы. Специфическим регулятором активности нейронов дыхательного центра является углекислый газ, который действует на дыхательные нейроны непосредственно и опосредованно. В нейронах дыхательного центра в процессе их деятельности образуются продукты обмена веществ (метаболиты), в том числе и углекислый газ, который оказывает непосредственное влияние на инспираторные нервные клетки, возбуждая их. В ретикулярной формации продолговатого мозга, вблизи дыхательного центра, обнаружены хеморецепторы, чувствительные к углекислому газу. При увеличении напряжения углекислого газа в крови хеморецепторы возбуждаются, и нервные импульсы поступают к инспираторным нейронам, что приводит к повышению их активности. Углекислый газ повышает возбудимость нейронов коры большого мозга. В свою очередь клетки коры большого мозга стимулируют активность нейронов дыхательного центра. В механизме стимулирующего влияния углекислого газа на дыхательный центр важное место принадлежит хеморецепторам сосудистого русла. В области сонных синусов и дуги аорты обнаружены хеморецепторы, чувствительные к изменениям напряжения углекислого газа и кислорода в крови.
При оптимальном содержании в крови углекислого газа и кислорода наблюдаются дыхательные движения, отражающие умеренную степень возбуждения нейронов дыхательного центра. Эти дыхательные движения грудной клетки получили название эйпноэ.
Избыточное содержание углекислого газа и недостаток кислорода в крови усиливают активность дыхательного центра, что обусловливает возникновение частых и глубоких дыхательных движений — гиперпноэ. Еще большее нарастание количества углекислого газа в крови приводит к нарушению ритма дыхания и появлению одышки — диспноэ. Понижение концентрации углекислого газа и избыток кислорода в крови угнетают активность дыхательного центра. В этом случае дыхание становится поверхностным, редким и может наступить его остановка — апноэ.
Периодическим называют тип дыхания, при котором ряд дыхательных движений чередуется с паузами. Продолжительность пауз колеблется в пределах от 5 до 20 с и даже более. При периодическом дыхании типа Чейна—Стокса после паузы появляются слабые, впоследствии усиливающиеся дыхательные движения. При достижении максимума вновь наблюдается ослабление дыхания, а затем оно прекращается — наступает новая пауза. По окончании паузы цикл вновь повторяется. Продолжительность цикла — 30—60 с.
При снижении возбудимости дыхательного центра, обусловленном недостатком кислорода, наблюдаются и другие типы периодического дыхания.
Артериальные (периферические) и центральные хеморецепторы, их роль в регуляции вентиляции легких.
Артериальные
Напряжение в артериальной крови О2 и СО2, а также рН, как уже известно, зависит от вентиляции легких.
Но, в свою очередь, они являются факторами, влияющими на интенсивность этой вентиляции, то есть они влияют на деятельность ДЦ.
Опыт Фредерико с перекрестным кровообращением. У двух собак соединяли перекрестно сонные артерии с яремными венами при перевязанных позвоночных артериях. В результате голова первой собаки снабжалась кровью второй собаки, а голова второй собаки - кровью первой. Если у первой собаки пережать трахею (вызвать асфиксию), то у второй собаки наступало гиперпноэ. У первой собаки, несмотря на повышение рСО2 и понижение рО2, возникает апноэ.
Причина: в сонную артерию первой собаки поступала кровь второй собаки, у которой в результате гипервентиляции, в крови понижалось рСО2. Это влияние осуществляется не непосредственно на его нейроны, а через посредство специальных хеморецепторов, расположенных:
1. В центральных структурах (центральные, медулярные, бульбарные хеморецепторы).
2. На периферии (артериальные хеморецепторы).
От этих рецепторов в дыхательный центр поступает афферентная сигнализация о газовом составе крови.
Роль артериальных хеморецепторов. О2, СО2 и Н+ могут действовать на структуры НС не только центрально, непосредственно, но и путем возбуждения периферических хеморецепторов.
Наиболее важными из них является:
1. Параганглии, расположенные у места деления общей сонной артерии на внутреннюю и наружную, называемые каротидными тельцами (иннервируются веточками языкоглоточного нерва).
2. Параганглии дуги аорты, так называемые аортальные тельца (иннервируются волокнами п.vagus).
Хеморецепторы указанных зон, возбуждаются при повышении рСО2 и понижении рО2 и рН. Влияние О2 на дыхательный центр опосредовано исключительно периферическими хеморецепторами.
Таким образом, нейроны ДЦ поддерживаются в состоянии активности импульсами, поступающими от центральных (бульбарных) и периферических (артериальных) хеморецепторов, реагирующих на изменение 3-х параметров артериальной крови:
1. Снижение рО2 (гипоксемию);
2. Повышение рСО2 (гиперкапнию);
3. Снижению рН (ацидоз).
Главным стимулом дыхания является гиперкапния. Чем выше рСО2 (а с ним связана и рН), тем выше вентиляция легких.
Но особенно сильным стимулом центрального дыхательного механизма является сочетанное действие гипоксемии и гиперкапнии (и связанным с ним ацидозом).
Центральные хеморецепторы, их роль в регуляции вентиляции легких.
Роль центральных хеморецепторов. Центральные хеморецепторы располагаются в ПМ (центральные, медулярные, бульбарные хеморецепторы). Перфузия участка ПМ в области расположения данных рецепторов раствором с пониженным рН приводит к резкому усилению дыхания, а с повышением рН - к ослаблению дыхания.
В естественных условиях центральные хеморецепторы постоянно стимулируются Н+. Концентрация Н+ в ней находится в зависимости от напряжения СО2 в артериальной крови. Снижение рН на 0,01 вызывает увеличение вентиляции легких на 4 л/мин.
Вместе с тем, центральные хеморецепторы реагируют и на изменения рСО2, но в меньшей степени, чем изменения рН. Полагают, что основным химическим фактором, влияющим на центральные хеморецепторы является содержание Н+ в межклеточной жидкости ствола мозга, а действие СО2 связано с образованием этих ионов.
Изменения вентиляции легких при физической нагрузке, при высотной гипоксии и при повышенном атмосферном давлении.
Изменения вентиляции легких при физической нагрузке.
При физической нагрузке потребление 02 и продукция С02 возрастают в среднем в 15—20 раз. Одновременно усиливается вентиляция и ткани организма получают необходимое количество 02, а из организма выводится С02.
Каждый человек имеет индивидуальные показатели внешнего дыхания. В норме частота дыхания варьирует от 16 до 25 в минуту, а дыхательный объем — от 2,5 до 0,5 л. При мышечной нагрузке разной мощности легочная вентиляция, как правило, пропорциональна интенсивности выполняемой работы и потреблению 02 тканями организма. У нетренированного человека при максимальной мышечной работе минутный объем дыхания не превышает 80 л «мин \ а у тренированного может быть 120—150 л»мин -1 и выше. Кратковременное произвольное увеличение вентиляции может составлять 150—200 л*мин -1.
В момент начала мышечной работы вентиляция быстро увеличивается, однако в начальный период работы не происходит каких- либо существенных изменений pH и газового состава артериальной и смешанной венозной крови. Следовательно, в возникновении ги- перпноэ в начале физической работы не участвуют периферические и центральные хеморецепторы как важнейшие чувствительные структуры дыхательного центра, чувствительные к гипоксии и к понижению pH внеклеточной жидкости мозга.
Уровень вентиляции в первые секунды мышечной активности регулируется сигналами, которые поступают к дыхательному центру из гипоталамуса, мозжечка, лимбической системы и двигательной зоны коры большого мозга. Одновременно активность нейронов дыхательного центра усиливается раздражением проприоцепторов работающих мышц. Довольно быстро первоначальный резкий прирост вентиляции легких сменяется ее плавным подъемом до достаточно устойчивого состояния, или так называемого плато. В период «плато», или стабилизации вентиляции легких, происходит снижение Рао2 и повышение Расо2 крови, усиливается транспорт газов через аэрогематический барьер, начинают возбуждаться периферические и центральные хеморецепторы. В этот период к нейрогенным стимулам дыхательного центра присоединяются гуморальные воздействия, вызывающие дополнительный прирост вентиляции в процессе выполняемой работы. При тяжелой физической работе на уровень вентиляции будут влиять также повышение температуры тела, концентрация катехоламинов, артериальная гипоксия и индивидуально лимитирующие факторы биомеханики дыхания.
Состояние «плато» наступает в среднем через 30 с после начала работы или изменения интенсивности уже выполняемой работы. В соответствии с энергетической оптимизацией дыхательного цикла повышение вентиляции при физической нагрузке происходит за счет различного соотношения частоты и глубины дыхания. При очень высокой легочной вентиляции поглощение Ог дыхательными мышцами сильно возрастает. Это обстоятельство ограничивает возможность выполнять предельную физическую нагрузку. Окончание работы вызывает быстрое снижение вентиляции легких до некоторой величины, после которой происходит медленное восстановление дыхания до нормы.
Изменения вентиляции легких при сдвигах парциального давления газов.
Газообмен О2 и СО2 через альвеолярно-капиллярную мембрану происходит с помощью диффузии, которая осуществляется в два этапа. На первом этапе диффузионный перенос газов происходит через аэрогематический барьер, на втором - происходит связывание газов в крови легочных капилляров, объем которой оставляет 80-150 мл при толщине слоя крови в капиллярах всего 5-8 мкм. Плазма крови практически не препятствует диффузии газов, в отличие от мембраны эритроцитов.
Структура легких создает благоприятные условия для газообмена: дыхательная зона каждого легкого содержит около 300 млн. альвеол и примерно такое же число капилляров, имеет площадь 40-140 м2, при толщине аэрогематического барьера всего 0,3-1,2 мкм.
Особенности диффузии газов количественно характеризуются через диффузионную способность легких. Для О2диффузионная способность легких - это объем газа, переносимого из альвеол в кровь в 1 минуту при градиенте альвеолярно-капиллярного давления газа, равном 1 мм рт.ст.
Движение газов происходит в результате разницы парциальных давлений. Парциальное давление - это та часть давления, которую составляет данный газ из общей смеси газов. Пониженное давление О2 в ткани способствует движению кислорода к ней. Для СО2 градиент давления направлен в обратную сторону, и СО2 с выдыхаемым воздухом уходит в окружающую среду.
Градиент парциального давления кислорода и углекислого газа – это сила, с которой молекулы этих газов стремятся проникнуть через альвеолярную мембрану в кровь.
Парциальное напряжение газа в крови или тканях - это сила, с которой молекулы растворимого газа стремятся выйти в газовую среду.
На уровне моря атмосферное давление составляет в среднем 760 мм рт.ст., а процентное содержание кислорода - около 21%. В этом случае рО2 в атмосфере составляет: 760 х 21/100=159 мм рт.ст. При вычислении парциального давления газов в альвеолярном воздухе следует учитывать, что в этом воздухе присутствуют пары воды (47 мм рт.ст.). Поэтому это число вычитают из значения атмосферного давления, и на долю парциального давления газов приходится (760^47) =713 мм рт.ст. При содержании кислорода в альвеолярном воздухе, равном 14 %, его парциальное давление будет 100 мм рт. ст. При содержании двуокиси углерода, равном 5,5%, парциальное давление СО2 составит примерно 40 мм рт.ст.
В артериальной крови парциальное напряжение кислорода достигает почти 100 мм рт.ст., в венозной крови - около 40 мм рт.ст., а в тканевой жидкости, в клетках - 10-15 мм рт.ст. Напряжение углекислого газа в артериальной крови составляет около 40 мм рт.ст., в венозной - 46 мм рт.ст., а в тканях - до 60 мм рт.ст.
Анатомические и гистологические особенности сердца человека (камеры сердца, клапанный аппарат сердца, виды кардиомиоцитов, межклеточные контакты).
Анатомические особенности строения сердца человека.
Анатомически сердце это мышечный орган. Размер его небольшой, примерно с размер сжатого кулака. Сердце работает на протяжении всей жизни человека. Оно перекачивает около 5-6 литров крови в минуту. Этот объем увеличивается, когда человек двигается, физически напрягается, и уменьшается во время отдыха.
Вместе сердце и сосуды составляют сердечно-сосудистую систему. Эта система состоит из большого и малого кругов кровообращения. Из левых отделов сердца кровь сначала движется по аорте, затем по крупным и мелким артериям, артериолам, капиллярам. В капиллярах кислород и другие необходимые организму вещества поступают в органы и ткани, а оттуда выводятся углекислый газ, продукты обмена. После этого кровь из артериальной превращается в венозную и опять начинает движение к сердцу. Сначала по венулам, затем по более мелким и крупным венам. Через нижнюю и верхнюю полые вены кровь снова попадает в сердце, только уже в правое предсердие. Образуется большой круг кровообращения.
Венозная кровь из правых отделов сердца по легочным артериям направляется в легкие, где обогащается кислородом и снова возвращается в сердце.
Внутри сердце разделено перегородками на четыре камеры. Два предсердия разделены межпредсердной перегородкой на левое и правое предсердия. Левый и правый желудочки сердца разделены межжелудочковой перегородкой. В норме левые и правые отделы сердца абсолютно раздельны. У предсердий и желудочков разные функции. В предсердиях накапливается кровь, поступающая в сердце. Когда объем этой крови достаточен, она проталкивается в желудочки. А желудочки проталкивают кровь в артерии, по которым она движется по всему организму. Желудочкам приходится выполнять более тяжелую работу, поэтому мышечный слой в желудочках значительно толще, чем в предсердиях. Предсердия и желудочки с каждой стороны сердца соединяются предсердно-желудочковым отверстием. Кровь через сердце движется только в одном направлении. По большому кругу кровообращения из левой части сердца (левого предсердия и левого желудочка) в правую, а по малому из правой в левую.
Правильное направление обеспечивает клапанный аппарат сердца:
трехстворчатый
легочный
митральный
аортальный клапаны.
Они открываются в нужный момент и закрываются, препятствуя кровотоку в обратном направлении.
Трехстворчатый клапан
Он расположен между правым предсердием и правым желудочком. Он состоит из трех створок. Если клапан открыт, кровь переходит из правого предсердия в правый желудочек. Когда желудочек наполняется, мышца его сокращается и под действием давления крови клапан закрывается, препятствуя обратному току крови в предсердие.
Легочный клапан
При закрытом трехстворчатом клапане выход крови в правом желудочке возможен только через легочной ствол в легочные артерии. Легочный клапан расположен на входе в легочный ствол. Он открывается под давлением крови при сокращении правого желудочка, кровь поступает в легочные артерии, затем под действием обратного тока крови при расслаблении правого желудочка он закрывается, препятствуя обратному поступлению крови из легочного ствола в правый желудочек.
Двустворчатый или митральный клапан
Находится между левым предсердием и левым желудочком. Состоит из двух створок. Если он открыт, кровь поступает из левого предсердия в левый желудочек, при сокращении левого желудочка он закрывается, препятствуя обратному току крови.
Аортальный клапан
Закрывает вход в аорту. Тоже состоит из трех створок, которые имеют вид полулуний. Открывается при сокращении левого желудочка. При этом кровь поступает в аорту. При расслаблении левого желудочка, закрывается. Таким образом, венозная кровь (бедная кислородом) из верхней и нижней полой вен попадает в правое предсердие. При сокращении правого предсердия через трехстворчатый клапан она продвигается в правый желудочек. Сокращаясь, правый желудочек выбрасывает кровь через легочной клапан в легочные артерии (малый круг кровообращения). Обогащаясь кислородом в легких кровь превращается в артериальную и по легочным венам продвигается в левое предсердие, затем в левый желудочек. При сокращении левого желудочка артериальная кровь через аортальный клапан под большим давлением попадает в аорту и разносится по всему организму (большой круг кровообращения).
Гистологическое строение сердца
Сердце представляет собой мышечный орган, который ритмически сокращается, перекачивая кровь по сосудистой системе. Оно также вырабатывает гормон — предсердный натриуретический фактор. Его стенки состоят из трех оболочек: внутренней, или эндокарда, средней, или миокарда, и наружной, или перикарда (peri — около + греч. kardia — сердце). Центральный волокнистый участок сердца — так называемый волокнистый (фиброзный) скелет сердца (термин не вполне удачен) — служит в качестве основания клапанов, а также местом начала и прикрепления сердечных мышечных клеток.
Эндокард гомологичен интиме кровеносных сосудов. Он состоит из одного слоя плоских эндотелиальных клеток, расположенных на тонком подэндотелиальном слое из рыхлой соединительной ткани, которая содержит эластические и коллагеновые волокна, а также небольшое количество гладких мышечных клеток. Подэндотелиальный слой прикрепляется к миокарду слоем соединительной ткани (известным как субэндокардиальный слой), который содержит вены, нервы и ветви проводящей системы сердца (волокна Пуркинье).
Миокард — самая толстая из оболочек сердца — состоит из сердечных мышечных клеток, или кардиомиоцитов, располагающихся слоями, которые окружают камеры сердца в виде сложной спирали. Большое количество этих слоев прикрепляются к волокнистому скелету сердца. Расположение этих мышечных клеток исключительно разнообразно, поэтому на гистологических препаратах видно, что даже в пределах небольших участков клетки ориентированы в различных направлениях. Сердце покрыто снаружи однослойным плоским эпителием (мезотелием), который поддерживается тонким слоем соединительной ткани, образующей эпикард.
Под эпикардиальный слой рыхлой соединительной ткани содержит вены, нервы и нервные узлы. В этом слое накапливается жировая ткань, которая обычно окружает сердце. Перикард — серозная оболочка, в которой располагается сердце, — содержит висцеральный слой (ему соответствует эпикард) и париетальный слой. Между этими слоями находится небольшое количество жидкости, что облегчает движения сердца.
Фиброзный скелет сердца состоит из плотной соединительной ткани. Его основными компонентами являются перепончатая перегородка, фиброзный треугольник и фиброзные кольца. Эти структуры образованы плотной соединительной тканью, в которой толстые коллагеновые волокна ориентированы в различных направлениях. Некоторые участки содержат узелки из волокнистого хряща. сердце
Сердечные клапаны состоят из расположенной в центре основы, образованной плотной волокнистой соединительной тканью (содержащей как коллагеновые, так и эластические волокна), покрытой с обеих сторон слоями эндотелия. Основания клапанов прикреплены к фиброзным кольцам волокнистого скелета сердца.
Сердце имеет специализированную систему, ритмически генерирующую импульсы, которые распространяются по всему миокарду. Эта система включает два узла, расположенные в предсердии (синусно-предсердный узел и предсердно-желудочковый, или атриовентрикулярный, узел), а также предсердно-желудочковый пучок. Предсердно-желудочковый пучок начинается от одноименного узла и отдает ветви к обоим желудочкам. Клетки системы, проводящей импульсы, функционально объединены щелевыми соединениями.
Синусно-предсердный узел представляет собой скопление видоизмененных сердечных мышечных клеток, которые имеют веретеновидную форму, более мелкие размеры, чем предсердные мышечные клетки, и содержат меньше миофибрилл. Клетки предсердно-желудочкового узла сходны с такими же клетками синусно-предсердного узла, однако их цитоплазматические выросты ветвятся в различных направлениях, образуя сеть.
Предсердно-желудочковый пучок образован клетками, похожими на клетки предсердно-желудочкового узла. В дистальном направлении, однако, эти клетки становятся крупнее, чем обычные сердечные мышечные клетки, и приобретают особые отличительные черты. Эти клетки, образующие волокна Пуркинье, содержат одно или два центрально расположенных ядра, а их цитоплазма богата митохондриями и гликогеном. сердце
Миофибриллы в них немногочисленны и сосредоточены на периферии цитоплазмы. Проходя через подэндокардиальный слой, волокна Пуркинье проникают в желудочек и становятся внутримиокардиальными. Такое расположение очень важно, поскольку оно позволяет импульсу достигать наиболее глубоких слоев мускулатуры желудочков. В иннервации сердца участвуют как парасимпатический, так и симпатический отделы автономной системы, которые образуют широко распространяющиеся сплетения у основания сердца. Ганглионарные нервные клетки и нервные волокна присутствуют в участках вблизи синусно-предсердного и предсердно-желудочкового узлов. Хотя эти нервы не влияют на генерирование сердечного ритма — процесс, который приписывают синусно-предсердному (пейсмекерному) узлу, — они всё же воздействуют на сердечный ритм, как, например, при физической нагрузке и эмоциональном стрессе.
Стимуляция парасимпатического отдела (блуждающего нерва) замедляет сердцебиения, тогда как стимуляция симпатического нерва ускоряет ритм пейсмекера. Между мышечными волокнами миокарда располагаются многочисленные афферентные свободные нервные окончания, которые связаны с чувствительностью и болью. Частичная закупорка венечных артерий снижает приток кислорода к миокарду и вызывает боль (стенокардия). Эта же чувствительная иннервация проявляется при инфаркте миокарда, который сопровождается сильными болями, потому что многочисленные мышечные волокна гибнут в результате низкого уровня кислорода.
Виды кардиомиоцитов
Сердечная мышечная ткань содержит кардиомиоциты трех основных типов:
сократительные (рабочие) кардиомиоциты - образуют основную часть миокарда и характеризуются мощно развитым сократительным аппаратом, занимающим большую часть их саркоплазмы;
проводящие кардиомиоциты - обладают способностью к генерации и быстрому проведению электрических импульсов. Они образуют узлы и пучки проводящей системы сердца и разделяются на несколько подтипов. Характеризуются слабым развитием сократительного аппарата, светлой саркоплазмой и крупными ядрами. Особенности распределения и строения различных видов проводящих кардиомиоцитов описаны в курсе частной гистологии
секреторные (эндокринные) кардиомиоциты располагаются в предсердиях (в особенности, правом) и характеризуются отростчатой формой и слабым развитием сократительного аппарата. В их саркоплазме вблизи полюсов ядра находятся окруженные мембраной плотные гранулы диаметром 200-300 нм, содержащие гормон предсердный натриуретический фактор (пептид) - ПНФ (ПНП). Этот гормон вызывает усиленную потерю натрия и воды с мочой (натриурез и диурез), расширение сосудов, снижение артериального давления, угнетение секреции альдостерона, кортизола и вазопрессина. Способностью к выработке ПНФ первоначально в ходе эмбрионального развития обладают все кардиомиоциты; в дальнейшем (уже после рождения) она резко падает в клетках желудочков, сохраняясь в предсердных кардиомиоцитах. При перегрузке сердечной мышцы способность к синтезу ПНФ может восстанавливаться в кардиомиоцитах желудочков.
Физиологические свойства миокарда (возбудимость, автоматизм, проводимость, сократимость).
Автоматия — способностью сердца ритмически сокращаться под влиянием импульсов, возникающих в нем самом;
Субстратом автоматии в сердце является специфическая мышечная ткань, или проводящая система сердца, которая состоит из синусно-предсердного (СА) узла(в стенке правого предсердия), предсердно-желудочкового узла (в межпредсердной перегородке). От атриовентрикулярного узла начинается пучок Гиса. Пройдя в толщу межжелудочковой перегородки, он делится на правую и левую ножки, заканчивающиеся конечными разветвлениями — волокнами Пуркинье. Верхушка сердца не обладает автоматией, а лишь сократимостью, так как в ней отсутствуют элементы проводящей системы сердца.
В нормальных условиях водителем ритма первого порядка является синоатриальный узел. Частота разрядов синоатриального узла в покое составляет 70 в 1 минуту. Атриовентрикулярный узел — это водитель ритма второго порядка с частотой 40 —50 в 1 минуту. Он берет на себя роль водителя ритма, если по каким-либо причинам возбуждение от СА не может перейти на предсердия при атриовентрикулярной блокаде или при нарушении проводящей системы желудочков. Если поражены все основные водители ритма, то очень редкие импульсы (20 имп/с) могут возникать в волокнах Пуркинье — это водитель ритма 3-го порядка. Следовательно, существует градиент автоматии сердца, согласно которому степень автоматии тем выше, чем ближе расположен данный участок проводящей системы к синусному узлу.
Возбудимость — способностью сердца приходить в состояние возбуждения под действием раздражителя;
Степень возбудимости сердечной мышцы в процессе сердечного цикла меняется. Во время возбуждения она теряет способность реагировать на новый импульс раздражения. Такое состояние полной невозбудимости сердечной мышцы называется абсолютной рефрактерностью и занимает практически все время систолы. По окончании абсолютной рефрактерности к началу диастолы возбудимость постепенно возвращается к норме — относительная рефрактерность. В это время (в середине или в конце диастолы) сердечная мышца способна отвечать на более сильное раздражение внеочередным сокращением — экстрасистолой. За желудочковой экстрасистолой, когда внеочередной импульс зарождается в атриовентрикулярном узле, наступает удлиненная (компенсаторная) пауза Она возникает в результате того, что очередной импульс, который идет от синусного узла, поступает к желудочкам во время их абсолютной рефрактерности, вызванной экстрасистолой и этот импульс или одно сокращение сердца выпадает. После компенсаторной паузы восстанавливается нормальный ритм сокращений сердца. Если дополнительный импульс возникает в синоатриальном узле, то происходит внеочередной сердечный цикл, но без компенсаторной паузы. Пауза в этих случаях будет даже короче обычной. За периодом относительной рефрактерности наступает состояние повышенной возбудимости сердечной мышцы (экзальтационный период) когда мышца возбуждается и на слабый раздражитель. Период рефрактерности сердечной мышцы продолжается более длительное время, чем в скелетных мышцах, поэтому сердечная мышца не способна к длительному тетаническому сокращению.
Проводимость — способностью сердечной мышцы проводить возбуждение;
Между клетками проводящей системы и рабочим миокардом имеются тесные контакты в виде нексусов, поэтому возбуждение, возникшее в одном участке сердца, проводится без затухания в другой.
Скорость распространения возбуждения от предсердий к желудочкам составляет 0,8— 1,0 м/с. Проходя атриовентрикулярный узел, возбуждение задерживается на 0,04 с. Далее, распространившись по пучку Гиса и волокнам Пуркинье, возбуждение охватывает мускулатуру желудочков со скоростью 0,75 — 4,0 м/с.
Таким образом, мышечная ткань сердца ведет себя как функциональный синцитий. Благодаря этой особенности сердце подчиняется закону «все или ничего».
На раздражение возрастающей силы, начиная от порогового, мышца сердца отвечает сразу возбуждением всех волокон (амплитуда сокращений одинакова). Если раздражитель подпороговый, то она совсем не реагирует. Если раздражать сердечную мышцу током возрастающей частоты, оставив его силу постоянной, то каждое увеличение частоты раздражителя вызовет возрастающее сокращение сердечной мышцы — феномен лестницы. Это явление можно объяснить попаданием каждого последующего импульса в фазу повышенной возбудимости и накоплением ионов Са2+ в области миофибрилл, что и дает усиление ответной реакции.
Сократимость — способностью изменять свою форму и величину под действием раздражителя, а также растягивающей силы или крови.
Сокращение сердца запускается ПД. У сердечной мышцы ПД и фазы сокращения перекрывают друг друга. ПД заканчивается только после начала фазы расслабления. Это одна из особенностей электромеханического сопряжения сердечной мышцы.
Так же существует взаимосвязь между внутриклеточным депо Са2+ и Са2+ внеклеточной среды. Во время ПД Са2+ входит в клетку из внеклеточной среды и увеличивает длительность ПД, а значит, и рефрактерного периода, тем самым создаются условия для пополнения внутриклеточных запасов кальция, участвующего в последующих сокращениях сердца.
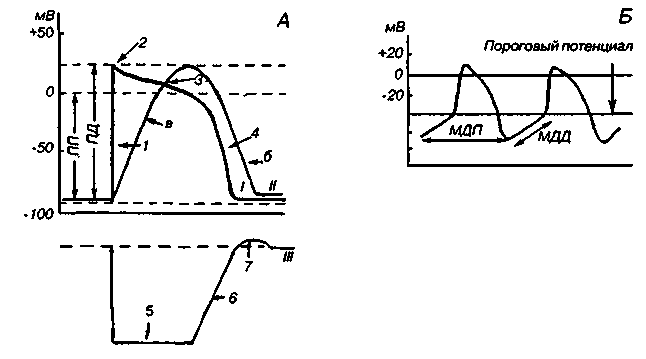
Электрическая активность клеток миокарда (потенциалы действия разных отделов миокарда). Автоматизм клеток миокарда.
Потенциал действия кардиомиоцитов начинается с быстрой риверсии мембранного потенциала, составляющего -90 мВ и создаваемого за счет К+-потенциала, до пика ПД (+30 мВ) (рис.11). Это фаза быстрой деполяризации, обусловленная коротким значительным повышением проницаемости для Na+, который лавинообразно устремляется в клетку. Фаза быстрой деполяризации очень короткая и составляет всего 1 -2 мс. Начальный вход Na+ быстро инактивируется, однако деполяризация мембраны продолжается за счет активации медленных натрий-кальциевых каналов, а вход Са2+ приводит к развитию плато ПД - это специфическая особенность клеток миокарда. В этот период быстрые натриевые каналы инактивируются и клетка становится абсолютно невозбудима. Это фаза абсолютной рефрактерности. Одновременно происходит активация калиевых каналов, а выходящие из клетки ионы К+ создают фазу быстрой реполяризации мембраны.
 Ускорение
процесса реполяризации происходит за
счет закрытия кальциевых каналов. В
конце периода реполяризации постепенно
закрываются калиевые каналы и
реактивируются натриевые. Это приводит
к восстановлению возбудимости кардио
миоцита и возникновению относительной
рефрактерной фазы. Длительность
ПД кардиомиоцита составляет 200 — 400 мс.
Ускорение
процесса реполяризации происходит за
счет закрытия кальциевых каналов. В
конце периода реполяризации постепенно
закрываются калиевые каналы и
реактивируются натриевые. Это приводит
к восстановлению возбудимости кардио
миоцита и возникновению относительной
рефрактерной фазы. Длительность
ПД кардиомиоцита составляет 200 — 400 мс.
Рис. 11. Схемы потенциалов действия различных отделов сердца, кривой сокращения и фаз возбудимости сердечной мышцы:
Калий-натриевый насос, создающий потенциал покоя или мембранный потенциал миокардиоцита, может быть инактивирован под действием сердечных гликозидов (препараты наперстянки, строфантина), которые приводят также к повышению внутриклеточной концентрации Na+, снижению интенсивности обмена внутриклеточного Са2+ на внеклеточный Na+, накоплению Са2+ в клетке. В результате сократимость миокарда становится больше. Ее можно увеличить и за счет повышения внеклеточной концентрации Са2+ и с помощью веществ (адреналин, норадреналин), ускоряющих вход Са2+ во время ПД. Если удалить Са2+ из внешней среды или заблокировать вход Са2+ во время ПД с помощью таких веществ - антагонистов кальция, как верапамил, нифедипин и др., то сократимость сердца уменьшается.
Клетки проводящей системы сердца и, в частности, клетки пейсмекера, обладающие автоматией, в отличие от клеток рабочего миокарда-кардиомиоцитов могут спонтанно деполяризоваться до критического уровня. В таких клетках за фазой реполяризации следует фаза медленной диастолической деполяризации (МДД), которая приводит к снижению МП до порогового уровня и возникновению ПД. МДД - это местное, нераспространяющееся возбуждение, в отличие от ПД, который является распространяющимся возбуждением.
Таким образом, пейсмекерные клетки отличаются от кардиомиоцитов: 1) низким уровнем МП - около 50 - 70 мВ, 2) наличием МДД 3) близкой к пикообразному потенциалу формой ПД, 4) низкой амплитудой ПД - 30 - 50 мВ без явления риверсии (овершута).
Особенности электрической активности пейсмекерных клеток обусловлены целым рядом процессов, происходящих на их мембране. Во-первых, эти клетки даже в условиях «покоя» имеют повышенную проницаемость для ионов Na+, что приводит к снижению МП. Во-вторых, в период реполяризации на мембране открываются только медленные натрий-кальциевые каналы, так как быстрые натриевые каналы из-за низкого МП уже инактивированы. В клетках синоатриального узла в период реполяризации быстро инактивируются открытые калиевые каналы, но повышается натриевая проницаемость, на фоне которой и возникает МДД, а затем и ПД. Потенциал действия синоатриального узла распространяется на все остальные отделы проводящей системы сердца.
Таким образом, синоатриальный узел навязывает всем «ведомым» отделам проводящей системы свой ритм. Если возбуждение не поступает от главного пейсмекера, то «латентные» водители ритма, т.е. клетки сердца, обладающие автоматией, берут на себя функцию нового пейсмекера, в них также зарождается МДД и ПД а сердце продолжает свою работу.
Автоматизм
Автоматия, т.е. генерация спонтанных ПД пейсмекерными клетками, обусловлена тем, что их мембранный потенциал не остается постоянным. В период диастолы в Р-клетках синоатриального узла происходит его медленное уменьшение. Это называется медленной диастолической деполяризацией (МДД). Когда ее величина достигает критического уровня, генерируется ПД, который по проводящей системе распространяется на все сердце. Возникает систола предсердий, а затем желудочков. МДД связана с постепенным нарастанием натриевой проницаемости мембраны атипических кардиомиоцитов. Истинными пейсмекерами является лишь небольшая группа Р-клеток синоатриального узла. Остальные Р-клетки проводящей системы являются латентными водителями ритма. Пока спонтанные ПД поступают из синоатриального узла, латентные пейсмекеры подчиняются его ритму. Это называется усвоением ритма. Но как только проведение нарушается, в них начинают генерироваться собственные спонтанные ПД. Поэтому при некоторых заболеваниях возникает патологическая импульсация в клетках проводящей системы, миокарде предсердий и желудочков. Такие очаги автоматии называют эктопическими, т.е. смещенными.
Сокращение кардиомиоцитов, как и других мышечных клеток, является следствием генерации ПД. В них, как и в скелетных миоцитах, имеется система трубочек саркоплазматического ретикулума, содержащих ионы кальция. При возникновении ПД эти ионы выходят из трубочек в саркоплазму. Начинается скольжение миофибрилл. Но в сокращении кардиомиоцитов принимают участие и ионы кальция, входящие в них в период генерации ПД. Они увеличивают длительность сокращения и обеспечивают пополнение запасов кальция в трубочках.
Функции проводящей системы сердца. Градиент автоматизма в проводящей системе сердца.
Узлы и пути проводящей системы сердца:
синоатриальный узел (Кейса-Флека). Он расположен в устье полых вен, т.е. в венозных синусах;
межузловые и межпредсердные проводящие пути Бахмана, Венкенбаха и Торелла. Проходят по миокарду предсердий и межпредсердной перегородке;
атриовентрикулярный узел (Ашоффа-Тавара). Находится в нижней части межпредсердной перегородки под эндокардом правого предсердия;
атриовентрикулярный пучок или пучок Гиса. Идет от атриовентрикулярного узла по верхней части межжелудочковой перегородки. Затем делится на две ножки – правую и левую. Они образуют ветви в миокарде желудочков;
волокна Пуркине. Это концевые разветвления ветвей ножек пучка Гиса. Образуют контакты с клетками сократительного миокарда желудочков.
Синоатриальный узел образован преимущественно Р-клеткми. Остальные отделы проводящей системы - переходными кардиомиоцитами. Однако небольшое количество клеток-пейсмекеров имеется и в них, а также сократительном миокарде предсердий и желудочков. Сократительные кардиомиоциты соединены с волокнами Пуркинье, а также между собой нексусами, т.е. межклеточными контактами с низким электрическим сопротивлением. Благодаря этому и примерно одинаковой возбудимости кардиомиоцитов, миокард является функциональным синцитием, т.е. сердечная мышца реагирует на раздражение как единое целое.
Роль различных отделов проводящей системы в автоматии сердца впервые была установлена Станниусом и Гаскеллом. Станниус накладывал лигатуры (перевязки) на различные участки сердца. Первая лигатура накладывается между венозным синусом, где расположен синоатриальный узел, и правым предсердием. После этого синус продолжает сокращаться в обычном ритме, т.е. с частотой 60-80 сокращений в минуту, а предсердия и желудочки останавливаются. Вторая лигатура накладывается на границе предсердий и желудочков. Это вызывает возникновение сокращений желудочков с частотой примерно в 2 раза меньшей, чем частота автоматии синусного узла, т.е. 30-40 в минуту. Желудочки начинают сокращаться из-за механического раздражения клеток атриовентрикулярного узла. Третья лигатура накладывается на середину желудочков. После этого их верхняя часть сокращается в атриовентрикулярном ритме, а нижняя с частотой в 4 раза меньше синусного ритма, т.е. 1520 в минуту.
Нормальная последовательность сокращений отделов сердца обусловлена особенностями проведения возбуждения по его проводящей системе. Возбуждение начинается в ведущем водителе ритма – синоатриальном узле. От него, по межпредсердным ветвям пучка Бахмана, возбуждение со скоростью 0,9-1,0 м/с распространяется по миокарду предсердий. Начинается их систола. Одновременно от синусного узла возбуждение по межузловым путям Венкенбаха и Торелла достигает атриовентрикулярного узла. В нем скорость проведения резко снижается до 0,02-0,05 м/с. Возникает атриовентрикулярная задержка. Т.е. проведение импульсов к желудочкам задерживается на 0,02-0,04 сек. Благодаря этой задержке, кровь во время систолы предсердий поступает в еще неначавшие сокращаться желудочки. От атриовентрикулярного узла по пучку Гиса, его ножкам и их ветвям возбуждение идет со скоростью 2-4 м/с. Благодаря такой высокой скорости оно одновременно охватывает межжелудочковую перегородку и миокард обоих желудочков. Скорость проведения возбуждения по миокарду желудочков 0,8-0,9м/с.
Гаскелл вызывал местное охлаждение узлов проводящей системы и установил, что ведущим водителем ритма сердца является синоатриалькый. На основании опытов Станниуса и Гаскелла, был сформулирован принцип убывающего градиента автоматии. Он гласит, что чем дальше центр автоматии сердца расположен от его венозного конца и ближе к артериальному, тем меньше его способность к автоматии. В нормальных условиях синоатриальный узел подавляет автоматию нижележащих, т.к. частота его спонтанной активности выше. Поэтому синоатриальный узел называют центром автоматии первого порядка, атриовентрикулярный – второго, а пучок Гиса и волокна Пуркинье – третьего.
Динамика возбудимости миокарда. Соотношение между механокардиограммой, потенциалом действия кардиомиоцита желудочка и изменением возбудимости миокарда.
В связи с тем, что сердечная мышца является функциональным синцитием, сердце отвечает на раздражение по закону "все или ничего". При исследовании возбудимости сердца в различные фазы сердечного цикла было установлено, что если нанести раздражение любой силы в период систолы, то его сокращения не возникает. Следовательно, во время систолы сердце находится в фазе абсолютной рефрактерности. В период диастолы на пороговые раздражения сердце не реагирует. При нанесении сверхпорогового раздражения возникает его сокращение, т.е. во время диастолы оно находится в фазе относительной рефрактерности. В начале общей паузы сердце находится в фазе экзальтации. При сопоставлении фаз потециала действия и возбудимости установлено, что фаза абсолютной рефрактерности совпадает с фазами деполяризации, быстрой начальной и замедленной реполяризации. Фазе относительной рефрактерности соответствует фаза быстрой конечной реполяризации. Продолжительность фазы абсолютной рефрактерности 0,25-0,3 сек, а относительной 0,03 сек. Благодаря большой длительности рефрактерных фаз, сердце может сокращаться только в режиме одиночных сокращений.
Характеристика стандартных, усиленных и грудных отведений ЭКГ. Природа зубцов и интервалов ЭКГ, их амплитудно-временные параметры.
Характеристика стандартных, усиленных и грудных отведений ЭКГ.
Биполярными являются стандартные отведения, предложенные Эйнтховеном, а униполярными усиленные отведения от конечностей.
Стандартных отведений три:
I отведение: правая и левая рука,
II: правая рука и левая нога,
III: левая рука и левая нога.
При усиленных отведениях регистрируется разность потенциалов между активным электродом на одной из конечности и индифферентным, образованным электродами на двух других конечностях. При отведении aVR активный электрод находится на правой руке, aVL – на левой, a aVF – левой ноге. Усиленные отведения служат для получения большей амплитуды элементов электрокардиограммы. Отведения от конечностей дают фронтальную проекцию распространения возбуждения.
Его горизонтальную проекцию отражают грудные униполярные отведения по Вильсону. Таких отведений шесть: V1 – четвертое межреберье у правого края грудины, V2 – четвертое межреберье у левого края грудины, V3 – точка между V2 и V4; V4 – в пятом межреберье по среднеключичной линии, V5 – на передней подмышечной линии, V6 – средней подмышечной линии.
Природа формирования ЭКГ-сигналов (зубцов и интервалов ЭКГ). Нормативы амплитудно-временных параметров ЭКГ.
Отражением электрических явлений, возникающих при распространении возбуждении в миокарде, является характерная кривая – электрокардиограмма, которая у практически здорового человека во II стандартном отведении состоит из направленных вверх зубцов P, R, T и вниз Q, S.
Зубец P – отражает процесс возбуждения предсердий и является алгебраической суммой потенциалов, возникающих в предсердиях при возбуждении. Продолжительность зубца P составляет 0,06-0,11 с, амплитуда 0,25 мВ.
Интервал P-Q – соответствует времени от начала возбуждения предсердий до начала возбуждения желудочков и отражает время, необходимое для проведения импульса из синоатриального узла по проводящей системе к сократительному миокарду желудочков. Измеряется от начала зубца P до начала Q. Продолжительность интервала составляет 0,12-0,20 с.
Зубец Q – отражает возбуждение межжелудочковой перегородки, правой сосочковой мышцы, основания правого желудочка, верхушки сердца. Его продолжительность составляет 0,03 с, амплитуда – 0,25 мВ.
Зубец R – отражает распространение возбуждения по боковым стенкам поверхностей обоих желудочков. Амплитуда зубца R во II отведении составляет 0,6-2 мВ.
Зубец S – соответствует периоду возбуждения обоих желудочков. Амплитуда зубца S составляет в среднем 0,6 мВ.
Комплекс QRS – отражает распространение возбуждения по желудочкам; ширину его определяет время последовательного распространения возбуждения по миокарду желудочков. Продолжительность комплекса составляет 0,06-0,1 с. Измеряется от начала зубца Q до конца зубца S. Амплитуда комплекса определяется по сумме амплитуды R и вниз направленных зубцов Q и S и должна превышать 0,5 мВ.
Сегмент ST – отражает период охвата возбуждением всего миокарда желудочков и период медленной реполяризации. Его длительность составляет от 0 до 0,15 с (в среднем 0,12 с). В норме этот сегмент изоэлектрический, в стандартных отведениях физиологическим считается смещение вверх до 1 мм.
Зубец Т – отражает процесс быстрой реполяризации обоих желудочков. Интервал QRST – отражает электрическую систолу желудочков и составляет от 0,24 до 0,55 с.
Интервал ТР – отражает электрическую диастолу сердца.
И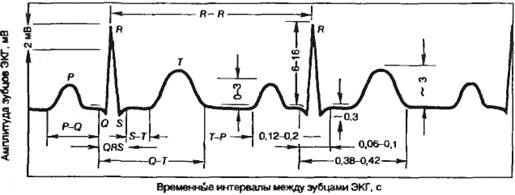 нтервалы
РР и RR отражают длительность сердечного
цикла.
нтервалы
РР и RR отражают длительность сердечного
цикла.
Нагнетательная функция сердца. Факторы наполнения камер сердца кровью и изгнания крови из камер сердца. Роль клапанного аппарата сердца.
Сокращение предсердий начинается в области устья полых вен, вследствие чего устья сжимаются. Поэтому кровь может двигаться только в одном направлении – в желудочки через предсердно-желудочковые отверстия. В этих отверстиях расположены атриовентрикулярныеклапаны: в левом желудочке находится двустворчатый (бикуспидальный) митральный клапан, в правом – трехстворчатый(трикуспидальный). В момент диастолы предсердий и последующей их систолы створки клапанов расходятся и пропускают кровь из предсердий в желудочки.
При сокращении желудочков кровь устремляется в сторону предсердий и захлопывает створки атриовентрикулярных клапанов. Открыванию створок клапанов в сторону предсердий препятствуют сухожильные нити, при помощи которых края створок прикрепляются к сосочковым мышцам, которые представляют собой пальцеобразные выросты внутреннего мышечного слоя стенки желудочков. Являясь частью миокарда желудочков, сосочковые мышцы сокращаются вместе с ними, натягивая сухожильные нити, которые удерживают створки клапанов.
Повышение давления в желудочках не только закрывает створчатые клапаны, но и обеспечивает открытие полулунных клапанов, которые расположены в устьях аорты и легочного ствола. Каждый из них состоит из трех лепестков, прикрепленных наподобие накладных карманов к внутренней поверхности указанных артериальных сосудов. Во время систолы желудочков выбрасываемая ими кровь прижимает эти лепестки к краям аорты и легочной артерии, что обеспечивает изгнание крови только в артериальные сосуды: из правого желудочка – в легочную артерию, из левого – в аорту. Во время диастолы желудочков в результате наличия разности давлений в указанных артериях и полостях желудочков кровь устремляется обратно в полости последних, наполняет лепестки полулунных клапанов и захлопывает их. Эти клапаны могут выдержать большое давление и не пропускают кровь из аорты и легочной артерии в желудочки.
Во время диастолы предсердий и желудочков кровь притекает из вен в предсердия и далее через атриовентрикулярные отверстия – в желудочки, происходит наполнение сердца кровью.
Первой причиной притока крови к сердцу является наличие остатка движущей силы, вызванной предыдущим сокращением сердца. Эта сила обуславливает наличие среднего давления в венах большого круга кровообращения около 7 мм рт. ст. В полостях сердца во время диастолы оно близко к нулю. Таким образом, градиент давления, обеспечивающий приток венозной крови к сердцу (венозный возврат), составляет всего 7 мм рт.ст. Это давление настолько мало, что любое препятствие току венозной крови может полностью прекратить доступ крови к сердцу. Так как сердце не имеет депо крови, то в систолу оно выбрасывает в артерии лишь ту кровь, которая притекает к нему в диастолу из вен. Поэтому прекращение венозного кровотока немедленно приводит к прекращению выброса крови в артериальную систему, а, следовательно, к падению артериального давления до нуля.
Вторая причина поступления крови в сердце – присасывание её грудной клеткой, особенно во время вдоха. Грудная клетка представляет собой герметически замкнутую полость, в которой вследствие эластической тяги лёгких существует отрицательное давление. В момент вдоха сокращение межрёберных и диафрагмальной мышц увеличивает объем этой полости: органы грудной полости, в частности полые вены, подвергаются растяжению, и давление в полых венах и предсердиях становится отрицательным. Это и обеспечивает присасывающий эффект.
Третья причина притока крови к сердцу – это сокращение скелетных мышц и наблюдающееся при этом наружное сдавливание вен конечностей и туловища. В венах имеются клапаны, пропускающие кровь только в одном направлении – к сердцу. Периодическое сдавливание вен вызывает систематическую подкачку крови к сердцу. Это, так называемая, венозная помпа обеспечивает значительное увеличение венозного притока к сердцу, а, следовательно, и увеличение сердечного выброса при физической нагрузке.
Четвёртая причина обеспечивается существованием механизма, непосредственно присасывающего кровь к сердцу. Он заключается в том, что во время систолы желудочков, когда уменьшается их продольный размер, предсердно-желудочковая перегородка оттягивается книзу. Это вызывает увеличение объема предсердий и, как результат, увеличение притока крови к ним из полых вен. Во время диастолы в желудочки притекает 70 % крови, при систоле предсердий подкачивается ещё около 30 %.
Периоды и фазы сердечного цикла, их продолжительность. Кровяное давление в предсердиях и желудочках в разные фазы сердечного цикла.
Систола (сокращение) предсердий
Перед началом систолы кровь движется к предсердиям, и они последовательно ею заполняются. Часть ее остается в этих камерах, остальная направляется в желудочки и попадает в них через атриовентрикулярные отверстия, которые не закрыты клапанами.
В этот момент и начинается систола предсердий. Стенки камер напрягаются, их тонус растет, давление в них повышается на 5-8 мм рт. столба. Просвет вен, которые несут кровь, перекрывается кольцевыми пучками миокарда. Стенки желудочков в это время расслаблены, их полости расширены, и кровь из предсердий быстро без затруднений устремляется туда через атриовентрикулярные отверстия. Продолжительность фазы – 0,1 секунды. Систола наслаивается на конец фазы диастолы желудочков. Мышечный слой предсердий довольно тонкий, поскольку им не требуется много силы для заполнения кровью соседних камер.
Систола (сокращение) желудочков
Это следующая, вторая фаза сердечного цикла и начинается она с напряжения мышц сердца. Фаза напряжения длится 0,08 секунд и в свою очередь делится еще на две фазы:
Асинхронного напряжения – длительностью 0,05 сек. Начинается возбуждение стенок желудочков, их тонус повышается.
Изометрического сокращения – длительностью 0,03 сек. В камерах растет давление и достигает значительных значений.
Свободные створки атриовентрикулярных клапанов, плавающих в желудочках, начинают выталкиваться в предсердия, но попасть туда они не могут из-за напряжения сосочковых мышц, которые натягивают сухожильные нити, удерживающие клапаны и препятствующие их попаданию в предсердия. В момент, когда клапаны смыкаются и сообщение между сердечными камерами прекращается, заканчивается фаза напряжения.
Как только напряжение станет максимальным, начинается период сокращения желудочков, продолжительностью 0,25 сек. Систола этих камер происходит как раз в это время. Около 0,13 сек. длится фаза быстрого изгнания – выброс крови в просвет аорты и легочного ствола, во время которого клапаны прилегают к стенкам. Это возможно, благодаря росту давления (до 200 мм ртутного столба в левом и до 60 в правом).
Остальное время приходится на фазу медленного изгнания: кровь выбрасывается под меньшим давлением и с меньшей скоростью, предсердия расслаблены, в них из вен начинает поступать кровь. Систола желудочков накладывается на диастолу предсердий.
Время общей паузы
Начинается диастола желудочков, и их стенки начинают расслабляться. Это длится в течение 0,45 сек. Период расслабления этих камер накладывается на еще продолжающуюся диастолу предсердий, поэтому эти фазы объединяют и называют общей паузой. Желудочек, сократившись, выгнал из своей полости кровь и расслабился. В нем образовалось разреженное пространство с давлением близким к нулю. Кровь стремится попасть обратно, но полулунные клапаны легочной артерии и аорты, смыкаясь, не дают ей этого сделать.
Кровяное давление в предсердиях и желудочках в разные фазы сердечного цикла.
Величина кровяного давления различна для каждой камеры сердца и изменяется в разные моменты сердечного цикла. Она зависит от степени кровенаполнения камер, сократительной функции миокарда и величины сопротивления путей оттока крови, а также ряда других кардиальных и экстракардиальных факторов — радиуса кривизны камер сердца, степени натяжения соединительнотканной основы сердца, внутригрудного давления. Регистрация изменений кровяного давления во времени в виде кривых давления в полостях сердца позволяет охарактеризовать состояние внутрисердечной гемодинамики и кровообращения в целом и получить необходимую информацию о степени и характере нарушений насосной функции сердца при различных патологических состояниях Изменение давления в аорте, левом желудочке и левом предсердии в процессе сердечнго цикла
И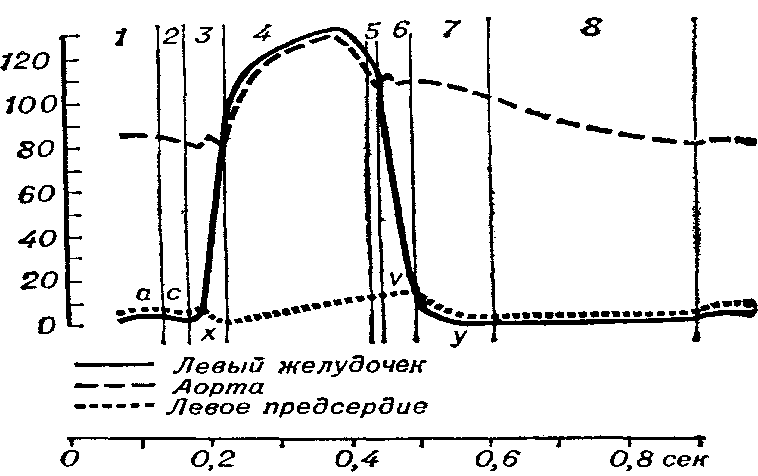 зменение
давления в аорте, левом желудочке и
левом предсердии в процессе сердечного
цикла: 1 — фаза наполнения, обусловленная
систолой предсердий; 2 — фаза асинхронного
сокращения; 3 — фаза изометрического
сокращения; 4 — фаза изгнания; 5 —
протодиастолический период; 6 — фаза
изометрического расслабления; 7 — фаза
быстрого наполнения; 8 — фаза медленного
наполнения; а, с, x, v и у — волны
внутрисердечного давления: а — развивается
во время систолы предсердий; с — возникает
в момент закрытия атрио-вентрикулярных
клапанов; x — связана с расслаблением
миокарда предсердий; v — обусловлена
притоком крови из легочных и полых вен;
у — развивается в начале диастолического
наполнения желудочков. По оси ординат
—величина давления. Внизу — отметчик
времени.
зменение
давления в аорте, левом желудочке и
левом предсердии в процессе сердечного
цикла: 1 — фаза наполнения, обусловленная
систолой предсердий; 2 — фаза асинхронного
сокращения; 3 — фаза изометрического
сокращения; 4 — фаза изгнания; 5 —
протодиастолический период; 6 — фаза
изометрического расслабления; 7 — фаза
быстрого наполнения; 8 — фаза медленного
наполнения; а, с, x, v и у — волны
внутрисердечного давления: а — развивается
во время систолы предсердий; с — возникает
в момент закрытия атрио-вентрикулярных
клапанов; x — связана с расслаблением
миокарда предсердий; v — обусловлена
притоком крови из легочных и полых вен;
у — развивается в начале диастолического
наполнения желудочков. По оси ординат
—величина давления. Внизу — отметчик
времени.
Большинство авторов на кривой давления в предсердии выделяет три положительные волны — а, с и v и две отрицательные волны (коллапса) — х и у (рис.). Начало волны а по времени совпадает с серединой или последней третью зубца P на ЭКГ. При нарушениях систолической деятельности предсердий, что имеет место, например, у больных с мерцательной аритмией, волна а на кривой давления отсутствует. Волна с возникает в момент закрытия атрио-вентрикулярных клапанов, т.е. в начале систолы желудочка. Причина возникновения волны с — толчкообразное выпячивание митрального клапана в предсердие в начале изометрического сокращения желудочка. Волна х связана с понижением давления и по времени соответствует периоду расслабления миокарда предсердия. Основной причиной появления волны х считается увеличение объема предсердий вследствие расслабления мышечных волокон. За время волны х давление в предсердии достигает атмосферного или снижается на несколько миллиметров ртутного столба. В дальнейшем волна х сменяется волной v, которая обусловлена увеличением притока крови в предсердия из легочных и полых вен. Волна у следует после пика волны v и ее начало во времени совпадает с моментом открытия атрио-вентрикулярных клапанов и началом диастолического наполнения желудочков. В этот период внутрипредсердное давление снижается параллельно со снижением давления в левом желудочке до конечного диастолического давления (конечное диастолическое давление — давление в полостях желудочков непосредственно перед закрытием атрио-вентрикулярных клапанов). За волной у следует полого возрастающая часть кривой внутрипредсердной давления. Для заполнения кровью левого предсердия, упруго-эластические свойства к-рого более высоки, чем правого предсердия, необходимо более высокое давление. Согласно имеющимся в литературе данным, полученным при зондировании сердца здоровых людей, в левом предсердии средняя величина волны, а составляет 10—11 мм рт. ст., волны v —12 —14 мм рт. ст. Среднее давление в левом предсердии, равное интегральной величине всех колебаний, находится в диапазоне 8—9 мм рт. ст., в правом предсердии — составляет 3 мм рт. ст.
В экспериментах установлено, что кривая зависимости внутрипредсердного давления от объема наполнения предсердий сохраняет линейный характер до 9—11 мм рт. ст. При дальнейшем увеличении объема прирост внутрипредсердного давления происходит в значительно большей степени.
Механические (верхушечный толчок) и звуковые (тоны сердца) проявления деятельности сердца: их происхождение. Основные точки выслушивания тонов сердца при его аускультации.
Механические (верхушечный толчок) и звуковые (тоны сердца) проявления деятельности сердца: их происхождение.
Деятельность сердца сопровождается механическими и звуковыми явлениями.
К механическим проявлениям активности сердца относится верхушечный толчок – это ритмическое выбухание кожи грудной клетки в пятом межреберье на 1 см кнутри от среднеключичной линии. Он возникает вследствие того, что во время систолы желудочков сердца укорачивается, поворачивается вокруг своей оси и прижимается верхушкой к грудной клетке.
Верхушечный толчок регистрируется с помощью механоэлектрического датчика. Он находится в точке толчка сердца; сигналы от него идут на электрокардиограф.
Кроме этого к механическим проявлениям сердечной деятельности относится ряд феноменов:
динамокардиография – регистрация колебаний центра тяжести грудной клетки, возникающих в результате работы сердца;
баллистокардиография – регистрация смещения тела в горизонтальной плоскости в результате выброса крови из желудочков в магистральные сосуды.
Звуковые проявления нормальной сердечной деятельности называются тонами сердца – это клинический термин, отличающий их от патологических звуков, шумов.
Простым методом исследования звуковых проявлений является аускультация – выслушивание с помощью фонендоскопа. Достоинством является ненужность приборов.
Обычно можно выслушать 2 тона: I и II. I тон глухой, низкий и продолжительный – 0,12-0,16 сек. Он совпадает с систолой желудочков и называется систолическим. Лучше всего выслушивается на верхушке сердца, т.е. в 5 межреберье на 1-1,5 см от среднеключичной линии. Возникает в момент захлапывания атриовентрикулярного клапана. Он обусловлен колебанием створок, сухожильных нитей и стенок желудочка. Основную роль в его происхождении играет митральный клапан.
II тон более высокий, короткий и громкий. Длительность 0,07-0,1 сек, он совпадает диастолой желудочков – диастолический. Его возникновение обусловлено колебаниями пульмонального клапана в момент его закрытия, т.е. в начале диастолы.
У здоровых детей часто удается выслушать еще 2 тона: III и IV. Появление III связано с растяжением стенки левого желудочка при его быстром пассивном наполнении кровью. IV тон обусловлен ускоренным движением крови в левый желудочек при систоле левого предсердия. Эти тоны лучше слышны на верхушке сердца.
Появление дополнительных тонов у взрослых чаще связано с патологическими изменениями. Например, III тон может выслушиваться при дефектах межжелудочковой перегородки.
Выслушивание сердца обычно начинается со второго межреберья слева от грудины, где громкость всех тонов наибольшая. После этого прослушивается второе межреберье справа от грудины, там находится проекция атриовентрикулярного клапана.
Пульмональный клапан выслушивается в точке Боткина в 3 межреберье слева от грудины или от основания мечевидного отростка. Митральный прослушивается на верхушке сердца, т.е. в 5 межреберье на 1,-1,5 см от среднеключичной линии.
Основные точки выслушивания тонов сердца при его аускультации.
Стандартные эхо-КГ позиции:
Парастернальный доступ – область III-V межреберья слева от грудины.
Верхушечный (апикальный) доступ – зона верхушечного толчка.
Субкостальный доступ – область над мечевидным отростком.
Супрастернальный доступ – югулярная ямка.
Функции разных видов кровеносных сосудов. Линейная и объемная скорости кровотока, соотношение между ними в разных сосудах.
Все сосуды малого и большого круга, в зависимости от строения и функциональной роли делят на следующие группы:
- Сосуды эластического типа: аорта, легочная артерия и другие крупные артерии. В их стенке содержится много эластических волокон, поэтому она обладает большой упругостью и растяжимостью.
- Сосуды мышечного типа: артерии среднего и малого калибра. В их стенке больше гладкомышечных волокон. Однако мышечный слой мало влияет на просвет этих сосудов, а, следовательно, на гемодинамику.
- Сосуды резистивного типа: концевые артерии и артериолы. Эти прекапиллярные сосуды имеют небольшой диаметр и толстую гладкомышечную стенку. Поэтому они оказывают наибольшее сопротивление току крови и влияние на системную гемодинамику. Сокращения их гладких мышц обеспечивают регуляцию кровотока в органах и тканях, а, следовательно, перераспределение крови.
- Сосуды обменного типа: капилляры. В них происходит диффузия и фильтрация воды, газов, минеральных и питательных веществ.
- Сосуды емкостного типа.
К емкостным сосудам относятся вены. Их стенка легко растягивается. Поэтому они способны накапливать большое количество крови, без изменения венозного кровотока. В связи с этим вены некоторых органов могут выполнять роль депо крови. Это вены печени, подкожных сосудистых сплетений, чревные вены. В венах может депонироваться до 70% всей крови. Истинных депо, как селезенка собаки, у человека нет. Кроме этих типов имеются шунтирующие сосуды. Ими являются артериовенозные анастомозы. При некоторых условиях они обеспечивают переход крови в вены минуя капилляры.
Основной функцией артерий является создание постоянного напора, под которым кровь движется по капиллярам. Уровень кровяного давления определяется нагнетающей силой сердца (главный), периферическим сопротивлением сосудов, объемом крови.
Основная задача артерий – доставка кислорода и других питательных веществ к органам и тканям. От того насколько эффективно сосуды справляются с этой задачей, зависит и то, как будет работать весь организм. Если по каким-то причинам артериальная кровь снабжает ткани недостаточным количеством кислорода, наступает кислородное голодание (гипоксия), которое может приводить к тяжелым поражениям органов и даже некрозу. Особенно чувствительны в этом плане сердце и мозг. Если коронарные (сердечные) артерии работают со сбоями, может возникнуть сердечная недостаточность, развиться ишемическая болезнь сердца или произойти инфаркт миокарда. Продолжительная гипоксия головного мозга приводит к смерти, а частичная вызывает спутанность сознания, головокружения, обмороки. Гипоксия плода во время патологических родов может приводить к гибели или серьезным поражениям центральной нервной системы. А в том случае если кислород не поступал в достаточном количестве во время вынашивания ребенка, он родится с отставанием в развитии. Большинство сосудов парные – то есть существуют аналогичные левая и правая артерия. К таким относятся артерии конечностей, бедренные, позвоночные, мозговые и другие сосуды. Среди непарных самой известной является центральная артерия аорта. Также артерии делятся на:
Анастомозирующие, то есть такие, которые имеют соединения с соседними сосудистыми стволами.
Конечные, без сочленений. Такой тип артерий наиболее подвержен закупорке тромбом с последующим инфарктом – омертвением части органа.
Основной функцией вен является обеспечение оттока крови, насыщенной углекислым газом и продуктами распада. Кроме этого, в кровеносную систему по венам попадают различные гормоны из желез внутренней секреции и питательные вещества из желудочно-кишечного тракта. Вены регулируют общее и местное кровообращение.
Линейная и объемная скорости кровотока, соотношение между ними в разных сосудах.
Линейная скорость кровотока (VЛИН.) – это расстояние, которое проходит частица крови в единицу времени. Она зависит от суммарной площади поперечного сечения всех сосудов, образующих участок сосудистого русла. В кровеносной системе наиболее узким участком является аорта. Здесь наибольшая линейная скорость кровотока, составляющая 0,5-0,6 м/сек. В артериях среднего и мелкого калибра она снижается до 0,2-0,4 м/сек. Суммарный просвет капиллярного русла в 500-600 раз больше, чем аорты. Поэтому скорость кровотока в капиллярах уменьшается до 0,5 мм/сек. Замедление тока крови в капиллярах имеет большое физиологическое значение, так как в них происходит транскапиллярный обмен. В крупных венах линейная скорость кровотока вновь возрастает до 0,1-0,2 м/сек. Линейная скорость кровотока в артериях измеряется ультразвуковым методом. Он основан на эффекте Доплера. На сосуд помещают датчик с источником и приемником ультразвука. В движущейся среде – крови – частота ультразвуковых колебаний изменяется. Чем больше скорость течения крови по сосудам, тем ниже частота отраженных ультразвуковых волн. Скорость кровотока в капиллярах измеряется под микроскопом с делениями в окуляре, путем наблюдения за движением определенного эритроцита.
Объемная скорость кровотока (VОБ.) – это количество крови, проходящей через поперечное сечение сосуда в единицу времени. Она зависит от разности давлений в начале и конце сосуда и сопротивления току крови. Раньше в эксперименте объемную скорость кровотока измеряли с помощью кровяных часов Людвига. В клинике объемный кровоток оценивают с помощью реовазографии. Этот метод основан на регистрации колебаний электрического сопротивления органов для тока высокой частоты, при изменении их кровенаполнения в систолу и диастолу. При увеличении кровенаполнения сопротивление понижается, а уменьшении – возрастает. С целью диагностики сосудистых заболеваний производят реовазографию конечностей, печени, почек, грудной клетки. Иногда используются плетизмографию – это регистрация колебаний объема органа, возникающих при изменении их кровенаполнения. Колебания объема регистрируют с помощью водных, воздушных и электрических плетизмографов. Скорость круговорота крови – это время, за которое частица крови проходит оба круга кровообращения. Ее измеряют путем введения красителя флюросцина в вену одной руки и определения времени его проявления в вене другой. В среднем скорость кругооборота крови составляет 20-25 сек.
Артериальное давление крови (АД). Волны АД 1-го, 2-го и 3-го порядка, их происхождение. Гемодинамические факторы, определяющие величину АД.
Артериальное давление крови (АД). Гемодинамические факторы, определяющие величину АД.
Давление крови движущейся по сосудам на их стенки называется кровяным давлением (артериальное и венозное).
Артериальное давление – один из важнейших параметров системы кровообращения, отражающий:
-деятельность сердца;
-упругое сопротивление растяжению стенок аорты и артерий;
-суммарное сопротивление кровотоку;
-вязкость крови;
-гидростатическое давление крови.
Уровень артериального давления определяют три основных фактора: фактор сердца (частота и сила сокращений), фактор сосудов (просвет сосудов), фактор крови (объем циркулирующей крови, ее реологические свойства).
После приема пищи наблюдается небольшое (на 6-8 мм) повышение систолического давления. Эмоциональное возбуждение (гнев, испуг) значительно повышают АД, преимущественно систолическое. Это повышение обусловлено усиленной деятельностью сердца, а также сужением сосудистого русла. Изменения эти наступают частью рефлекторно, частью под влиянием гуморальных сдвигов - поступления адреналина в кровь. После приема пищи наблюдается небольшое (на 6-8 мм) повышение систолического давления. Эмоциональное возбуждение (гнев, испуг) значительно повышают АД, преимущественно систолическое. Это повышение обусловлено усиленной деятельностью сердца, а также сужением сосудистого русла. Изменения эти наступают частью рефлекторно, частью под влиянием гуморальных сдвигов - поступления адреналина в кровь. После приема пищи наблюдается небольшое (на 6-8 мм) повышение систолического давления. Эмоциональное возбуждение (гнев, испуг) значительно повышают АД, преимущественно систолическое. Это повышение обусловлено усиленной деятельностью сердца, а также сужением сосудистого русла. Изменения эти наступают частью рефлекторно, частью под влиянием гуморальных сдвигов - поступления адреналина в кровь.
1. Работа сердца. Изменение систолического объема. Повышение систолического объема увеличивает максимальное и пульсовое давление. Уменьшение будет приводить к снижению и уменьшению пульсового давления.
2. Частота сокращений сердца. При более частом сокращении давление прекращается. При этом начинает возрастать минимальное диастолическое.
3. Сократительная функция миокарда. Ослабление сокращения сердечной мышцы приводит к снижению давления.
Волны артериального давления 1-го, 2-го, 3-го порядка, их происхождение.
При длительной графической регистрации артериального давления обнаруживается три типа его колебаний. Их называют волнами 1-го, 2-го и 3-го порядков.
- Волны первого порядка (пульсовые)- обусловлены повышением давления в сосудах в систолу и снижением в диастолу. В период изгнания крови из сердечных желудочков наблюдается увеличение давления в аорте, а также в легочной артерии. Оно повышается и достигает максимальной отметки – 140 и 40 мм.рт.ст. Такое давление является максимальным либо систолическим, его фиксируют буквосочетанием СД. Во время диастолы (расширения полостей сердца) сердце не получает крови из артериальной системы, происходит только отток ее из крупных артерий в область капилляров. Соответственно в этот момент давление в артериях снижается до минимума, его классифицируют как минимальное либо диастолическое, и обозначают буквосочетанием ДД. Уровень этого показателя во многом зависит от просвета и тонуса сосудов, и в среднем равен 60-80 мм.рт.ст. Разница между показателями систолического и диастолического давления – это пульсовое давление, именно оно обеспечивает возникновение систолической волны (волны первого порядка) на кимограмме. Обычно пульсовое давление равно 30-40 мм.рт.ст. Этот показатель прямо пропорционален ударному объему сердца и указывает на силу сердечных сокращений, ведь чем большее количество крови сердце отправит в систолу, тем большим будет уровень пульсового давления. Максимального значения пульсовое давление достигает в сосудах, которые расположены около сердца, а именно, в аорте, а также в крупных артериях. В небольших артериях интервал между систолическим и диастолическим давлением несколько сглаживается, а в артериолах (как и в капиллярах) давление является постоянным и не зависит от систолы и диастолы. Такая особенность организма важна для стабильности обменных процессов, которые происходят между кровью, проходящей сквозь капилляры, и тканями, окружающими их. Количество волн первого порядка равно ЧСС (частоте сердечных сокращений).
- Волны второго порядка – (дыхательные) у человека вдох сопровождается понижением АД, а выдох — повышением. Их количество равно числу дыхательных движений. В каждой волне ІІ порядка состоит несколько волн І порядка. Они имеют довольно сложный механизм возникновения: во время вдоха в нашем организме создаются оптимальные условия, обеспечивающие поступление крови с большого круга кровообращения внутрь малого. Это объясняется увеличением емкости легочных сосудов, а также некоторым уменьшением их сопротивляемости кровотоку, большим поступлением крови с правого желудочка сердца в легкие. Кроме того, этому способствует наличие разницы давлений между сосудами в брюшной полости и грудной клетки, эта разница возникает при повышении отрицательного давления внутри плевральной полости и при опускании диафрагмы и выдавливанием ней крови с венозных сосудов в кишечнике и печени. Описанные механизмы создают условия для хранения крови в легочных сосудах и для снижения объемов ее выхода с легких внутрь левой половины сердца. Таким образом, на максимальном вдохе наблюдается снижение притока крови к сердцу и закономерное снижение артериального давления. А ближе к окончанию выдоха показатели артериального давления увеличиваются. Это механические факторы, которые объясняют формирование волн ІІ порядка. Но они зависят и от нервных факторов. Так изменение активности дыхательного центра, которое наблюдается при вдохе, приводит к повышению активности сосудодвигательного центра, что повышает тонус сосудов в большом круге кровообращения. Кроме того, колебания объемов кровотока также способны вторично провоцировать повышение-снижение кровяного давления, так как происходит активация сосудистых рефлексогенных зон.
- Волны третьего порядка - обусловлены периодическими изменениями тонуса сосудодвигательного центра. Они представляют собой еще более медленное повышение и понижение показателей давления. Каждая из них охватывает несколько дыхательных волн ІІ порядка. Волны ІІІ порядка частенько появляются по причине недостаточного снабжения мозга кислородом (высотной гипоксии), после перенесенной кровопотери либо отравления несколькими ядами.
Артериальный пульс. Характеристики пальпаторной оценки артериального пульса. Происхождение компонентов сфигмограммы.
Артериальным пульсом называются ритмические колебания артериальных стенок, обусловленные прохождением пульсовой волны.
Пульсовая волна – это расширение артерий в результате систолического повышения артериального давления. Пульсовая волна возникает в аорте во время систолы, когда в нее выбрасывается систолическая порция крови и ее стенка растягивается. Так как пульсовая волна движется по стенке артерий, скорость ее распространения не зависит от линейной скорости кровотока, а определяется морфофункциональным состоянием сосуда. Чем больше жесткость стенки, тем больше скорость распространения пульсовой волны и наоборот. Поэтому у молодых людей она составляет 7-10 м/сек, а у старых, из-за атеросклеротических изменений сосудов, она возрастает. Самым простым методом исследования артериального пульса является пальпаторный. Обычно пульс прощупывается на лучевой артерии путем прижатия ее к подлежащей лучевой кости. Так как характер пульса в основном зависит от деятельности сердца и тонуса артерий, по пульсу можно судить об их состоянии.
Обычно определяют его следующие параметры:
- частота пульса. В норме 60-80 уд/мин;
- ритмичность. Если интервалы между пульсовыми волнами одинаковы, пульс ритмичный;
- скорость пульса. Это быстрота пульсового повышения и понижения давления. При патологии может наблюдаться быстрый или медленный пульс;
- напряжение пульса. Определяется силой, которую необходимо приложить для того, чтобы пульс прекратился. Например, при артериальной гипертензии наблюдается напряженный пульс;
- наполнение. Складывается из высоты пульсовой волны и частично напряжения пульса. Зависит от величины систолического объема крови. Если сила сокращений левого желудочка падает, пульс становится слабым.
Объективное исследование пульсовой волны осуществляют с помощью сфигмографии.
Сфигмограмма. Происхождение компонентов сфигмограммы.
Это метод графической регистрации пульса. Сфигмография позволяет рассчитать такие физиологические показатели, как скорость распространения пульсовой волны, упругость и эластическое сопротивление артериального русла, а также диагностировать некоторые заболевания сердца и сосудов. В клинике используют объемную и чаще прямую сфигмографию. Это непосредственная регистрация колебания стенки артерии. Для этого на артерию накладывают датчик, преобразующий механические колебания в электрический сигнал, который подается на электрокардиограф. Если производится сфигмография сонных или подключичиных артерий, получают центральные сфигмограммы, а если бедренной, лучевой, локтевой – перифирические.
Периферическая сфигмограмма является периодической кривой, на которой выделяют следующие элементы:
- восходящая часть (CD), называется анакротой: она отражает рост артериального давления в период систолы под влиянием крови, выброшенной из сердца в начале фазы изгнания;
- снижение пульсовой волны (DF) – катакрота: свидетельствует о диастолическом понижении давления в конце систолы желудочка давление;
- инцизура (F): желудочек начинает расслабляться и давление в его полости становится ниже, чем в аорте, кровь, устремляется назад к желудочку; давление в артериях резко падает и на пульсовой кривой крупных артерий появляется глубокая выемка;
 -
дикротический подъем (FH): бусловлен
вторичным повышением артериального
давления в результате удара возвращающегося
к сердцу потока крови о закрывшийся
аортальный клапан, волна крови отражается
от клапанов и создает вторичную волну
повышения давления.
-
дикротический подъем (FH): бусловлен
вторичным повышением артериального
давления в результате удара возвращающегося
к сердцу потока крови о закрывшийся
аортальный клапан, волна крови отражается
от клапанов и создает вторичную волну
повышения давления.
Факторы венозного возврата крови к сердцу. Венный пульс (флебограмма). Происхождение зубцов флебограммы.
Функции венозных сосудов. Факторы венозного возврата крови к сердцу.
Основной функцией вен является обеспечение оттока крови, насыщенной углекислым газом и продуктами распада. Кроме этого, в кровеносную систему по венам попадают различные гормоны из желез внутренней секреции и питательные вещества из желудочно-кишечного тракта. Вены регулируют общее и местное кровообращение.
Процесс циркуляции крови по венам и по артериям сильно разнится. В артерии кровь попадает под давлением сердца во время его сокращения (около 120 мм рт. ст.), в венах же давление составляет лишь 10 мм рт. ст. Движение крови в венах происходит прежде всего вследствие разности давления крови в мелких и крупных венах (градиент давления), т. е. в начале и конце венозной системы. Эта разность, однако, невелика, и потому кровоток в венах определяется рядом добавочных факторов. Одним из них является то, что эндотелий вен образует клапаны, пропускающие кровь только по направлению к сердцу. Скелетные мышцы, сокращаясь, сдавливают вены, что вызывает передвижение крови; обратно кровь не идет вследствие наличия клапанов. Этот механизм перемещения крови в венах называют мышечным насосом.
Вспомогательные факторы:
1. замкнутость сердечно-сосудистой системы;
2. разность давления в аорте и полых венах;
3. эластичность сосудистой стенки (превращение пульсирующего выброса крогви из сердца в непрерывный кровоток);
4. клапанный аппарат сердца и сосудов, обеспечивающий однонаправленное движение крови;
5. наличие внутригрудного давления - "присасывающее" действие, обеспечивающее венозный возврат крови к сердцу.
Факторы, участвующие в формировании венозного возврата
1 группа представлена факторами, которые объединяет общий термин «vis a tegro», действующие сзади.
- 13% энергии сообщенной потоку крови сердцем
- сокращение скелетной мускулатуры («мышечное сердце», «мышечная венозная помпа»)
- переход жидкости из ткани в кровь в венозной части капилляров
- наличие клапанов в крупных венах препятствует обратному току крови
- констрикторные (сокротительные) реакции венозных сосудов на нервные и гуморальные воздействия
2 группа представлена факторами, которые объединяет общий термин «vis a fronte», действующие спереди:
- присасывающая функция грудной клетки (при вдохе отрицательно давление в плевральной полости увеличивается и это приводит снижению центрального венозного давления- ЦВД, т.е. к ускорению кровотока в венах)
- присасывающая функция сердца осуществляется за счет понижения давления в правом предсердии (ЦВД) до нуля в диастолу.
Снижение ЦВД до –4 мм.рт.ст. ведет усилению венозного возврата, а далее не влияет, при ЦВД более12 мм.рт.ст. венозный возврат крови к сердцу тормозиться. Изменение венозного давления на несколько мм.рт.ст. ведут к увеличению притока крови в 2-3 раза
От венозного возврата крови к сердцу зависит наполнение крови сердца в диастолу (конечнодиастолический объем), а значит, это опосредовано влияет, особенно при нагрузках, на величину ударного объема через изменение резервного объема, и как следствие, - на величину МОК. Эти изменение приводят к соответствующим изменениям АД.
Венный пульс (флебограмма). Происхождение зубцов флебограммы.
В крупных венах (чаще всего яремных венах) вблизи сердца отмечаются пульсовые колебания — венный пульс. Обусловлен затруднением притока крови из вен в сердце во время систолы предсердий и желудочков, давление внутри вен повышается и происходят колебания их стенок.
Запись венного пульса называется флебограммой. Компоненты:
- а – систола правого предсердия, сопровождается затруднением оттока из вен
- с – возникает в начале систолы правого желудочка при закрытии трехстворчатого клапана
- х – отражает ускоренный отток крови из магистральных вен в расслабляющееся предсердие
- v – повышение давления при закрытом трехстворчатом клапане в результате наполнения правого предсердия и затруднения оттока крови из вен
-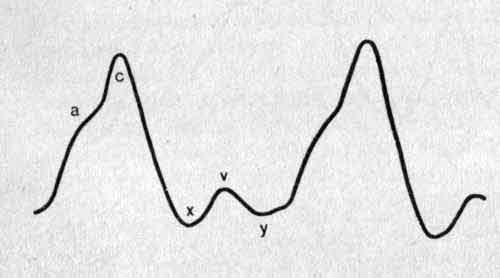 у – обусловлена быстрым поступлением
крови из правого предсердия в желудочек
во время общей диастолы сердца (волна
диастолического коллапса)
у – обусловлена быстрым поступлением
крови из правого предсердия в желудочек
во время общей диастолы сердца (волна
диастолического коллапса)
Функциональные особенности коронарного кровообращения.
Венечные артерии сердца берут свое начало от корня аорты неподалеку от заслонок ее клапана. Они отходят от правого и левого аортального синуса.
Правая ветвь питает почти весь правый желудочек и заднюю стенку левого, небольшой участок перегородки. Весь остальной миокард снабжается левой венечной ветвью. Она имеет от двух до четырех отходящих артерий, из которых самые важные – это нисходящая и огибающая.
Первая является прямым продолжением левой коронарной артерии и проходит до верхушки, а вторая расположена под прямым углом к основной, направляется спереди назад, огибая сердце.
Питание миокарда определяется задней межжелудочковой артерией. Она может отходить от правой или огибающей ветви левой.
В зависимости от этого тип кровоснабжения называют соответственно правым или левым. Почти у 70% людей отмечается первый вариант, 20% имеют смешанную систему, а остальные – левый тип доминантности. кровообращение человека.
Венозный отток проходит по трем сосудам – большая, малая и средняя вены. Они забирают от тканей примерно 65% крови, сбрасывают ее в венозный синус, а затем через него в правое предсердие.
Остальная часть проходит по наименьшим венам Вьессена-Тебезия и передним венозным ветвям.
Таким образом, схематично движение крови проходит через: аорту – общую венечную артерию – ее правую и левую ветви – артериолы – капилляры – венулы – вены – коронарный синус – правую половину сердца.
На питание сердца в покое расходуется от 4% всего выброса крови в аорту. При высокой физической или эмоциональной нагрузке он увеличивается в 3 — 4 раза, а иногда и больше. Скорость движения крови по венечным артериям зависит от:
артериального давления;
частоты сокращений сердца;
преобладания тонуса симпатической или парасимпатической нервной системы;
интенсивности обменных процессов.
Основное поступление артериальной крови к сердечной мышце левого желудочка происходит в период расслабления сердца, только небольшая часть (около 14 — 17%) поступает во время систолы, как и ко всем внутренним органам. Для правого желудочка зависимость от фаз сердечного цикла не настолько существенная. При сердечном сокращении венозная кровь под действием мышечного сжатия оттекает от миокарда. Сердечная мышца имеет отличия от скелетной мускулатуры. Особенностями ее кровообращения являются:
количество сосудов в миокарде вдвое больше, чем у остальной мышечной ткани;
питание кровью лучше при диастолическом расслаблении, чем чаще сокращения, тем хуже приток кислорода и энергетических соединений;
хотя артерии имеют множество соединений, но их бывает недостаточно для компенсации закупоренного сосуда, что приводит к инфаркту;
артериальные стенки из-за высокого тонуса и растяжимости могут обеспечивать повышенный кровоток в миокарде при нагрузках.
Регуляция малого коронарного круга
Сильнее всего коронарные артерии реагируют на дефицит кислорода. При гипоксии образуются недоокисленные продукты обмена веществ, которые стимулируют расширение сосудистого просвета.
Кислородное голодание бывает абсолютным – при спазме артериальной ветви или закупорке атеросклеротической бляшкой, тромбом, эмболом снижается поступление крови. При относительном недостатке проблемы с питанием клеток возникают только при повышенной потребности, когда нужно увеличить частоту и силу сокращений, а резервной возможности для этого нет. Так возникают приступы боли в сердце при ишемической болезни в ответ на физическую нагрузку или эмоциональный стресс.
Венечные артерии сердца также получают импульсы от вегетативной нервной системы. Блуждающий нерв, парасимпатический отдел и его проводник (медиатор) ацетилхолин расширяет сосуды. Одновременно со снижением тонуса артерий падает и сократительная способность миокарда. Действие симпатического отдела, выброса гормонов стресса проявляется не так однозначно. Стимуляция альфа-адренорецепторов сужает сосуды, а бета-адренергическая их расширяет. Конечным результатом такого разнонаправленного эффекта является активизация коронарного кровотока при хорошей проходимости артериальных путей.
Функциональные особенности мозгового кровообращения.
Кровоснабжение мозга осуществляется двумя внутренними сонными и двумя позвоночными артериями, а отток крови происходит по двум яремным венам. Магистральные артерии соединяются в обширный анастомоз – виллизиев круг. Вены образуют систему синусов. Отходящие от него крупные артерии образуют сеть овальных сосудов. Эта сеть вместе с пиальными венами формирует мягкую мозговую оболочку. От пиальных сосудов вглубь мозга идут мелкие радиальные артерии; которые переходят в капиллярную сеть. Большое количество артерий и анастомозов обеспечивают высокую надежность системы кровоснабжения мозга.
В основном сосуды иннервируются симпатическими нервами, хотя имеется и холинэргическая иннервация. Через сосуды мозга в покое проходит 15% минутного объема крови. Мозг потребляет до 20% всего кислорода и 17% глюкозы.
Он очень чувствителен к гипоксии и гипогликемии, а, следовательно, к ухудшению кровотока. За счет механизмов саморегуляции сосуды мозга способны поддерживать его нормальный уровень в широком диапазоне колебаний АД. Однако при его подъеме выше 180 мм рт.ст. возможно резкое расширение артерий мозга, увеличение проницаемости гематоэнцефалического барьера и отек мозга.
Тонус сосудов мозга регулируется миогенными, гуморальными и нейрогенными механизмами. Миогенный проявляется сокращением гладких мышц сосудов при повышении кровяного давления и наоборот расслаблением при его понижении. Он стабилизирует быстрые колебания кровотока. В частности, при изменениях положения тела. Нервная регуляция осуществляется симпатическими нервами, которые кратковременно и незначительно суживают сосуды. Основная роль принадлежит гуморальным факторам, в первую очередь метаболическим. Увеличение концентрации углекислоты в крови сопровождается выраженным расширением сосудов мозга. Подобным же действием обладают катионы водорода, поэтому сдвиг реакции крови в кислую сторону приводит к вазодилатации. При гипервентиляции содержание СО2 падает, сосуды мозга суживаются, мозговой кровоток уменьшается. Возникают головокружение, спутанность сознания, судороги и т.д. Аденозин, брадикинин, гистамин расширяют сосуды. Вазопрессин, серотонин, ангиотензин суживают их.
Функциональные особенности легочного кровообращения.
Существенной особенностью сосудистой системы легких является то, что она включает сосуды малого круга и бронхиальные артерии большого. Первые служат для газообмена, вторые обеспечивают кровоснабжение ткани легких. У человека между ними имеются анастомозы, роль которых в гемодинамике малого круга значительно возрастает при застойных явлениях в нем.
Легочная артерия разветвляется на более мелкие артерии, а затем артериолы. Артериолы окружены паренхимой легких, поэтому кровоток в них тесно связан с режимом вентиляции легких. В легких имеется 2 типа капилляров: широкие, диаметром 20-40 мкм, и узкие – 6-12 мкм. Стенка легочного капилляра и альвеолы образуют функциональную единицу – альвеолокапиллярную мембрану. Через нее осуществляется газообмен. Минутный объем крови в сосудах малого круга такой же, как и большом, но кровяное давление меньше. Оно не может значительно повышаться из-за большой растяжимости стенок сосудов легких.
Нервная регуляция тонуса легочных сосудов осуществляется симпатическими нервами. Они оказывают слабое сосудосуживающее влияние. Из факторов гуморальной регуляции легочного кровотока главную роль играют серотонин, гистамин, ангиотензин, которые суживают сосуды. Катехоламины оказывают слабое вазоконстрикторное действие.
Движение крови в капиллярах. Микроциркуляция. Механизм обмена жидкости между кровью, межклеточным пространством и лимфой.
Микроциркуляция — это движение крови и лимфы в микроскопической части сосудистого русла.
Микроциркуляторное русло включает 5 звеньев:
1) артериолы как наиболее дистальные звенья артериальной системы;
2) прекапилляры, или прекапиллярные артериолы, являющиеся промежуточным звеном между артериолами и истинными капиллярами;
3) капилляры;
4) посткапилляры, или посткапиллярные венулы;
5) венулы, являющиеся корнями венозной системы.
Артериолы — мелкие сосуды диаметром 50-100 мкм, постепенно переходящие в капилляры. Основная функция артериол — регулирование притока крови в основное обменное звено МЦР — гемокапилляры. Артериолы обладают выраженной сократительной активностью, называемой вазомоцией.
Прекапилляры— тонкие микрососуды, отходящие от артериол. В местах отхождения от прекапиллярных артериол кровеносных капилляров имеются гладкомышечные сфинктеры. Регулируют приток крови к отдельным группам гемокапилляров.
Гемокапилляры. Наиболее тонкостенные сосуды микроциркуляторного русла, по которым кровь транспортируется из артериального звена в венозное. Они обеспечивают направленное движение крови и обменные процессы между кровью и тканями.
Посткапилляры— это сосуды, образующиеся при слиянии нескольких капилляров. На уровне посткапилляров происходят активные обменные процессы и осуществляется миграция лейкоцитов.
Венулы образуются при слиянии посткапилляров. Венулы отводят кровь из капилляров, выполняя отточно-дренажную функцию, выполняют вместе с венами депонирующую функцию. Сокращение продольно ориентированных гладких миоцитов венул создает некоторое отрицательное давление в их просвете, способствующее "присасыванию" крови из посткапилляров.
По строению капилляры делятся на три типа:
- Капилляры соматического типа (сплошные). Их стенка состоит из непрерывного слоя эндотелиоцитов. Она легко проницаема для воды и растворенных в ней ионов и низкомолекулярных веществ и непроницаема для белковых молекул. Такие капилляры находятся в коже, скелетных мышцах, легких, миокарде, мозге.
- Капилляры висцерального типа (окончатые). Имеют в эндотелии фенестры (оконца). Этот тип капилляров обнаружен в органах, которые служат для выделения и всасывания больших количеств воды с растворенными в ней веществами. Это пищеварительные и эндокринные железы, кишечник, почки.
- Капилляры синусоидного типа (несплошные). Находятся в костном мозге, печени, селезенке. Их эндотелиоциты отделены друг от друга щелями. Поэтому стенка этих капилляров проницаема не только для белков плазмы, но и для клеток крови.
У некоторых капилляров в месте ответвления от артериол находится капиллярный сфинктер. Он состоит из 1-2 гладкомышечных клеток, образующих кольцо на устье капилляра. Они служат для регуляции местного капиллярного кровотока.
Основной функцией капилляров является транскапиллярный обмен, обеспечивающий водно-солевой, газовый обмен и метаболизм клеток. Общая обменная капилляров составляет около 1000 м. Однако количество капилляров в органах и тканях неодинаково. Например, в 1 ммЗ мозга, почек, печени, миокарда около 2500-3000 капилляров. В скелетных мышцах от 300 до 1000.
Обмен осуществляется путем диффузии, фильтрации-абсорбции и микропиноцитоза. Наибольшую роль в транскапиллярном обмене воды и растворенных в ней веществ играет двусторонняя диффузия. Ее скорость составляет около 60 литров в минуту. С помощью диффузии обмениваются молекулы воды, неорганические ионы, кислород, углекислый газ, алкоголь и глюкоза. Диффузия происходит через заполненные водой поры. Фильтрация и абсорбция связаны с разностью гидростатического и онкотического давления крови и тканевой жидкости. В артериальном конце капилляров гидростатическое давление составляет 25-30 мм рт.ст., а онкотическое давление белков плазмы 20-25 мм рт.ст. Т.е. возникает положительная разность давлений около +5 мм рт.ст. Гидростатическое давление тканевой жидкости около нуля, а онкотическое – около 3 мм рт.ст. Разность -3 мм рт.ст. Суммарный градиент давления направлен из капилляров. Поэтому вода с растворенными веществами переходит в межклеточное пространство. Гидростатическое давление в венозном конце капилляров 8-12 мм рт.ст. Поэтому разность онкотического и гидростатического давления составляет -10-15 мм рт.ст. при той же разности в тканевой жидкости. Направление градиента в капилляры. Вода абсорбируется в них. Возможен транскапиллярный обмен против концентрационных градиентов. В эндотелиоцитах имеются везикулы, расположенные в цитозоле и фиксированные в клеточной мембране. В каждои клетке около 500 таких везикул. С их помощью происходит транспорт из капилляров в тканевую жидкость и наоборот крупных молекул, например, белковых. Этот механизм требует затрат энергии, поэтому относится к активному транспорту.
В состоянии покоя кровь циркулирует лишь по 25-30% всех капилляров. Их называют дежурными. При изменении функционального состояния организма количество функционирующих капилляров возрастает.
Например, в работающих скелетных мышцах оно увеличивается в 50-60 раз. В результате обменная поверхность капилляров возрастает в 50-100 раз. Возникает рабочая гиперемия. Наиболее выраженная рабочая гиперемия наблюдается в мозге, сердце, печени, почках. Значительно возрастает количество функционирующих капилляров и после временного прекращения кровообращения в них. Например, после временного сдавления артерии. Такое явление называется реактивной (постокклюзионной) гиперемией.
Кроме того, капилляры имеют ауторегуляторную реакцию. Это поддержание постоянства кровотока в капиллярах при снижении или повышении системного артериального давления. Такая реакция связана с тем, что при повышении давления гладкие мышцы сосудов сокращаются и их просвет уменьшается. При понижении наблюдается обратная картина.
Регуляции кровотока в микроциркуляторном русле осуществляется с помощью местных, гуморальных и нервных механизмов, влияющих на просвет артериол.
К местным относятся факторы, оказывающие прямое влияние на мускулатуру артериол. Эти факторы также называются метаболическими, т.к. необходимы для клеточного метаболизма. При недостатке в тканях кислорода, повышении концентрации углекислого газа, протонов, под влиянием АТФ, АДФ, АМФ происходит расширение сосудов. С этими метаболическими сдвигами связана реактивная гиперемия.
Гуморальное влияние на сосуды микроциркуляторного русла оказывает ряд веществ. Гистамин вызывает местное расширение артериол и венул. Адреналин, в зависимости от характера рецепторного аппарата гладкомышечных клеток, может вызывать и сужение, и расширение сосудов. Брадикинин, образующийся из белков плазмы кининогенов под влиянием фермента калликреина, также расширяет сосуды. Оказывает влияние на артериолы расслабляющие факторы эндотелиоцитов. К ним относятся окись азота, белок эндотелин и некоторые другие вещества. Симпатические вазоконстрикторы иннервируют мелкие артерии и артериолы кожи, скелетных мышц, почек, органов брюшной полости. Они обеспечивают регуляцию тонуса этих сосудов. Мелкие сосуды наружных половых органов, твердой мозговой оболочки, желез пищеварительного тракта иннервируются сосудорасширяющими парасимпатическими нервами. Интенсивность транскапиллярного обмена главным образом определяется количеством функционирующих капилляров. Проницаемость капиллярной стенки повышают гистамин и брадикинин.
Если капилляры открываются пассивно прибывшей кровью, то механизм закрытия их несколько сложнее. При наблюдении за движением крови в микроциркуляторном русле было обнаружено несколько его особенностей. Во-первых, по мере уменьшения диаметра сосуда соотношение между форменными элементами крови и плазмой постепенно уменьшается. Во-вторых, при уменьшении диаметра сосуда движение крови (обратная вязкости показатель) возрастает.
Механизм обмена жидкости между кровью, межклеточным пространством и лимфой.
Непосредственным окружением кровеносного сосуда и прилегающих к ней клеток является интерстициальное пространство. Это сеть коллагеновых и эластичных волокон, которые образуют ячейки разной величины и формы, заполненные гелеобразное вещество, состоящее из белков, полисахаридов, неорганических солей и воды. Интерстициальное пространство имеет фильтрационную (комплекс кровеносных капилляров) и реабсорбционной (лимфатические капилляры и венулярном микрососуды) системы. Благодаря конвекционном переноса (посредством циркуляции водных растворов) и диффузии молекул в среде интерстициальная жидкость движется от кровеносных к лимфатическим капиллярам. Лимфатические капилляры имеют вид или трубочки диаметром 20-200 мкм со слепым концом, или петли или сеточки, или синусоиды. Стенки капилляров состоят из уплотненных эндотелиальних клеток, содержащих органеллы, микропиноцитозных везикулы и лизосомы. Стенки лимфатических сосудов имеют много отверстий, через которые проникают элементы интерстициальной жидкости. Низко- и высокодисперсные вещества, и вода проникают в просвет лимфатических капилляров благодаря гидростатическому и осмотическому давлению в интерстиции. Макромолекулы и другие частицы диаметром 3-5 мкм проникают с помощью пиноцитозных пузырьков.
Движущей силой лимфы является градиент давления. В рабочих органах лимфоток возрастает.
Градиент гидростатического давления в лимф. Системе создается:
- Сократительная активность лимфатических сосудов и узлов. Эта деятельность активируется повышением гидростатического давления из-за попадания порции лимфы из соседнего лимфангиона.
- Присасывающее действие грудной клетки, способствует продвижению лимфы в область крупных вен грудной полости. На вдохе давление становится ниже, что и создает присасывающий эффект.
- Вспомогательную роль играют сокращение скелетных мышц, повышение внутрибрюшного давления, пульсация близлежащих крупных артериальных сосудов.
Через сосудистую систему за сутки проходит 8000—9000 л крови. Через стенку капилляров профильтровывается около 20 л жидкости и 18 л реабсорбируется в кровь.
По лимфатическим сосудам оттекает около 2 л жидкости. Закономерности, обусловливающие обмен жидкости между капиллярами и тканевыми пространствами, были описаны Стерлингом. Гидростатическое давление крови в капиллярах (Ргк) является основной силой, направленной на перемещение жидкости из капилляров в ткани. Основной силой, удерживающей жидкость в капиллярном русле, является онкотическое давление плазмы в капилляре (Рок). Определенную роль играют также гидростатическое давление (Ргт) и онкотическое давление тканевой жидкости (Рот) На артериальном конце капилляра Ргк составляет 30—35 мм рт.ст., а на венозном — 15—20 мм рт.ст. Рок на всем протяжении остается относительно постоянным и составляет 25 мм рт.ст. Таким образом, на артериальном конце капилляра осуществляется процесс фильтрации — выхода жидкости, а на венозном — обратный процесс — реабсорбция жидкости. Определенные коррективы вносит в этот процесс Рот, равное примерно 4,5 мм рт.ст., которое удерживает жидкость в тканевых пространствах, а также отрицательная величина Ргт (-3—9 мм рт.ст.). Следовательно, объем жидкости, переходящей через стенку капилляра за одну минуту (V), при коэффициенте фильтрации К равен: V=(Ргк + Рот + Ргт - Рок)*К. На артериальном конце капилляра V положителен, здесь происходит фильтрация жидкости в ткань, а на венозном — V отрицателен и жидкость реабсорбируется в кровь. Транспорт электролитов и низкомолекулярных веществ, например глюкозы, осуществляется вместе с водой. Капилляры различных органов отличаются по своей ультраструктуре, а следовательно, по способности пропускать в тканевую жидкость белки. Так, 1 л лимфы в печени содержит 60 г белка, в миокарде — 30 г, в мышцах — 20 г и в коже — 10 г. Белок, проникший в тканевую жидкость, с лимфой возвращается в кровь.
Функции лимфатической системы. Механизмы лимфообразования и лимфообращения.
Лимфа выполняет следующие функции:
- поддерживает постоянство объема тканевой жидкости путем удаления ее избытка;
- перенос питательных веществ, в основном жиров, от органов пищеварения к тканям;
- возврат белка из тканей в кровь;
- удаление продуктов обмена из тканей;
- защитная функция обеспечивается лимфоузлами, иммуноглобулинами, лимфоцитами, макрофагами;
- участвует в механизмах гуморальной регуляции, перенося гормоны и другие ФАВ.
Механизм лимфообразования.
Лимфа образуется путем фильтрации тканевой жидкости через стенку лимфатических капилляров. В лимфатической системе циркулирует около 2 литров лимфы. Из капилляров она движется по лимфатическим сосудам, проходит лимфатические узлы и по крупным протокам поступает в венозное русло.
* Удельный вес лимфы 1,012-1,023 г/мм3.
* Вязкость 1,7 пуаз, а рН ~ 9,0.
* Электролитный состав лимфы сходен с плазмой крови, но в ней больше анионов хлора и бикарбоната.
* Содержание белков в лимфе меньше, чем в плазме: 2,5-5,6% или 25-65 г/л.
*Из форменных элементов лимфа в основном содержит лимфоциты (2'000-20'000 мкл (220·109/л)) - имеется и небольшое количество других лейкоцитов (больше всего моноцитов). Эритроцитов в норме нет. Благодаря наличию в ней тромбоцитов, фибрина, факторов свертывания лимфа способна образовывать тромб. Однако время ее свертывания больше, чем у крови.
Механизм лимфообращения.
Движение лимфы начинается с момента ее образования в лимфатических капиллярах, поэтому факторы, которые увеличивают скорость фильтрации жидкости из кровеносных капилляров, будут также увеличивать скорость образования и движения лимфы. Факторами, повышающими лимфообразование, являются увеличение гидростатического давления в капиллярах, возрастание общей поверхности функционирующих капилляров (при повышении функциональной активности органов), увеличение проницаемости капилляров, введение гипертонических растворов. Роль лимфообразования в механизме движения лимфы заключается в создании первоначального гидростатического давления, необходимого для перемещения лимфы из лимфатических капилляров и посткапилляров в отводящие лимфатические сосуды.
В лимфатических сосудах основной силой, обеспечивающей перемещение лимфы от мест ее образования до впадения протоков в крупные вены шеи, являются ритмические сокращения лимфангионов. Лимфангионы, которые можно рассматривать как трубчатые лимфатические микросердца, имеют в своем составе все необходимые элементы для активного транспорта лимфы: развитую мышечную «манжетку» и клапаны. По мере поступления лимфы из капилляров в мелкие лимфатические сосуды происходит наполнение лимфангионов лимфой и растяжение их стенок, что приводит к возбуждению и сокращению гладких мышечных клеток мышечной «манжетки». Сокращение гладких мышц в стенке лимфангиона повышает внутри него давление до уровня, достаточного для закрытия дистального клапана и открытия проксимального. В результате происходит перемещение лимфы в следующий центрипетальный лимфангион. Заполнение лимфой проксимального лимфангиона приводит к растяжению его стенок, возбуждению и сокращению гладких мышц и перекачиванию лимфы в следующий лимфангион. Таким образом, последовательные сокращения лимфангионов приводят к перемещению порции лимфы по лимфатическим коллекторам до места их впадения в венозную систему. Работа лимфангионов напоминает деятельность сердца. Как в цикле сердца, в цикле лимфангиона имеются систола и диастола. По аналогии с гетерометрической саморегуляцией в сердце, сила сокращения гладких мышц лимфангиона определяется степенью их растяжения лимфой в диастолу. И наконец, как и в сердце, сокращение лимфангиона запускается и управляется одиночным платообразным потенциалом действия.
Стенка лимфангионов имеет развитую иннервацию, которая в основном представлена адренергическими волокнами. Роль нервных волокон в стенке лимфангиона заключается не в побуждении их к сокращению, а в модуляции параметров спонтанно возникающих ритмических сокращений. Кроме этого, при общем возбуждении симпатико-адреналовой системы могут происходить тонические сокращения гладких мышц лимфангионов, что приводит к повышению давления во всей системе лимфатических сосудов и быстрому поступлению в кровоток значительного количества лимфы. Гладкие мышечные клетки высокочувствительны к некоторым гормонам и биологически активным веществам. В частности, гистамин, увеличивающий проницаемость кровеносных капилляров и приводящий тем самым к росту лимфообразования, увеличивает частоту и амплитуду сокращений гладких мышц лимфангионов. Миоциты лимфангиона реагируют также на изменения концентрации метаболитов, рО2 и повышение температуры.
В организме, помимо основного механизма, транспорту лимфы по сосудам способствует ряд второстепенных факторов. Во время вдоха усиливается отток лимфы из грудного протока в венозную систему, а при вдохе он уменьшается. Движения диафрагмы влияют на ток лимфы — периодическое сдавление и растяжение диафрагмой цистерны грудного протока усиливает заполнение ее лимфой и способствует продвижению по грудному лимфатическому протоку. Повышение активности периодически сокращающихся мышечных органов (сердце, кишечник, скелетная мускулатура) влияет не только на усиление лимфооттока, но и способствует переходу тканевой жидкости в капилляры. Сокращения мышц, окружающих лимфатические сосуды, повышают внутрилимфатическое давление и выдавливают лимфу в направлении, определяемом клапанами. При иммобилизации конечности отток лимфы ослабевает, а при активных и пассивных ее движениях — увеличивается. Ритмическое растяжение и массаж скелетных мышц способствуют не только механическому перемещению лимфы, но и усиливают собственную сократительную активность лимфангионов в этих мышцах.
Гетерометрическая и гомеометрическая регуляция сердца. Регуляция межклеточных взаимодействий в миокарде.
Гетерометрическая регуляция сердца (закон Старлинга).
Сердце может саморегулироваться за счет сердечных интракардиальных механизмов. Закон Франка-Старлинга: чем больше растяжение миокарда, тем сильнее сокращения.
В 1895г. О. Франк получил зависимость: чем больше растянуто сердце, тем сильнее оно сокращается. Окончательно эту зависимость проверил и сформулировал Э. Старлинг в 1918г. В последующем это явление получило название «Закон Франка-Старлинга». Суть его заключалась в том, что чем больше (до определенной величины) растягивается мышца желудочков (и предсердий) во время фазы наполнения, тем сильнее она будет сокращаться во время систолы.
Найдено, что максимальное сокращение сердечная мышца совершает в том случае, если длина саркомера достигает 1,9-2,2 мкм. В этой ситуации число мест, генерирующих силу (число активно функционирующих мостиков), достигает максимального значения. При дальнейшем растяжении мышцы взаимодействующие части актиновых и миозиновых нитей разъединяются, число мест генерации силы уменьшается, и сила сокращения падает. При длине саркомера, равно 3,6 мкм, сила сокращений равна 0, т.к. взаимодействие полностью отсутствует. В целом этот способ регуляции силы сокращения получил название гетерометрической регуляции.
Гомеометрическая регуляция сердца (феномен Анрепа).
Если размеры желудочка не меняются, но увеличиваеся давление крови на стенки желудочка, тогда срабатывает закон гомеометрической регуляции, следовательо увеличивается частота сердечных сокращений. Известно, что сила сердечных сокращений может меняться при неизмененной длине мышцы (гомеометрический режим) за счет влияний, приводящих, в частности, к повышению внутри миокардиоцита свободного кальция. В частности, подобное может наблюдаться в явлении лестницы Боудича: чем чаще возникает возбуждение в миокарде, тем сильнее (до некоторого предела) сокращение. Это явление получило название хроноинотропного взаимоотношения. Это явление играет важную роль в регуляции деятельности сердца в реальных условиях.
Второй вариант гомеометрической регуляции, которая осуществляется без каких-либо нервны или гуморальных механизмов – это феномен Анрепа – при увеличении давления в аорте (артерии) в результате роста противонагрузки возрастает и сила сердечных сокращений. Благодаря этому феномену при повышении давления в аорте или артерии величина систолического объема крови может оставаться постоянной. Механизмы, лежащие в основе феномена Анрепа, до настоящего времени не ясны.
Регуляция межклеточных взаимодействий в миокарде.
Установлено, что вставочные диски, соединяющие клетки миокарда, имеют различную структуру. Одни участки вставочных дисков выполняют чисто механическую функцию, другие обеспечивают транспорт через мембрану кардиомиоцита необходимых ему веществ, третьи - нексусы, или тесные контакты, проводят возбуждение с клетки на клетку. Нарушение межклеточных взаимодействий приводит к асинхронному возбуждению клеток миокарда и появлению сердечной аритмии.
Кроме того, соединительно-тканные клетки миокарда представляют не только механическую опорную структуру, но и поставляют для сократительного миокарда ряд сложных высокомолекулярных продуктов, необходимых для поддержания функции сократительных белков.
Такой тип взаимодействий получил называние креаторных связей
Экстракардиальная регуляция сердца. Характеристика хронотропного, инотропного, батмотропного, дромотропного регуляторных эффектов. Схема парасимпатической и симпатической иннервации сердца.
Экстракардиальная регуляция сердца. Характеристика хронотропного, инотропного, батмотропного, дромотропного регуляторных эффектов.
Работа сердца регулируется двумя нервами: блуждающим (или вагусом), относящимся к парасимпатической нервной системе, и симпатическим. Эти нервы образованы двумя нейронами. Тела первых нейронов, отростки которых составляют блуждающий нерв, расположены в продолговатом мозге. Отростки этих нейронов заканчиваются в инграмуральных ганглиях сердца. Здесь находятся вторые нейроны, отростки которых идут к проводящей системе, миокарду и коронарным сосудам.
Иннервируя ткань водителей ритма, вегетативные нервы способны менять их возбудимость, тем самым вызывая изменения частоты генерации потенциалов действия и сокращений сердца – это хронотропный эффект. Нервные влияния изменяют скорость электротонической передачи возбуждения и, следовательно, длительности фаз сердечного цикла – дромотропнымый эффект. Поскольку действие медиаторов вегетативной нервной системы заключается в изменении уровня циклических нуклеотидов и энергетического обмена, вегетативные нервы в целом способны влиять и на силу сердечных сокращений - инотропный эффект. В лабораторных условиях получен эффект изменения величины порога возбуждения кардиомиоцитов под действием нейромедиаторов, его обозначают как батмотропный. Отрицательный клинотропный – падение скорости нарастания давления в фазу изометрического сокращения. При продолжении раздражения блуждающего нерва деятельность сердца восстанавливается.
Схема парасимпатической и симпатической иннервации сердца.
Первые нейроны симпатической нервной системы, регулирующей работу сердца, лежат в боковых рогах I-V грудных сегментов спинного мозга. Отростки этих нейронов заканчиваются в шейных и верхних грудных симпатических узлах. В этих узлах находятся вторые нейроны, отростки которых идут к сердцу. Большая часть симпатических нервных волокон направляются к сердцу от звездчатого ганглия. Нервы, идущие от правого симпатического ствола, в основном подходят к синусному узлу и к мышцам предсердий, а нервы левой стороны — к атриовентрикулярному узлу и мышцам желудочков
Парасимпатическая иннервация представлена ветвями блуждающих нервов, отходящими от общих стволов этих нервов в верхней части грудной полости. Преганглионарные волокна заканчиваются на интрамуральных ганглиях. Если на шее животного перерезать один блуждающий нерв, а его периферический конец, идущий к сердцу, раздражать электрическим током, то при слабом раздражении возникает урежение сокращений сердца и ослабевает их сила. Если раздражение усилить, может произойти полная остановка сердца во время диастолы желудочков. Действие ацетилхолина в первую очередь основано на повышении мембранной проницаемости для иона К+, что вызывает гиперполяризацию. В то же время еще в 30-е годы XX в. В. Кеннон установил, что при слабом раздражении блуждающего нерва может наблюдаться усиление сердечной деятельности. В настоящее время в интрамуральных ганглиях наряду с холинергическими обнаружены адренергические нейроны, которые и обеспечивают сердечную деятельность и иннервируют главным образом предсердия.
С — сердце; М — продолговатый мозг; CI — ядро, тормозящее деятельность сердца; СА — ядро, стимулирующее деятельность сердца; LH — боковой рог спинного мозга; 75 — симпатический ствол; V- эфферентные волокна блуждающего нерва; Д — нервдепрессор (афферентные волокна); S — симпатические волокна; А — спинномозговые афферентные волокна; CS — каротидный синус; В — афферентные волокна от правого предсердия и полой вены
Влияние блуждающих нервов на сердце. Опыт О. Леви. Механизм отрицательного хронотропного влияния блуждающего нерва на сердце.
Влияние блуждающих нервов на сердце. Механизм отрицательного хронотропного влияния блуждающего нерва.
При раздражении сердечных нервов под влиянием медиатора изменяется мембранный потенциал мышечных волокон сердечной мышцы. При раздражении блуждающего нерва происходит гиперполяризация мембраны, т.е. увеличивается мембранный потенциал. Основу гиперполяризации сердечной мышцы составляет увеличение проницаемости мембраны для ионов калия.
Зная, что блуждающий нерв гиперполяризует, а симпатический — деполяризует мембрану, можно объяснить все эффекты действия этих нервов на сердце. Поскольку при раздражении блуждающего нерва увеличивается мембранный потенциал, требуется большая сила раздражения для достижения критического уровня деполяризации и получения ответной реакции, а это свидетельствует об уменьшении возбудимости (отрицательный батмотропный эффект).
Отрицательный хронотропный эффект связан с тем, что при большой силе раздражения вагуса гиперполяризация мембраны столь велика, что возникающая спонтанная деполяризация не может достичь критического уровня и ответ не возникает — наступает остановка сердца.
При малой частоте или силе раздражения блуждающего нерва степень гиперполяризации мембраны меньше и спонтанная деполяризация постепенно достигает критического уровня, вследствие чего наступают редкие сокращения сердца (отрицательный дромотропный эффект).
Химический механизм передачи нервных импульсов в сердце. Опыт О. Леви.
В 1921 г. исследованиями О. Леви было показано, что влияние блуждающего нерва на сердце передается гуморальным путем. В опытах Леви наносил сильное раздражение на блуждающий нерв, что приводило к остановке сердца. Затем из сердца брали кровь и действовали ею на сердце другого животного; при этом возникал тот же эффект — торможение деятельности сердца. Точно гак же можно перенести и эффект симпатического нерва на сердце другого животного. Эти опыты свидетельствуют о том, что при раздражении нервов в их окончаниях выделяются активно действующие вещества, которые или тормозят, или стимулируют деятельность сердца: в окончаниях блуждающего нерва выделяется ацетилхолин, а в окончаниях симпатического — норадреналин.
При раздражении сердечных нервов под влиянием медиатора изменяется мембранный потенциал мышечных волокон сердечной мышцы. При раздражении блуждающего нерва происходит гиперполяризация мембраны, т.е. увеличивается мембранный потенциал. Основу гиперполяризации сердечной мышцы составляет увеличение проницаемости мембраны для ионов калия.
Влияние симпатического нерва передается с помощью медиатора норадреналина, который вызывает деполяризацию постсинаптической мембраны. Деполяризация связана с увеличением проницаемости мембраны для натрия.
Зная, что блуждающий нерв гиперполяризует, а симпатический — деполяризует мембрану, можно объяснить все эффекты действия этих нервов на сердце. Поскольку при раздражении блуждающего нерва увеличивается мембранный потенциал, требуется большая сила раздражения для достижения критического уровня деполяризации и получения ответной реакции, а это свидетельствует об уменьшении возбудимости (отрицательный батмотропный эффект).
При раздражении симпатического нерва даже небольшой силой возникает деполяризация мембраны, которая характеризуется уменьшением величины мембранного и порогового потенциалов, что свидетельствует о повышении возбудимости (положительный батмотропный эффект).
Поскольку под влиянием симпатического нерва мембрана мышечных волокон сердца деполяризуется, время спонтанной деполяризации, необходимой для достижения критического уровня и возникновения потенциала действия, уменьшается, что приводит к увеличению частоты сердечных сокращений.
Влияние симпатических нервов на сердце. «Усиливающий» нерв И.П. Павлова, механизм его действия на сердце.
Первые детальные исследования симпатической нервной системы на деятельность сердца принадлежит братьям Цион (1867), а затем И.П. Павлову (1887).
Братья Цион наблюдали увеличение частоты сердечных сокращений при раздражении спинного мозга в области расположения нейронов, регулирующих деятельность сердца. После перерезки симпатических нервов такое же раздражение спинного мозга не вызывало изменений деятельности сердца. Было установлено, что симпатические нервы, иннервирующие сердце, оказывают положительное влияние на все стороны деятельности сердца. Они вызывают положительные хронотропный, инотропный, батморопный, дромотропный и тонотропный эффекты.
Дальнейшими исследованиями И.П. Павлова было показано, что нервные волокна, входящие в состав симпатического и блуждающего нервов, влияют на разные стороны деятельности сердца: одни изменяют частоту, а другие — силу сердечных сокращений. Веточки симпатического нерва, при раздражении которых наступает усиление силы сердечных сокращений, были названы усиливающим нервом Павлова. Было установлено, что усиливающее влияние симпатических нервов связано с повышением уровня обмена веществ.
В составе блуждающего нерва также были найдены волокна, влияющие только на частоту и только на силу сердечных сокращений.
На частоту и силу сокращений влияют волокна блуждающего и симпатического нервов, подходящие к синусному узлу, а сила сокращений изменяется под влиянием волокон, подходящих к атриовентрикулярному узлу и миокарду желудочков.
Блуждающий нерв легко адаптируется к раздражению, поэтому его эффект может исчезнуть, несмотря на продолжающееся раздражение. Это явление получило название «ускользание сердца от влияния вагуса». Блуждающий нерв обладает более высокой возбудимостью, вследствие чего он реагирует на меньшую силу раздражения, чем симпатический, и коротким латентным периодом.
Поэтому при одинаковых условиях раздражения эффект блуждающего нерва появляется раньше, чем симпатического
Ветви симпатических нервов берут начало от грудного отдела спинного мозга и прерываются в верхнем, среднем шейных и звездчатых ганглиях. Постганглионарные волокна иннервируют весь миокард, но в основном предсердия. Раздражение симпатических нервов оказывает влияние, противоположное действию блуждающих нервов: увеличиваются частота и сила сердечных сокращений, улучшается проводимость и повышается возбудимость.
Указанные процессы обусловлены взаимодействием медиатора норадреналина преимущественно с β-адренорецепторами миокарда. Его действие связано с ростом мембранной проницаемости для ионов кальция, что сопровождается повышением степени сопряженности возбуждения и сокращения миокарда. Кроме того, адреналин способствует расщеплению гликогена и образованию глюкозы, служащей источником энергии для сокращения миокарда. Норадреналин разрушается значительно медленнее, чем ацетилхолин, поэтому его взаимодействие с адренорецепторами сердечных клеток, как и раздражение симпатических волокон, сопровождается более продолжительным эффектом. При чрезмерном возбуждении сердечных симпатических нервов возбудимость миокарда может возрасти настолько, что появляются эктопические очаги возбуждения и нарушения ритма.
При раздражении симпатического нерва даже небольшой силой возникает деполяризация мембраны, которая характеризуется уменьшением величины мембранного и порогового потенциалов, что свидетельствует о повышении возбудимости (положительный батмотропный эффект). Поскольку под влиянием симпатического нерва мембрана мышечных волокон сердца деполяризуется, время спонтанной деполяризации, необходимой для достижения критического уровня и возникновения потенциала действия, уменьшается, что приводит к увеличению частоты сердечных сокращений.
Рефлексы сопряженной регуляции сердца (рефлекс Гольца, рефлекс Ашнера-Данини). Условнорефлекторная регуляция сердца.
Рефлексы сопряженной регуляции сердца (рефлексы Гольца и Ашнера-Данини)
Существуют рефлекторные влияния и с других рецепторов организма человека. Всякого рода болевые, температурные, световые и другие раздражители в той или иной степени изменяют сердечную деятельность. Нервные центры и эффекторы внесердечной нервной регуляции принадлежат автономной нервной системе.
Это понятие ввел в физиологию В.Н.Черниговский. Сопряженные (межсистемные) рефлексы — рефлекторные влияния на сердечнососудистую систему с рефлексогенных зон других органов или с сердечно-сосудистой системы на другие системы организма. Они не принимают прямого участия в регуляции системного АД. Примером сопряженных рефлексов могут служить следующие рефлексы.
Глазосердечный (Даньини–Ашнера) рефлекс. Надавливание на глазные яблоки вызывает раздражение рецепторов тройничного нерва; импульсы передаются по этому нерву в средний мозг, далее по вставочному нейрону (возможно, по волокнам ретикулярной субстанции) направляются к ядрам блуждающих нервов, от которых импульсы доходят до нервных сплетений сердца. Кроме того, надавливание на глаза приводит к изменению внутриглазного давления и раздражению барорецепторов полостей глаз, импульсы от которых передаются в ствол мозга к ядрам блуждающих нервов.
Солярный рефлекс (Тома–Ру). При надавливании на эпигастральную зону в области солнечного сплетения происходит раздражение многочисленных его рецепторов, афферентные импульсы от которых по чревным нервам достигают спинного мозга, а затем ядер блуждающих нервов. Далее по эфферентным волокнам импульсы достигают сердца, в результате чего частота сердцебиений замедляется.
Дыхательно-сердечный рефлекс (Геринга). Терминальные и дыхательные бронхиолы легких содержат механорецепторы блуждающих нервов. При значительном их растяжении (глубокое форсированное дыхание) афферентация от легких в центры продолговатого мозга резко усиливается, что, вследствие повышения тонуса ядер блуждающих нервов, вызывает замедление работы сердца.
Рефлекс Гольтца — уменьшение ЧСС или даже полная остановка сердца при раздражении механорецепторов органов брюшной полости или брюшины, что учитывается при хирургических вмешательствах в брюшной полости. В опыте Гольца поколачивание по желудку и кишечнику лягушки ведет к остановке сердца.
Рефлекс с механо- и терморецепторов кожи при их раздражении заключается в торможении или стимуляции сердечной деятельности. Степень их выраженности может быть
весьма сильной. Известны, например, случаи летального исхода вследствие остановки сердца при нырянии в холодную воду (резкое охлаждение кожи живота).
Рефлекс с проприорецепторов возникает при физической нагрузке и выражается в увеличении ЧСС вследствие уменьшения тонуса блуждающих нервов. Этот рефлекс является приспособительным — обеспечивает улучшение снабжения работающих мышц кислородом и питательными веществами, удаление метаболитов.
Условнорефлекторная регуляция сердца.
Все условные рефлексы являются приобретенными в процессе жизни каждого организма и формируются они с участием коры больших полушарий. Трудно, а может быть даже и невозможно выработать условный рефлекс, который бы проявлялся изолированным изменением только деятельности сердца. В целостном организме изменения функций носят системный характер, т.е. наблюдается одновременное изменение ряда показателей. Например, предстартовое изменение ряда функций организма имеет несомненно условнорефлекторный характер, но при этом усиливается не только работа сердца, а происходит повышение АД, гипервентиляция, повышение активности ЦНС, вегетативной нервной системы, увеличение количества эритроцитов и гемоглобина, усиление функций желез внутренней секреции. Все эти изменения необходимы для достижения полезного приспособительного результата, а в данном случае — высокого спортивного результата. Или другой пример, который также имеет приобретенный, т.е. условнорефлекторный характер. Изменение функционального состояния перечисленных систем четко проявляется у студентов и школьников во время сдачи экзаменов. Причем уровень психоэмоционального возбуждения неодинаковый в разные периоды предэкзаминационного напряжения, чем больше дефицит информации, тем больше выраженность реакций (перед взятием билета, начало ответа и т.д.). Уровень мотиваций, выраженность эмоционального компонента имеют чрезвычайно важное значение для выработки условных рефлексов. Поэтому все эти сложные поведенческие реакции протекают с участием не только коры головного мозга, но и подкорковых, и прежде всего лимбических и гипоталамических структур мозга. Роль коры при этом заключается, главным образом, в оценке путей реализации и правильности результата действия.
Условные рефлексы могут быть натуральными (естественными — вышеприведенные примеры относятся к этой категории рефлексов) и искусственными, т.е. выработанные в лабораторных условиях на какие-то ранее индифферентные раздражители. Например, в качестве условного сигнала используется «свет», а подкреплением является болевое раздражение (которое сопровождается в частности тахикардией и повышением АД и т.д.). После выработки условного рефлекса условный сигнал «свет» будет вызывать такие же изменения, как и боль.
Роль биологически активных веществ и электролитов в регуляции сердца.
Изменения работы сердца наблюдаются при действии на него ряда биологически активных веществ, циркулирующих в крови.Катехоламины (адреналин, норадреналин) увеличивают силу и учащают ритм сердечных сокращений, что имеет важное биологическое значение. При физических нагрузках или эмоциональном напряжении
мозговой слой надпочечников выбрасывает в кровь большое количество адреналина, что приводит к усилению сердечной деятельности, крайне необходимому в данных условиях.
Указанный эффект возникает в результате стимуляции катехоламинами рецепторов миокарда, вызывающей активацию внутриклеточного фермента аденилатциклазы, которая ускоряет образование 3',5'-циклического аденозинмонофосфата (цАМФ). Он активирует фосфорилазу, вызывающую расщепление внутримышечного гликогена и образование глюкозы (источника энергии для сокращающегося миокарда). Кроме того, фосфорилаза необходима для активации ионов Са2+ — агента, реализующего сопряжение возбуждения и сокращения в миокарде (это также усиливает положительное инотропное действие катехоламинов). Помимо этого, катехоламины повышают проницаемость клеточных мембран для ионов Са2+, способствуя, с одной стороны, усилению поступления их из межклеточного пространства в клетку, а с другой — мобилизации ионов Са2+ из внутриклеточных депо.
Активация аденилатциклазы отмечается в миокарде и при действии глюкагона — гормона, выделяемого α-клетками панкреатических островков, что также вызывает положительный инотропный эффект.
Гормоны коры надпочечников, ангиотензин и серотонин также увеличивают силу сокращений миокарда, а тироксин учащает сердечный ритм. Гипоксемия, гиперкапния и ацидоз угнетают сократительную активность миокарда.
Метаболиты могут как угнетать, так и стимулировать работу сердца. При повышении содержания калия в кардиомиоцитах снижается потенциал покоя, их возбудимость и проводимость возрастают, появляются гетеротропные очаги возбуждения. Кальций усиливает сердечные сокращения, улучшает электромеханическое сопряжение, активирует фосфорилазу, способствуя высвобождению энергии. Ионы НСО3- , снижение рН и уменьшение О2 угнетают, а повышение рН усиливает сердечную деятельность.
Базальный тонус сосудов, его природа. Иннервация сосудов. Сосудосуживающие и сосудорасширяющие нервы.
Базальный тонус сосудов:
Даже при отсутствии нервных влияний на сосуды в случае их полной денервации продолжает сохраняться остаточный сосудистый тонус, получивший название базального тонуса. В основе базального тонуса лежит миогенный механизм. Во-первых, это способность гладкомышечных клеток сосудов к спонтанной биоэлектрической активности, т.е. к автоматии, и распространению возбуждения от клетки к клетке через плотные контакты. Это приводит к их сокращению и сужению просвета сосуда. Вторая причина - это деполяризация и сокращение гладкомышечных клеток под влиянием растягивающего действия давления крови на стенку сосуда. Базальный тонус наиболее выражен в сосудах органов с высоким уровнем метаболизма в сосудах почек, сердца и головного мозга. На него влияют гуморальные факторы. Клеточные метаболиты углекислый газ, органические кислоты снижают базальный тонус и расширяют сосуды, а вазопрессин, ангиотензин, адреналин, циркулирующие в крови, увеличивают базальный тонус и сосуды суживаются. Благодаря наличию базального тонуса и способности его к местной саморегуляции сосуды указанных областей могут поддерживать объёмную скорость кровотока на постоянном уровне независимо от колебаний системного артериального давления.
Нервная регуляция сосудистого тонуса осуществляется сосудосуживающими и сосудорасширяющими нервами.
Сосудосуживающими являются симпатические нервы. Первым их сосудосуживающее влияние обнаружил в 1851 г. К.Дернар, раздражая шейный симпатический нерв у кролика. Тела вазоконстрикторных симпатических нейронов расположены в боковых рогах грудных и поясничных сегментов спинного мозга. Преганглионарные волокна заканчиваются в паравертебральных ганглиях. Идущие от ганглиев постганглионарные волокна образуют на гладких мышцах сосудов а-адренергические синапсы. Симпатические вазоконстрикторы иннервируют сосуды кожи, внутренних органов, мышц. Центры симпатических вазоконстрикторов находятся в состоянии постоянного тонуса. Поэтому по ним поступают возбуждающие нервные импульсы к сосудам. За счет этого иннервируемые ими сосуды постоянно умеренно сужены.
К сосудорасширяющим относится несколько типов нервов:
1) Сосудорасширяющие парасимпатические нервы. К ним относится барабанная струна, расширяющая сосуды подчелюстной слюнной железы и парасимпатические тазовые нервы.
2) Симпатические холинергические вазодилататоры. Ими являются симпатические нервы, иннервирующие сосуды скелетных мышц. Их постганглионарные окончания выделяют ацетилхолин.
3) Симпатические нервы, образующие на гладких мышцах сосудов бетта-адренергические синапсы. Такие нервы имеются в сосудах легких, печени, селезенки.
4 )
Расширение сосудов кожи возникает при
раздражении задних корешков спинного
мозга, в которых идут афферентные нервные
волокна. Они и вызывают вазодилатацию.
При химическом или механическом
раздражении кожи возникает местная
сосудорасширяющая реакция, в основе
которой лежит так называемый аксон-рефлекс:
)
Расширение сосудов кожи возникает при
раздражении задних корешков спинного
мозга, в которых идут афферентные нервные
волокна. Они и вызывают вазодилатацию.
При химическом или механическом
раздражении кожи возникает местная
сосудорасширяющая реакция, в основе
которой лежит так называемый аксон-рефлекс:
Расширение сосудов в этом случае связано с тем, что возбуждение от кожных рецепторов распространяется по чувствительным волокнам не только к спинному мозгу (ортодромно), но также по эфферентным коллатералям к артериолам данного кожного участка (антидромно). В нервном окончании, подходящем к кровеносному сосуду в качестве медиатора выделяется одно из сильных сосудорасширяющих веществ: гистамин, брадикинин, АТФ, вещество Р, брадикинин.
И, наконец, расширение большинства артерий и артериол может осуществляться путём снижения частоты импульсов, посылаемых вазоконстрикторным центром периферическим сосудам по симпатическим сосудосуживающим волокнам.
Сосудодвигательный центр продолговатого мозга.
В регуляции тонуса сосудов принимают участие центры всех уровней ЦНС. Низшим является симпатические спинальные центры. Они находятся под контролем вышележащих. В 1871 г. В.Д.Овсянников установил, что после перерезки ствола между продолговатым и спинным мозгом кровяное давление резко падает. Если перерезка проходит между продолговатым и средним мозгом, то давление практически не изменяется. В дальнейшем было установлено, что в продолговатом мозге на дне IV желудочка находится бульбарный сосудодвигательный центр. Он состоит из депрессорного отделов. Прессорные нейроны в основном расположены в латеральных областях центра, а депрессорные в центральных. Прессорный отдел находится в состоянии постоянного возбуждения. В результате нервные импульсы от него постоянно идут к спинальным симпатическим нейронам, а от них к сосудам. Благодаря этому сосуды постоянно умеренно сужены. Тонус прессорного отдела обусловлен тем, что к нему непрерывно идут нервные импульсы в основном от рецепторов сосудов, а также неспецифические сигналы от рядом расположенного дыхательного центра и высших отделов ЦНС. Активирующее влияние на его нейроны оказывают углекислый газ и протоны. Регуляция тонуса сосудов в основном осуществляется именно через симпатические вазоконстрикторы путем изменения активности симпатических центров.
Влияют на тонус сосудов и сердечную деятельность и центры гипоталамуса. Например, раздражение одних задних ядер приводит к сужению сосудов и повышению кровяного давления. При раздражении других возрастает частота сердечных сокращений и расширяются сосуды скелетных мышц. При тепловом раздражении передних ядер гипоталамуса сосуды кожи расширяются, а при охлаждении суживаются. Последний механизм играет роль в терморегуляции.
Многие отделы коры также регулируют деятельность сердечно-сосудистой системы. При раздражении двигательных зон коры тонус сосудов возрастает, а частота сердцебиений увеличивается. Это свидетельствует о согласованности механизмов регуляции деятельности сердечно-сосудистой системы и органов движения. Особое значение имеет древняя и старая кора. В частности, электростимуляция поясной извилины, сопровождается расширением сосудов, а раздражение островков – к их сужению. В лимбической системе происходит координация эмоциональных реакций с реакциями системы кровобращения. Например, при сильном страхе учащаются сердцебиения и суживаются сосуды.
Барорецепторные рефлексы регуляции АД: блок-схема рефлекса регуляции АД с аортальной рефлексогенной зоны (рефлекс Циона-Людвига).
- Барорецепторный механизм: при повышении артериального давления и растяжении стенки артерии возбуждаются барорецепторы, расположенные в области каротидного синуса и дуги аорты, далее информация от этих рецепторов поступает в сосудодвигательный центр головного мозга, откуда исходит импульсация, приводящая к уменьшению влияния симпатической нервной системы на артериолы (они расширяются, снижается общее периферическое сосудистое сопротивление — постнагрузка), вены (происходит венодилатация, уменьшается давление наполнения сердца — преднагрузка); наряду с этим повышается парасимпатический тонус, что приводит к уменьшению частоты сердечного ритма; в конечном итоге указанные механизмы приводят к снижению артериального давления.
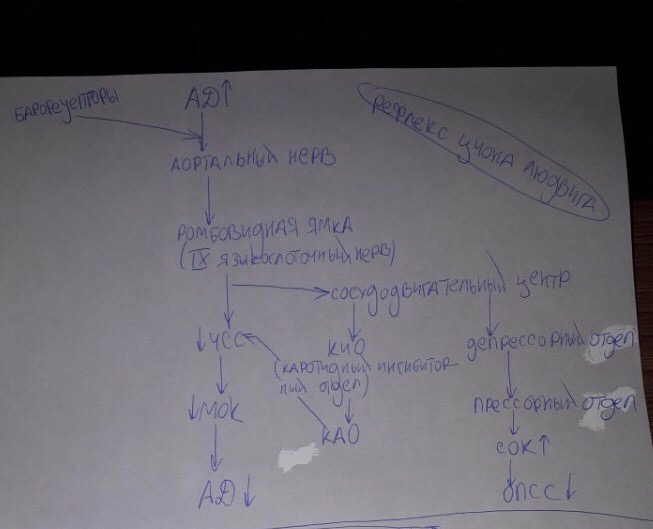
Барорецепторные рефлексы регуляции АД: блок-схема рефлекса регуляции АД с синокаротидных рефлексогенных зон (рефлекс Геринга).
- Барорецепторный механизм: при повышении артериального давления и растяжении стенки артерии возбуждаются барорецепторы, расположенные в области каротидного синуса и дуги аорты, далее информация от этих рецепторов поступает в сосудодвигательный центр головного мозга, откуда исходит импульсация, приводящая к уменьшению влияния симпатической нервной системы на артериолы (они расширяются, снижается общее периферическое сосудистое сопротивление — постнагрузка), вены (происходит венодилатация, уменьшается давление наполнения сердца — преднагрузка); наряду с этим повышается парасимпатический тонус, что приводит к уменьшению частоты сердечного ритма; в конечном итоге указанные механизмы приводят к снижению артериального давления.
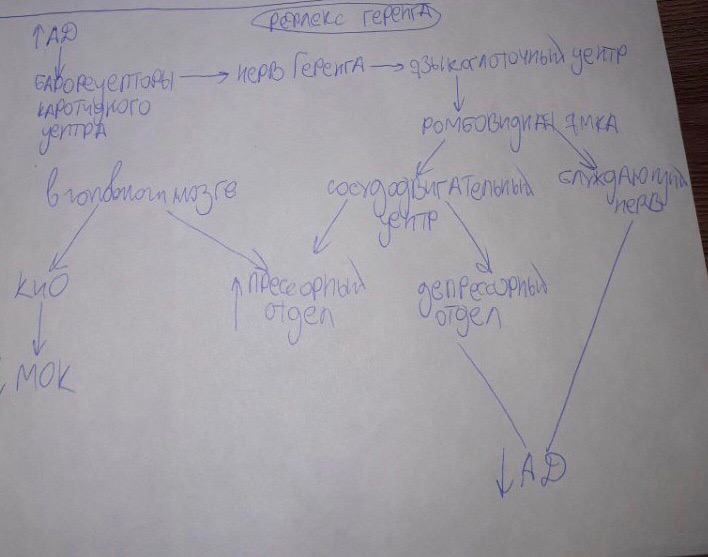
Гуморальные влияния на сосуды. Почечный эндокринный контур регуляции АД.
Гуморальные влияния на сосуды.
Гуморальная регуляция осуществляется физиологически активными веществами, находящимися в крови или тканевой жидкости. Их можно разделить на следующие группы:
1) Метаболические факторы. Они включают несколько групп веществ.
а) неорганические ионы. Ионы калия вызывают расширение сосудов, ионы кальция суживают их;
б) неспецифические продукты метаболизма. Молочная кислота и другие кислоты цикла Кребса расширяют сосуды. Таким же образом действует повышение содержания СO2 и протонов, т.е. сдвиг реакции среды в кислую сторону;
в) осмотическое давление тканевой жидкости. При его повышении происходит расширение сосудов.
2) Гормоны. По механизму действия на сосуды делятся на 2 группы:
а) Гормоны, непосредственно действующие на сосуды.
Главными сосудосуживающими веществами являются гормоны мозгового вещества надпочечников адреналин и норадреналин. Для взаимодействия с этими гормонами в гладкомышечных клетках артериол существуют два типа мембранных рецепторов: альфа – и бетта – адренорецепторы. Норадреналин действует на артериолы через альфа – адренорецепторы, возбуждение которых сопровождается сокращением гладкомышечных клеток сосудов.
Адреналин действует на альфа – и бетта-адренорецепторы. В тех сосудах, где преобладают альфа-адренорецепторы, адреналин так же, как норадреналин, вызывает суживающий эффект (артериолы кожи,желудочно-кишечного тракта и лёгких). В тех же артериолах, где преобладают бетта-рецепторы,адреналин вызывает расслабление гладкой мускулатуры и расширение сосудов (артериолы скелетных мышц, коронарные артерии).
Вазопрессин, гормон нейрогипофиза, оказывает суживающее действие на артериолы и капилляры.
Ангиотензин оказывает сильное суживающее действие на артерии и менее сильное на вены, стимулирует центральные и периферические симпатические структуры. В результате периферическое сопротивление и кровяное давление повышаются.
Серотонин содержится в больших количествах во внутренних органах и тромбоцитах. Серотонин, в зависимости от класса серотонинергических мембранных рецепторов, может вызывать как вазоконстрикцию, так и вазодилатацию.
Сосудорасширяющие вещество - гистамин выделяется базофилами, тучными клетками, при реакциях антиген-антитело. Его много в коже и слизистых оболочках. Оказывает местное расширение артериол и венул и резко увеличивает проницаемость капилляров.
Брадикинин, образующийся из кининогена плазмы под влиянием калликреина, оказывает выраженных сосудорасширяющий эффект и увеличивает проницаемость капилляров.
Гормоноподобные вещества простагландины, образующиеся практически во всех органах и тканях, существуют в виде нескольких групп. Группа ПГА-1. ПГА-2 вызывают расширение артерий особенно чревной области. В мозговом веществе почек выделен ПГА-2 под названием медуллин. Он снижает артериальное давление и увеличивает почечный кровоток, а также выделение почками воды, натрия и калия. Простогландины группы Е также вызывают расширение сосудов и тормозят выделение норадреналина из окончаний симпатических нервов. Простагландины группы F оказывают противоположное - сосудосуживающее действие.
б) Гормоны опосредованного действия.
АКТГ и кортикостероиды надпочечников постепенно увеличивают тонус сосудов и повышают кровяное давление. Таким же образом действует тироксин
Почечный эндокринный контур регуляции АД.
К эндокринным аппаратам почек относят: - Юкстагломеруллярный аппарат (ЮГА), выделяют ренин и эритропоэтин;
- Интерстициальные клетки мозгового вещества и нефроциты собирательных трубок, вырабатывают простагландины;
- ККС;
- Клетки APUD-системы, содержащие серотонин.
Данный механизм адаптации также в основном противодействует острой артериальной гипотензии. Начальным звеном почечного эндокринного контура является юкстагломерулярный аппарат почек, в клетках которого синтезируется ренин. В норме около 80 % ренина находится в плазме в неактивной или малоактивной форме (проренин). Главным активатором проренина считается плазменный калликреин. Поврежденная почка в отличие от здоровой преимущественно секретирует активный ренин. К увеличению секреции ренина приводят снижение перфузионного давления в артериолах почек, снижение транспорта ионов С1 в восходящем колене петли Генле, усиление b-адренергической стимуляции.
Кроме того, секреция ренина зависит от содержания в крови катехоламинов, простагландина (простациклина), глюкагона, ионов Na и К, ангиотензина П. Увеличение концентрации последнего тормозит секрецию ренина по механизму отрицательной обратной связи. Образование ренина снижается при увеличении объема внеклеточной жидкости и содержания ионов Na в плазме.
При взаимодействии с ангиотензиногеном образуется ангиотензин I. В физиологических условиях плазменная концентрация ангиотензиногена, вырабатываемого в печени, является достаточно стабильной и регулируется уровнем ангиотензина II по механизму обратной связи. Ангиотензин I считается промежуточной субстанцией, но также самостоятельно усиливает высвобождение норадреналина из окончаний симпатических нервов и вызывает прессорную сосудистую реакцию на периферии.
В результате воздействия на ангиотензин I превращающего (конвертирующего) фермента образуется ангиотензин II. Ангиотензин II — наиболее мощный вазопрессор, сосудосуживающая активность которого в 50 раз выше, чем у норадреналина. В случае острого снижения АД образование ренина и ангиотензина II возрастает. Последний совместно с норадреналином восстанавливает нормальное АД, воздействуя на специфические ангиотензиновые рецепторы артериол (имеется 2 типа ангиотензиновых рецепторов, находящихся в различных тканях). При этом увеличивается концентрация ионов Са в миоплазме гладкомышечных клеток артериол, что приводит к повышению их тонуса. Для развития максимального эффекта данного механизма требуется около 20 мин.
Другие механизмы восстановления АД при развитии острой гипотензии с участием ангиотензина II реализуются путем непосредственного его взаимодействия с центральными и периферическими звеньями симпатического отдела вегетативной нервной системы. Основным местом центрального нейрогенного прессорного эффекта ангиотензина II является area postrema продолговатого мозга. Быстрый компонент возникающей ответной реакции обеспечивается благодаря повышению симпатической активности на периферии. Ангиотензин II, воздействуя на определенные участки ЦНС, не только способствует повышению системного АД, но и усиливает чувство жажды, выделение антидиуретического гормона вазопрессина.
Периферические прессорные реакции ангиотензина II связаны с высвобождением адреналина из мозгового слоя надпочечников и норадреналина из окончаний постганглионарных симпатических волокон. Кроме того, ангиотензин II повышает чувствительность гладкомышечных клеток сосудов к сосудосуживающему действию норадреналина.
Ангиотензин II расщепляется с участием ферментов плазмы с образованием ангиотензина III. Периферическая и центральная прессорная активность последнего в 2 раза ниже, чем ангиотензина II. Разрушение ангиотензина II и его удаление из кровеносного русла компенсируются усилением секреции ренина и новым образованием ангиотензина П. Все три ангиотензина участвуют в регуляции внутрипочечного кровотока.
Прессорные механизмы регуляции АД длительного действия.
Прессорный отдел (на рис.21 – П) находится в состоянии постоянного возбуждения и посылает импульсы к периферическим сосудам через симпатические центры боковых рогов грудных сегментов спинного мозга и периферические симпатические нервы. Увеличение активности прессорного отдела вызывает повышение периферического сосудистого тонуса и увеличение системного артериального давления. Уменьшение его активности вызывает расширение сосудов и снижение давления.
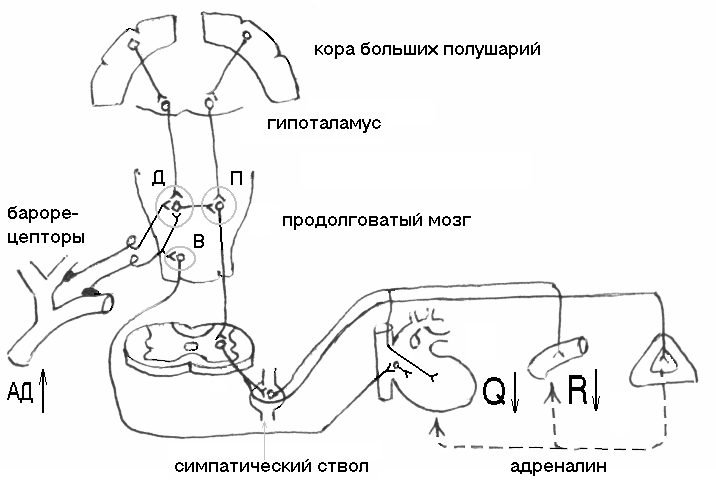
Ренин-ангиотензин-альдостероновая система регуляции АД.
Местные (локальные) системы ренин — ангиотензин II. Наряду с циркулирующими в крови факторами ренин-ангиотензиновой системы ренин и ангиотензин обнаружены в почках, надпочечниках, мозге, сердце и других органах. Синтез ангитензиногена, ангиотензинов и ренина происходит в этих органах внутриклеточно. Эти факторы оказывают ау-токринные («на себя») и паракринные («на соседние клетки») влияния, изменяя локальные тканевые функции. Локальные механизмы способны оказывать длительное воздействие на резистивные сосуды, регулируя их просвет, ОПСС и, следовательно, АД.
Локальные системы ренин—ангиотензин II совсем незначительно влияют на уровень этих гуморальных факторов в крови. При этом местная активность ренин-ангиотензиновой системы примерно в 1000 раз превышает ее активность в системном кровотоке.
Влияние ангиотензина II на баланс ионов Na и воды в организме — важнейшая роль длительно действующей системы регуляции АД. Увеличение реабсорбции Na обеспечивается:
а) непосредственным воздействием ангиотензина II на почечные канальцы;
б) опосредованным усилением секреции альдостерона клетками клубочкового слоя коры надпочечников.
При ограничении натрия в пище плазменная и местные ренин-ангиотензиновые системы играют ведущую роль в поддержании АД. Избыточное потребление натрия выводит на первый план в этом процессе увеличение объема циркулирующей плазмы.
Альдостерон — еще один гормон системы регуляции АД длительного действия, в основном
поддерживающий баланс ионов Na, К и воды. Скорость биосинтеза и выделение альдостерона регулируются ангиотензином И, секрецией адренокортикотропного гормона, концентрацией ионов Na и К в плазме. Даже небольшое увеличение содержания КЛ в крови способно на длительное время усилить секрецию альдостерона.
Непосредственного влияния на секрецию ренина альдостерон не оказывает. Активность юк-стагломерулярных клеток тормозится по механизму обратной связи в ответ на задержку натрия и воды, осуществляющихся под действием альдостерона.
Депрессорные механизмы регуляции АД длительного действия.
Депрессорный отдел (на рис.21 – Д) является центром, куда поступают импульсы непосредственно от сосудистых барорецепторов, под влиянием которых возрастает его активность. Собственных эфферентных связей с периферическими сосудами депрессорный отдел не имеет, и влияние на артериальное давление он может оказывать только, угнетая активность прессорного отдела через тормозные вставочные интернейроны, что приводит к расширению сосудов и снижению артериального давления.
- Система простагландинов. Простагландины представляют собой ненасыщенные циклические жирные кислоты, продукты метаболизма арахидоновой кислоты, которые широко представлены в организме человека и вызывают многообразные физиологические эффекты. Простагландины синтезируются в тканях в ответ на различные стимулы, главным образом проявляя локальную биологическую активность, но также поступают в кровь, функционируя как гормоны. В выработке простагландинов определенных типов имеет место тканевая специфичность. Например, в коронарных артериях и сосудах скелетных мышц преобладающим является простагландин I 2 (простациклин), а в мозговом слое почек главным образом синтезируются Простагландины серий Е, D, F и I, способные вызывать разнонаправленные реакции.
Ведущую роль в регуляции сосудистого тонуса и АД играет простациклин, образующийся в эндотелии и гладкомышечных клетках кровеносных сосудов. Он циркулирует в крови, оказывая вазодилатирующий эффект. Простагландины расширяют сосуды путем противодействия вазокон-стрикции, опосредуемой ангиотензином II и норадреналином, регуляции содержания циклических нуклеотидов и ионов Са в их гладкомышечных клетках. К влиянию простагландинов наиболее чувствительны сосуды скелетных мышц и чревной области, вносящие главный вклад в формирование ОПСС.
Мозговое вещество и сосочек почки — зоны наиболее интенсивного синтеза простагландинов. Почечный простагландин совместно с простагландином G2 и арахидоновой кислотой стимулирует выделение ренина в юкстагломерулярных клетках, что при участии ангиотензина II ведет к повышению сопротивления почечных сосудов и снижению скорости клубочковой фильтрации. С другой стороны, увеличение объема внеклеточной жидкости и плазмы крови, повышение содержания ионов Na в организме сопровождаются усилением синтеза медуллярного простагландина Е2, регулирующего концентрационную способность почек и выделение электролитов.
Таким образом, почечные и местные (сосудистые) простагландины играют существенную роль в поддержании водно-электролитного гомеостаза и сохранении нормальной проходимости резистивных сосудов, т.е. в процессах контроля физиологического уровня АД.
- Калликреин-кининовая система подразделяется на два физиологических аппарата — плазменный и почечный (железистый). Калликреин плазмы способствует отщеплению от кининогена активного сосудорасширяющего пептида брадикинина.
- Калликреин-кининовая система, функционирующая в почках, существенно отличается от плазменной. Синтезируемый канальциевым эпителием кортикальных сегментов нефрона калликреин поступает в канальцевую жидкость, а затем в мочу. В результате взаимодействия калликреи-на с кининогенами в дистальных канальцах образуется лизил-брадикинин. Повышение концентрации кининов в сосудах почек вызывает усиление почечного кровотока, выделения ионов Na и воды из организма. Лизил-брадикинин, как и брадикинин плазмы, быстро разрушается кининазами I и II. Система почечных кининов является антагонистом системы ренин—ангиотензин II..
- Допаминергические депрессорные механизмы. Свободный допамин образуется в почках и является нейромедиатором с самостоятельной физиологической ролью в ЦНС и на периферии. Существует два типа периферических допаминовых рецепторов — постсинаптические в гладкомышечных клетках сосудов и пресинаптические в окончаниях симпатических нервов.
Активация периферических допаминовых рецепторов в окончаниях симпатических нервов вызывает торможение высвобождения норадреналина из депо симпатических терминалей, снижает ЧСС и АД. Постсинаптические допаминовые рецепторы имеются в почечных артериолах, клубочках и проксимальных канальцах. Их стимуляция усиливает экскрецию ионов Na4" с мочой, а снижение содержания допамина в почках тормозит выделение натрия, что является важным компонентом депрессорной системы почек. Депрессорным эффектом сопровождается и стимуляция допаминовых нейронов головного мозга.
Собственные сосудистые (эндотелиальные) механизмы регуляции АД.
В последние годы установлена важная роль эндотелия сосудистой стенки в регуляции кровотока. Триллион клеток эндотелия выстилает изнутри все древо сердечно-сосудистой системы. У человека с массой тела 75 кг общая поверхность сосудов, выстланная эндотелием, достигает 1300 м2 и весит около 2 кг. Эндотелий синтезирует и выделяет факторы, активно влияющие на тонус гладких мышц сосудов. Клетки эндотелия — эндотелиоциты, под влиянием химических раздражителей, приносимых кровью, или под влиянием механического раздражения (растяжение) способны выделять вещества, действующие на гладкие мышечные клетки сосудов, вызывая их сокращение или расслабление. Срок жизни этих веществ мал, поэтому действие их ограничивается сосудистой стенкой и не распространяется обычно на другие гладкомышечные органы. Кроме простациклина, активным фактором, вызывающим расслабление сосудов, является оксид азота — N0. Расширение сосудов обусловлено диффузией N0 из эндотелия к гладкомышечным клеткам стенки сосуда, активацией в них гуани-латциклазы и образованием цГМФ. Повышение уровня цГМФ приводит к снижению концентрации ионов кальция в цитозоле клеток и ослаблению связи между миозином и актином, что приводит к расслаблению мышечных клеток сосудов. Показано, что торможение синтеза NO приводит к развитию NO-дефицитной гипертензии.
В скелетных мышцах в процессе расширения сосудов участвует и ацетилхолин, воздействующий через эндотелиальный релаксирующий фактор.
Регуляция коронарного кровообращения.
Осуществляется миогенными, гуморальными и нервными механизмами. Первый обусловлен автоматией гладких мышц сосудов и обеспечивает поддержание постоянства коронарного кровотока при колебаниях артериального давления от 75 до 140 мм рт.ст. Важнейшим является гуморальный механизм. Наиболее мощным стимулятором расширения коронарных сосудов является недостаток кислорода. Дилатация сосудов наступает при снижении содержания кислорода в крови всего на 5%. Предполагают, что в условиях гипоксии миокарда не происходит полного ресинтеза АТФ, что приводит к накоплению аденозина. Он тормозит сокращения ГМК сосудов. Расширяют сердечные сосуды гистамин, ацетилхолин, простагландины Е. Симпатические нервы обладают слабым сосудосуживающим влиянием. Слабое вазодилататорное действие оказывают парасимпатические нервы. Ишемия миокарда приводит к тяжелым нарушениям деятельности сердца. Уже через 6-10 минут прекращения кровотока наступает остановка сердца. Если аноксия длится 30 мин, то развиваются и структурные изменения в миокарде. После этого восстановить работу сердца невозможно. Поэтому 30-ти минутный срок называется вторым пределом реанимации (если гипотермия мозга).
Регуляция мозгового кровообращения.
Тонус сосудов мозга регулируется миогенными, гуморальными и нейрогенными механизмами. Миогенный проявляется сокращением гладких мышц сосудов при повышении кровяного давления и наоборот расслаблением при его понижении. Он стабилизирует быстрые колебания кровотока. В частности, при изменениях положения тела. Нервная регуляция осуществляется симпатическими нервами, которые кратковременно и незначительно суживают сосуды. Основная роль принадлежит гуморальным факторам, в первую очередь метаболическим. Увеличение концентрации углекислоты в крови сопровождается выраженным расширением сосудов мозга. Подобным же действием обладают катионы водорода, поэтому сдвиг реакции крови в кислую сторону приводит к вазодилатации. При гипервентиляции содержание СО2 падает, сосуды мозга суживаются, мозговой кровоток уменьшается. Возникают головокружение, спутанность сознания, судороги и т.д. Аденозин, брадикинин, гистамин расширяют сосуды. Вазопрессин, серотонин, ангиотензин суживают их.
Регуляция легочного кровообращения.
Местная регуляция легочного кровотока в основном представлена метаболическими факторами, ведущая роль среди которых принадлежит РО2 и РСО2. При снижении РО2 и/или повышении РСО2 происходит вазоконстрикция легочных сосудов.
Нервная регуляция легочного кровотока осуществляется в основном симпатическими сосудосуживающими волокнами. Система легочного кровообращения выделяется среди всех сосудистых регионов наибольшей функциональной взаимосвязью с регуляцией гемодинамики в большом круге кровообращения. Гуморальная регуляция легочного кровообращения в значительной степени обусловлена влиянием ангиотензина 2, адреналина, норадреналина, ацетилхолина, брадикинина, серотонина, гистамина, простагландинов, которые вызывают свои сосудистые эффекты.
Пищеварение в ротовой полости. Жевание, его фазы. Регуляция жевания.
Пищеварение в ротовой полости.
Ротовая полость — начальный отдел пищеварительного тракта. Сверху она ограничена твёрдым и мягким нёбом, снизу диафрагмой рта, а спереди и с боков — зубами и дёснами.
В полость рта открываются протоки трёх пар слюнных желёз: околоушных, подъязычных и подчелюстных. Кроме этих имеется масса мелких слизистых слюнных желёз, разбросанных по всей ротовой полости.
Секрет слюнных желёз — слюна — смачивает пищу и участвует в её химическом изменении. В слюне содержатся только два фермента — амилаза (птиалин) и мальтаза, которые переваривают углеводы. Но так как в ротовой полости пища находится недолго, расщепление углеводов не успевает закончиться. В слюне содержатся также муцин (слизистое вещество) и лизоцим, обладающий бактерицидными свойствами. Состав и количество слюны может изменяться в зависимости от физических свойств пищи. В течение суток у человека выделяется от 600 до 150 мл слюны.
Жевание. Фазы и функции жевания. Роль зубов в механической обработке пищи.
Жевание - это основная функция зубочелюстной системы. Это начальная фаза процесса поглощения пищи, которая состоит в измельчении, перемешивании пищи со слюной и формировании пищевого комка. Совокупность процессов направленных на измельчение пищи в полости рта является основной функцией жевания.
Жевание воздействует на желудочно- кишечный тракт и обеспечивает химическую, механическую и рефлекторную фазы. Стимулирует обмен веществ и влияет на формирование челюстей и лица человека. Полноценное жевание положительно влияет на обмен веществ и кровообращение. В среднем жевание отдельной, не грубой порции пищи длится 10 секунд.
Процесс жевания состоит из двух фаз – откусывание пищи и разжевывание.
Механическая обработка пищи проводится зубами, которые совершают цикл движений одновременно с нижней челюстью. В движениях нижней челюсти различаются основные и вспомогательные движения. Основные движения связаны с разламыванием пищи, вспомогательные захватывают и перемещают пищу в полости рта во время осуществления жевания. Откусывание пищи происходит передними зубами, раздробление происходит при помощи премоляров и клыков. Далее пища подвергается растиранию с помощью активных движений в стороны нижней челюсти. В этот период происходит активное выделение слюны, которая способствует образованию пищевого комака. Степень измельчения откушенной пищи регулируется специальными рецепторами слизистой оболочки рта и языка. Частицы измельченной пищи собираются для следующей механической обработки. Функция жевания может происходить на одной или на обеих сторонах. Передача пищи совершается при помощи губ, языка и щек.
При осуществлении функции жевания довольно важная роль отводится так же слизистой оболочке полости рта, мягкому небу и слюнным железам. Этот сложный комплекс секреторной и двигательной деятельности жевательного аппарата способствует не только измельчению пищи, но и подготовку ее к проглатыванию. Жевательные движения нижней челюсти отличатся определенным ритмом и постоянством, в зависимости от рода пищи. Нормальная функция пищеварительной системы обеспечивает сложное взаимодействие условных и безусловных рефлексов. Она осуществляет постепенное и тщательное пережевывание пищи. Нарушения функции жевания приводит к возникновению множества проблем, которые связаны с правильностью зубочелюстной системы. В процессе жевания на зубочелюстную систему оказывается сильное давление, которое вызывает функциональные раздражения, которые могут быть стимулом для правильного развития и формирования челюстных и лицевых костей. Смена зубов и установка межзубных контактов приводит к снижению эффективности функции жевания. В большинстве случае в это выражено при смене молочных зубов в детстве. При смене клыков и резцов резких изменений в жевательной функции не происходит. Привычка пережевывания пищи только передними зубами приводит к формированию перекрестного или мезеального прикуса.
Регуляция жевания.
Обычно сигналом для начала жевания служит поступление в ротовую полость твердой пищи. Но жевание может инициироваться и произвольно.
Импульсы от рецепторов полости рта в основном по волокнам тройничного нерва передаются в сенсорные ядра продолговатого мозга, ядра зрительного бугра, оттуда — в кору большого мозга. В координации жевания большую роль играют рецепторы жевательных мышц и зубов.
От ствола мозга и зрительного бугра коллатерали отходят к ретикулярной формации.
В регуляции жевания принимают участие двигательные ядра продолговатого мозга, красное ядро, черное вещество, подкорковые ядра и кора большого мозга. Совокупность управляющих жеванием нейронов различных отделов мозга называют центром жевания.
Эфферентами являются двигательные ветви тройничного нерва,идущие к жевательным мышцам.
Слюноотделение. Функции слюны. Регуляция слюноотделения. Морфофункциональная организация рефлекса слюноотделения.
Слюноотделение. Функции слюны.
Слюна продуцируется :
крупными слюнными железами (три пары)
околоушными
поднижнечелюстная
подъязычная
мелкими железами (множеством)
языка
слизистой оболочки неба
слизистой оболочки щёк
Значение (функции) слюны
Под действием слюны начинается переваривание углеводов.
Слюна растворяет пищу, облегчает жевание и глотание, смазывает пережеванную пищу.
Способствует вкусовым ощущениям.
Поддержание влажности в ротовой полости необходимо для речевой функции (артикуляции).
Слюна содержит антимикробные и антивирусные факторы: лизоцима, пероксидазы, ионов тиоцианата., иммуноглобулина А.
Секреция гидролитических ферментов, помогающих разложению остатков пищи вокруг зубов.
При уменьшении слюноотделения возникает чувство жажды, стимулирующее потребление жидкости.
Участие в терморегуляции (испарение).
Секреция гуморальных факторов роста (эпидермального и нервного).
У грудных детей — герметизирующая роль, облегчающая акт сосания молока.
Поддержание влажности слизистой ротовой полости необходимо для ее целостности. Слизь слюны выполняет защитную функцию, покрывая нежную слизистую оболочку рта и пищевода.
Слюна важна для сохранения зубов; в ее отсутствие они поражаются кариесом и выпадают.
Регуляция слюноотделения. Морфофункциональная организация рефлекса слюноотделения.
Слюноотделениерегулируетсярефлекторно(по механизмам безусловного и условного рефлексов).
Выделение слюны по механизму безусловного рефлекса
Используются контактные рецепторы:
Контактные
Вкусовые (хеморецепторы)
Тактильные (осязательные) рецепторы
Терморецепторы (холодовые, тепловые)
Механорецепторы жевательных мышц
Дистантные - обонятельные
Возбуждение от рецепторов слизистой оболочки рта передается по веточкам тройничного и языкоглоточного нервов в центры, находящиеся в продолговатом мозге.
Центробежную функцию выполняют парасимпатические и симпатические нервы.
Первые из них усиливают слюноотделение и, в частности, обусловливают выделение жидкой слюны в больших количествах.
Раздражение симпатических нервов вызывает незначительное отделение густой слюны с обильным содержанием органических веществ.
Соотношение между одновременным воздействием парасимпатических и симпатических нервов определяет объем, состав и плотность слюны.
