
- •2. Инозитолтрифосфат и даг:
- •3.ЦГмф:
- •4.Проникновение гидрофобных гормонов в клетку:
- •3) Маркеры заболеваний бронхолёгочной системы. Механизмы повреждающего действия полимеров α1-антитрипсина.
- •2.Репарация днк. Этапы репарации. Дефекты репарации.
- •2.Катаболизм пиримидиновых нуклеотидов
- •Первый этап:
- •Второй этап:
- •Третий этап:
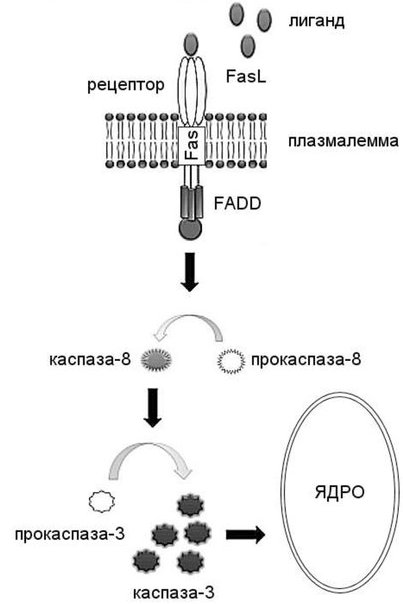
- •2.Рецепторзависимый сигнальный путь
2.Рецепторзависимый сигнальный путь
Процесс апоптоза часто начинается с взаимодействия специфических внеклеточных лигандов с рецепторами клеточной гибели, которые находятся на поверхности клеточной мембраны. Рецепторы, воспринимающие сигнал апоптоза, относятся к суперсемейству TNF-рецепторов( «рецептор фактора некроза опухолей»). Все рецепторы смерти представляют собой трансмембранные белки, характеризующиеся наличием общей последовательности из 80 аминокислот в цитоплазматическом домене. Данная последовательность называется доменом смерти (кратко DD) и является необходимой для трансдукции сигнала апоптоза. Внеклеточные участки рецепторов смерти взаимодействуют с тримерами лигандов (CD95L, TNF, Apo3L, Apo2L и т. п.). Тримеры лигандов в результате взаимодействия тримеризуют рецепторы смерти (то есть «сшивают» 3 молекулы рецептора). Активированный таким образом рецептор взаимодействует с соответствующим внутриклеточным адаптером (или адаптерами). Для рецептора CD95 адаптером является FADD («белок, взаимодействующий с доменом смерти Fas-рецептора»). Для рецепторов TNFR1 и DR3 адаптером является TRADD («белок, взаимодействующий с доменом смерти TNFR1-рецептора»).
Адаптер, ассоциированный с рецептором смерти, вступает во взаимодействие с эффекторами — пока ещё неактивными предшественниками протеаз из семейства инициирующих каспаз — с прокаспазами. В результате цепочки взаимодействия «лиганд-рецептор-адаптер-эффектор» формируются агрегаты, в которых происходит активация каспаз. Данные агрегаты именуются апоптосомами, апоптозными шаперонами или сигнальными комплексами, индуцирующими смерть . Посредством рецепторов смерти могут быть активированы три инициирующие каспазы: −2; −8 и −10. Активированные инициирующие каспазы далее участвуют в активации эффекторных каспаз.
3. Роль нейраминидазы и гемаглютининов в вирусной репликации. Задача: про алкоголика и действие обезболов
Билет б/н (8)
1) Роль АФК в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Кислородзависимый фагоцитоз реализуется через образование значительного количества продуктов с токсическим дейсвтием, повреждающих микроорганизмы и окружающие структуры. За их образование ответсвенны НАДФ –оксидаза плазматической мембраны и цитохром b, в присутсвии хинонов этот, комплекс трансформирует 02 в анион супероксида (02-). Последний проявляет выраженное повреждающее действие, а также быстро трансформируется в перекись водорода по схеме: 202 + Н20 = Н202 + О2 (процесс катализирует фермент супероксид дисмутаза).
Пероксид водорода (H202) проявляет меньший повреждающий эффект, но в его присутствии фермент миелопероксидаза конвертирует ионы Сl в ионы НСlO-, обладающие бактерицидным действием, во многом аналогичным эффекту хлорной извести (NaClO).
Кислородзависимые механизмы
Считается, что начальным этапом в образовании биоцидных кислородных радикалов и метаболитов является восстановление молекулярного кислорода НАДФН-оксидазой с образованием супероксидного анион-радикала, который становится родоначальником других биоцидных соединений. Образовавшийся радикал кислорода не обладает бактерицидным свойством. Оно характерно для Н2О2, образующегося при дисмутации кислотного радикала и спонтанно.
Пероксид водорода может оказывать бактерицидное действие особенно в присутствии аскорбиновой кислоты и Fe , но это действие несравнимо с эффектом в присутствии миелопероксидазы. (МПО)
МПО- фермент, синтез которого происходит на стадии промиелоцита, после чего миелопероксидаза локализуется в азурофильных гранулах нейтрофильных гранулоцитах.
Кислороднезависимые механизмы активируются в результате контакта опсонизированного объекта с мембраной фагоцита. В процессе фагосомолизосомального слияния первыми с мембраной фагосомы сливаются гранулы, содержащие лактоферрин и лизоцим, затем к ним присоединяются азурофильные гранулы, содержащие катионные белки (например, САР57, САР37), протеиназы (например, эластазу и коллагеназу), катепсин G, дефензины и др. Эти продукты вызывают повреждение клеточной стенки и нарушение некоторых метаболических процессов; в большей степени их активность направлена против грамположительных бактерий.
Роль АФК в фагоцитозе
В результате воздействия НАДФ – оксидазы, АФК повреждают структуры фагоцитированного антигена
Образованная Н2О2 вместе с ионов Fe2 может происходить реакция Фентона с образованием чрезвычайно активного гидроксил-радикала. Наличие одновременно H2O2 и супероксида запускает реакцию Хабера-Вайса.
2) Адреналин: химическая природа, механизм действия, органы-мишени, биологические эффекты. Адреналин – гормон стресса, синтезируется из аминокислоты тирозина в мозговом веществе надпочечников. Транспорт в крови в комплексе с альбумином, Т1/2 –30 сек. Механизм действия – мембранно-внутриклеточный, мессенджеры цАМФ, И3Ф. Запасается в гранулах с АТФ в соотношении 4А:1АТФ. Регуляция синтеза и секреции. Активаторы: стимуляция чревного нерва, стресс. Уменьшают секрецию - гормоны щитовидной железы. Адреналин подавляет секрецию инсулина и повышает секрецию глюкагона. Клетки мишени: миоциты, кардиомиоциты, гепатоциты, адипоциты, ССС. Влияние на метаболизм: усиливает распад гликогена (активируя гликогенфосфорилазу каскадным механизмом аденилатциклазной системы), глюконеогенез (активирует ферменты: пируваткарбоксилазу, ФЕПкарбоксикиназу, фруктозо-1,6-дифосфатазу, глюкозо-6-фосфатазу), гликолиз (активирует фермент: фосфофруктокиназу), липолиз ТАГ (активирует фермент: ТАГ-липазу), ß-окисление ВЖК. Суммарный биологический эффект: увеличение концентрации в крови: ВЖК, ХС, ФЛ, глюкозы. Общий биологический эффект: суживание сосудов, следовательно, повышение АД, повышение сердечной функции, расширение бронхов. Катаболизм адреналина протекает в печени до ванилил-миндальной кислоты и метадреналина, и лишь 5% выделяется в неизменном виде с мочой.
39 билет 1. Гликолиз + энергетический выход гликолиза Гликолиз – это специфический путь катаболизма глюкозы, в результате которого происходит расщепление глюкозы с образованием
2 молекул пирувата - аэробный гликолиз
2 молекул лактата - анаэробный гликолиз
Все этапы гликолитического пути окисления глюкозы происходят в цитозоле.
Превращение глюкозы в 2 молекулы глицеральдегид-3-фосфата. Происходит потребление 2 АТФ
Превращение глицеральдегида в пируват или лактат.Происходит образование 2 АТФ, и НАДФН+Н+
В результате 6 реакции образуется НАДФН+Н+. Передача водорода на ЦПЭ в митохондриях происходит за счет челночных систем:
Глицерофосфатная челночная система– водород передается на FAD-зависимую дегидрогеназу, Р/О=2
В цитозоле метаболиты
гликолиза – диоксиацетонфосфат и НАДН
образуют глицерол-3-фосфат,
поступающий в митохондрии. Там он
окисляется с образованием ФАДН2.
Далее ФАДН2 направляется
в
дыхательную цепь
и используется для получения энергии
Малат-аспартатная челночная система – водород поступает в ЦПЭ через митохондриальный NAD и Р/О=3
В
цитоплазме NADH восстанавливает
оксалоацетат в малат, который при
участии переносчика проходит в
митохондрии, где окисляется в оксалоацетат
NAD-зависимой малатдегидрогеназой.
Восстановленный в ходе этой реакции
NAD отдаёт водород в митохондриальную
ЭТЦ. Однако образованный из малата
оксалоацетат выйти самостоятельно из
митохондрий в цитозоль не может, так
как мембрана митохондрий для него
непроницаема. Поэтому оксалоацетат
превращается в аспартат, который и
транспортируется в цитозоль, где снова
превращается в оксалоацетат.
Далее пируват окисляется до ацетил-КоА и поступает в ЦТК
Особенность метаболизма углеводов в нервной ткани.Глюкоза-основной субстрат для получения энергии в клетках нервной системы. Собственные запасы глюкозы в мозговой ткани очень малы, по сравнению с высокой активностью окисления. Поступает в нервную ткань путем облегченной диффузии.
85-90% глюкозы окисляется до воды и СО2, 5% расходуется в реакциях гликолиза с образованием молочной кислоты.
Основной метаболический путь - аэробный гликолиз. Поэтому при недостатке кислорода могут возникать нарушения деятельности мозга. Использование глюкозы зависит от активности гексокиназы(на 1 изоформу приходится 90% активности, на 2 – 10%). Несмотря на то что, ГМ – инсулиннезависимая ткань, при СД он испытывает некоорый недостаток(из-за того, что инсулин влияет на активность гексокиназы).
В глиальных клетках работает ЛДГ5 (находится в цитозоле) ПВК лактат(в сторону лактата)
В нейронах работает ЛДГ1 (находится в мх) ПВК лактат (в сторону ПВК)
Особенности энергетического обмена в нервной ткани.
ГМ составляет 2% от массы тела, но потребляет 20-25% кислорода. 3% кислорода от этого количества потребляет ПНС. 67% расходуемого кислорода приходится на нейроны. 30% - на глиальные клетки.
Активность фермента Mg2+-зависимой K+Na+-АТФазы выше в ГМ, чем в других тканях. Высокая потребность нейронов в энергии объясняется необходимостью синтеза нейромедиаторов.
В условиях голодания субстратом для получения энергии могут стать кетоновые тела, свободные жирные кислоты.
2. Роль Са в мышечном сокращении. Миозиновая и актиновая регуляция сокращения Каждая миофибрилла окружена мембранным мешочком каркоплазматического ретикулума, который Са, Mg, АТФ-азу, обеспечивающая перекачку Са из саркоплазмы в ретикулум против градиента концетрации. С помощью белка – кальсеквестрина Са активным транспортом попадает в ретикулум. Так же при поступлении нервного импульса открывается белок SR-Foot, и происходит пассивный транспорт Са из ретикулума в саркоплазму.
В процессе возбуждения вознкиает трансмембранный ток ионов, входящих в клетку. Быстрый вход Na вызывает формирование потенциала действия и последующий медленный вход Са – это деполяризация сарколеммы. При гидролизе 1 АТ в ретикулуме накапливается 2 иона Са.
При возбуждении мембраны саркомера Са быстро высвобождается из ретикулума в саркоплазму. При этом тропонин С насыщается Са, образуя с ним комплекс, который взаимодействует с тропонином I и тропонином Т, влияя на тропомиозин. При этом изменяется конформация актина так, что миозиновая головка с продуктами гидролиза АТФ соединяется с F-актином и происходит сократительный цикл.
В миокарде основным источником Са служит внеклеточная жидкость. При отсутствии Са сокращение прекращается в течение 1 минуты, а скелетная мышца может сокращаться в такой ситуации часами .
Актиновая регуляция
Характерна для миокарда и скелетных мышц .
Основным действующим механизмом регуляции сокращения является аллостерический механизм, представленный в мышце актином, тропомиозином, тропонин С,Т,I и Са. Са вызывает перемещение нити тропомиозина относительно актина путем увеличения его спирализации, что позволяет головке миозина соединится с актином. Таким образом, тропомиозин обладает способностью блокировать взаимодействие актина и миозина. Тропонин I предотвращает присодинение миозиновой головки к актину.
Регуляция уровня Са в саркоплазе принимает участие так же фермент Mg,Ca-АТФ-аза и система Na/Ca- обмена, которые поддерживают необходимую концентрацию Са,в ыкачивая его из клетки.
Миозиновая регуляция
Характерен для гладкой мускулатуры. Это свяазано с тем, что в гмк нет упорядоченности нитей миозина и нет тропониновой системы. Миозин имеет молекулярную структуру.
Для активации миозиновой АТФ-азы, с целью обеспечения взаимодействия с F-актином, необходимо фосфорилирование легкой цепи миозина, которое происходит с участием активированной комплексом кальмодулин х 4Са с АМФ-зависимой киназы. Таким образом, фосфорилирование миозина стимулирует его АТФ-азную активность и запускает сократительный цикл.
3. Протеогликаны Задача про билирубин
19 билет: 1. Синтез мочевины: схема реакций, суммарное уравнение. В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании.
Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
ЦТК

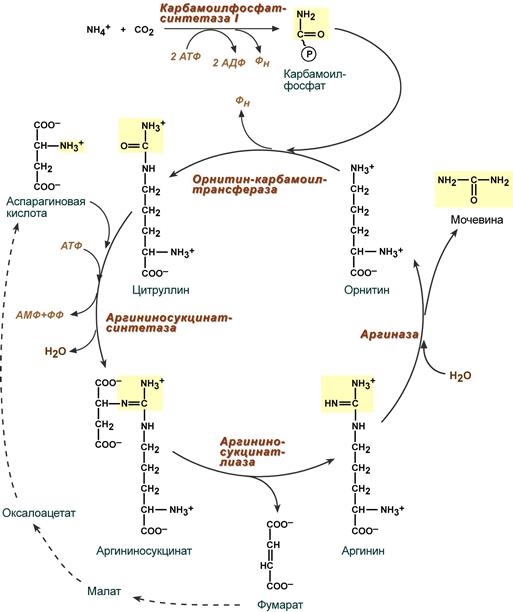
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
Допустимое значение 2,5—8,3 миллимолей на литр в крови
Нарастание содержания мочевины в крови
до 16—20 ммоль/л - нарушение функции почек средней тяжести,
до 35 ммоль/л — как тяжелое;
свыше 50 ммоль/л — очень тяжелое.
при острой почечной недостаточности - 50—83 ммоль/л.
Увеличение содержания мочевины в крови наблюдается при:
усиленном её образовании в результате богатого белками рациона питания, чрезмерного катаболизма белка, лейкозов, желтухи, тяжелых инфекционных заболеваний, непроходимости кишечника, ожогов, дизентерии, шока;
кровотечении из верхних отделов желудочно-кишечного тракта;
приеме некоторых лекарств - сульфаниламидов, левомецитина, тетрациклина и других.
Снижение содержания мочевины в крови наблюдается при:
особенно тяжелых поражениях печени, в частности при отравлении фосфором, мышьяком, декомпенсированном циррозе;
голодании;
пониженном катаболизме белков;
после введения глюкозы;
после гемодиализа.
Норма мочевины в моче330 до 580 ммоль/сутки.
Увеличение экскреции мочевины с мочой наблюдается при:
злокачественной анемии (вследствие отрицательного азотистого баланса);
лихорадке;
после приема лекарственных препаратов (салицилатов, хинина и др.);
гиперпротеиновой диете;
гиперфункции щитовидной железы;
в послеоперационный период.
Уменьшение экскреции мочевины с мочой наблюдается при:
нефрите, уремии;
нарушении функции почек;
нефропатии беременных;
паренхиматозной желтухе (вследствие нарушения образования мочевины);
острой дистрофии печени;
прогрессирующем циррозе печени;
приеме анаболитических гормонов (положительный азотистый баланс).
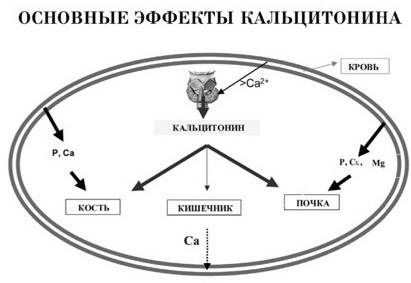
2. Кальцитонин: химическая природа, механизм действия и биологические эффекты. Паратиреоидный гормон: химическая природа, органы- мишени, биологические эффекты. Влияние на обмен кальция и фосфора гипо- и гиперпродукции ПТГ. Кальцитонинвырабатывается и секретируется клетками ЩЖ. В небольшом количестве его также могут вырабатывать тимус и паращит.железа.
Хим.природа – пептидная.
Механизм действия: мембранно-внутриклеточный.
Органы-мишени – кости (остеокласты), почки, желудок, кишечник, клетки ЦНС.
Стимулируют биосинтез и секрецию кальцитонина – гастрин и высокое содержание Ca2+ в крови.
Кальцитонин антагонист ПТГ по биологическим эффектам – тормозит резорбтивные процессы в костной ткани и снижает уровень ионизированного кальция и фосфатов в крови.
Биологические эффекты:
Подавляет резорбцию костного минерала остеокластами
Подавляет реабсорбцию ионов Ca и фостфатов, а также ионов Na, K, Mg.
Снижает секрецию гастрина и соляной кислоты в желудке; трипсина и амилазы в экзокринной части поджелудочной железы.
Усиливает поступление в кишечник Н2О и ионом Na, K, Cl.
Оказывает прямой анальгетический эффект, действуя на рецепторы клеток гипоталамуса и лимбической системы.
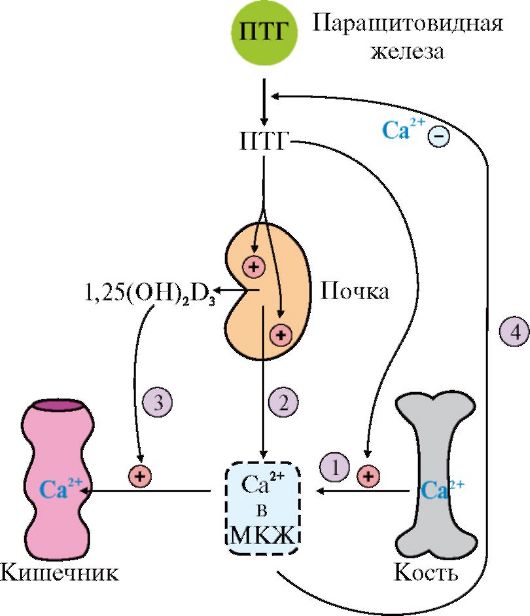
Паратгормонсинтезируется паращитовидными железами в видепрепро- гормона, который затем превращается в зрелый гормон путем частичного протеолиза.
ПТГ секретируется в ответ на снижение концентрации кальция в крови.
Основными органами-мишенями для гормона являются кости и почки.
Гормон инициирует каскад событий, связанный с аденилатциклазойостеоБластов, которые стимулируют метаболическую активность остеоКластов. Происходит мобилизация Са2+ из кости и поступление фосфатов в кровь, а дистальных канальцах почек стимулируется реабсорбцияфосфатов, в результате чего восстанавливается нормальный уровень Са2+ во внеклеточной жидкости.
Гиперпаратиреоз.Избыточная секреция паратгормона, возникающая в результате опухоли околощитовидной железы, диффузной гиперплазии желез, карциномы паращитовидной железы (первичный гиперпаратиреоз), приводит к повышению мобилизации кальция и фосфатов из кости, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия, которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляется общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья.Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии.
Гипопаратиреоз. Основным симптомом гипопаратироза, обусловленного недостаточностью паращитовидных желез, является гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические и сердечно-сосудистые нарушения, а также поражения соединительной ткани.У больного гипопаратиреозом отмечается повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
1 - ПТГ
стимулирует мобилизацию кальция из
кости; 2 - ПТГ стимулирует реабсорбцию
ионов кальция в дистальных канальцах
почек;
3
- ПТГ активирует образование 1,25(OH)2D3
в почках, что приводит к стимуляции
всасывания Са2+
в кишечнике

3. Патобиохимия инфаркта миокарда. Особенности обмена белков. Образование аммиака идет пуриновым циклом; Интенсивно идет переаминирование оксалоацетата с различными аминокислотами, поэтому высока в клетках активность АсАТ (аспартатаминотрансферазы). Активность АсАТ в сердечной мышце почти в 10.000 раз выше, чем в сыворотке. Повышение активности АсАТ в сыворотке крови отмечено при целом ряде заболиваний и особенно при поражении сердечной мышцы (инфаркт миокарда), когда идет разрушении клеток миокарда с выходом АсАТ в кровь.
Ранние маркеры некроза миокарда:
Миоглобин
МВ-КФК (сердечная форма креатинфосфокиназы — КФК)
Сердечная форма белка, связывающего жирные кислоты (сБСЖК)
Поздние маркеры некроза миокарда:
Лактатдегидрогеназа (ЛДГ)
Аспартатаминотрансфераза (АсАТ)
Сердечные тропонины I и Т
ЗАДАЧА: При проведении теста на толерантность к глюкозе её кон- центрация в крови натощак и через 2 ч после сахарной нагрузки оказалась, соответственно 5 и 11,1 ммоль/л. Имеется ли в этих результатах отклонение от нормы? С какой целью выполнено это исследование?
32 билет 1) Функции желчных кислот + энтерогепатическая циркуляция Синтез желчных кислот
Образование желчных кислот идет в эндоплазматическом ретикулуме при участии цитохрома Р450, кислорода, НАДФН и аскорбиновой кислоты. 75% холестерина, образуемого в печени, участвует в синтезе желчных кислот.
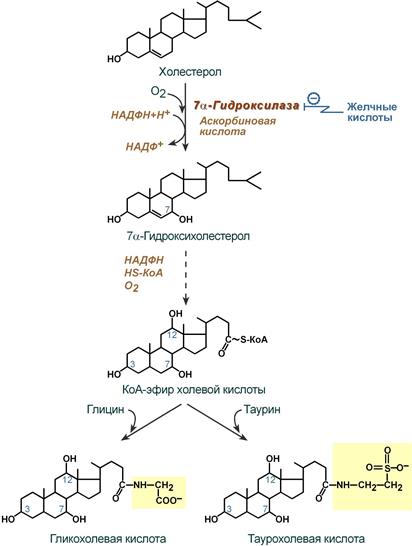
Реакции синтеза желчных кислот на примере холевой кислоты
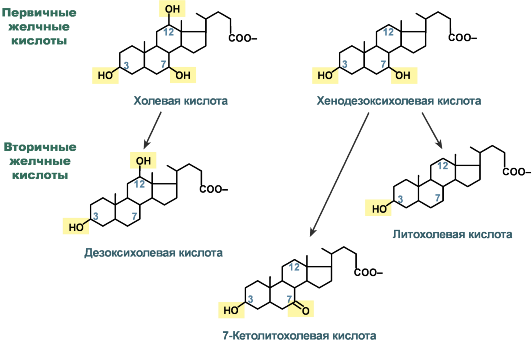
В печени синтезируются первичные желчные кислоты:
холевая (3α, 7β, 12α, гидроксилирована по С3, С7, С12),
хенодезоксихолевая (3α, 7α, гидроксилирована по С3, С7).
Затем они образуют парные желчные киcлоты – конъюгаты с глицином(гликопроизводные) и с таурином (тауропроизводные), в соотношении 3:1 соответственно.
Основные функции желчных кислот состоят в образовании мицелл, эмульгировании жиров и солюбилизации липидов в кишечнике.
Регуляция синтеза желчных кислот. Регуляторный фермент – 7-альфа-гидроксилаза ингибируется желчными кислотами, то есть накопление в печени желчных кислот ведет к снижению синтеза желчных кислот. Кроме того, важное значение имеет энтерогепатическая циркуляция: прерывание циркуляции приведет к повышению синтеза желчных кислот. Другие механизмы регуляции 7-альфа-гидроксилазы: - фосфорилирование/дефосфорилирование, причем активна фосфорилированная форма; - изменение количества фермента.
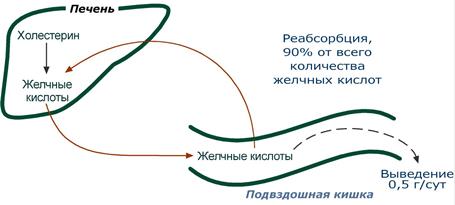
Кишечно-печеночная циркуляция
Рециркуляция
заключается в непрерывном движении
желчных кислот из гепатоцитов в просвет
кишечника и реабсорбция их большей
части в подвздошной кишке, что сберегает
ресурсы холестерола. В сутки происходит
6-10 таких циклов. Таким образом, небольшое
количество желчных кислот (всего 3-5 г)
обеспечивает переваривание липидов,
поступающих в течение суток. Потери в
размере около 0,5 г/сут соответствуют
суточному синтезу холестерола de novo.
Роль желчи в мицеллообразовании и эмульгировании жиров:
В связи с наличием в структуре α-гидроксильных групп желчные кислоты и соли желчных кислот являются амфифильными соединениями и обладают свойствами детергентов. Основные функции желчных кислот состоят в образовании мицелл, эмульгировании жиров и солюбилизации липидов в кишечнике. Это повышает эффективность действия панкреатической липазы и способствует всасыванию липидов.
Молекулы желчных кислот фиксируются на мицелле своими неполярными частями, обеспечивая ее растворимость. Липаза агрегирует с желчными кислотами и гидролизует жиры (триацилглицерины), содержащиеся в жировой капле.
2) Обмен железа: основные функции, пул железа в организме. Всасывание железа в кишечнике, «ферритиновый» блок. Транспорт железа в плазме крови. Нарушения метаболизма железа (железодефицитные состояния, гемосидероз). Железо входит в состав гемсодержащих белков, а также металлофлавопротеинов, железосерных белков, трансферрина, ферритина.
1. Источником железа при биосинтезе белков, содержащих железо, являются пищевые продукты. Обычно всасывается не более 10% железа пищи. Железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезенки, может повторно использоваться для синтеза железосодержащих белков.
Кислая среда желудка и присутствие в пище аскорбиновой кислоты, восстанавливающей Fe 3+, способствуют освобождению железа из солей органических кислот пищи (рис. 13.3).
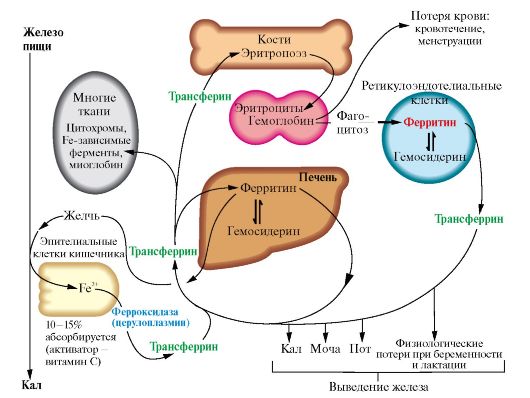
2. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин улавливает железо в клетках слизистой кишечника и превращается в ферритин, который остается
• Железо поступает с пищей, транспортируется кровью в форме трансферрина, запасается в виде ферритина и используется для синтеза цитохромов, железосодержащих ферментов, гемоглобина и миоглобина.
• Организм теряет железо с мочой, калом, потом и при кровотечениях.
• Гемосидерин аккумулирует избыток железа
в энтероцитах. Это снижает поступление железа в кровь из клеток кишечника. Когда потребности в железе невелики, скорость синтеза апоферритина повышается. Слущивание клеток слизистой оболочки кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется.
Фермент крови ферроксидаза (церулоплазмин) окисляет железо, оно связывается с гликопротеином крови трансферрином и транспортируется кровью (рис. 13.4).
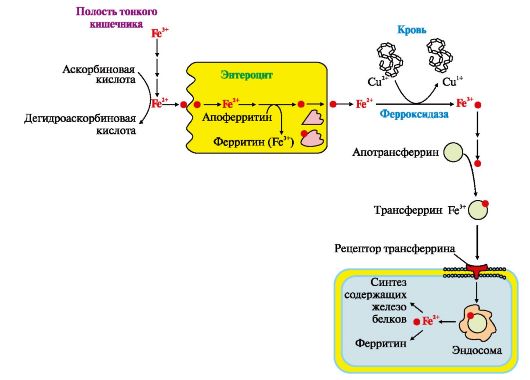
3. Трансферрин взаимодействует со специфическими рецепторами и поступает в клетки. Количество рецепторов трансферрина зависит от содержания железа в клетках и регулируется на уровне транскрипции гена белкарецептора. При снижении содержания железа в клетках скорость синтеза рецепторов повышается, и наоборот. В полости кишечника Fe3+ высвобождается из белков и солей органических кислот пищи. Усвоение Fe3+ улучшает аскорбиновая кислота, восстанавливающая его до Fe+2. Поступление Fe2+ из слизистой оболочки кишечника в кровь сопровождается окислением железа медьсодержащим ферментом плазмы крови ферроксидазой. Избыток поступившего в клетки слизистой оболочки кишечника железа соединяется с белком апоферритином, который окисляет железо и превращается в ферритин. В крови Fe3+ транспортирует белок плазмы крови трансферрин. В тканях Fe2+ используется для синтеза железосодержащих белков или депонируется в составе ферритина.
4. Белок ферритин играет роль депо железа в клетках печени, селезенки, костного мозга. Избыток железа аккумулируется в печени и других тканях в составе гранул гемосидерина. Если количество железа в клетках превышает объем ферритинового депо, то оно откладывается в белковой части молекулы ферритина. Таким образом ферритин превращается в гемосидерин, который плохо растворим в воде и может содержать до 37% железа. Накопление гранул гемосидерина в ретикулоэндотелиоцитах печени и селезенки может привести к повреждению органа - гемохроматозу.
При недостаточном поступлении или нарушении утилизации железа развивается железодефицитная анемия.
3) использование рекомбинантный ДНК в медицине 4) задача про трипсин
33 билет 1) Буферные системы крови и механизм их действия. Роль почек и легких в поддержании буферной емкости крови. Параметры оценки кислотно-основного состояния организма. Причины развития и формы ацидоза и алкалоза. Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+, включающие кислотно-основные пары: слабое основание (анион, А–) и слабая кислота (Н-А).
БИКАРБОНАТНАЯ БУФЕРНАЯ СИСТЕМА Эта система состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3)
Работа этой системы неразрывно и тесно связана с легкими.
При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота. В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
NaНСО3 + Н-Анион ↔ Н2СО3 + Na+ + Анион–
При поступлении оснований они реагируют с угольной кислотой и образуют соли бикарбонатов:
H2CO3 + Катион-ОН ↔ Катион+ + HCO3– + Н2О
Возникающий при этом дефицит угольной кислоты компенсируется уменьшением выделения CO2 легкими.
При накоплении угольной кислоты в крови не происходит параллельного значимого увеличения концентрации НСО3–, т.к. она очень плохо диссоциирует.
Благодаря работе бикарбонатного буфера концентрация водородных ионов понижается по двум причинам:
o угольная кислота является очень слабой кислотой и плохо диссоциирует,
o в крови легких благодаря присутствию в эритроцитах фермента карбоангидразы, угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Н2СО3 ↔ Н2О + СО2↑
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
ФОСФАТНАЯ БУФЕРНАЯ СИСТЕМА. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами.. При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
HPO42– + Н-Анион ↔ H2PO4– + Анион–
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+ , а расход ионов Н+ восполняется повышением диссоциации NaH2PO4. H2PO4– + Катион-ОН ↔ Катион+ + HPO42– + Н2О Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и мочи.
БЕЛКОВАЯ БУФЕРНАЯ СИСТЕМА Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. В кислой среде подавляется диссоциация СООН-групп, а группы NH2 связывают избыток Н+, при этом белок заряжается положительно. В щелочной среде усиливается диссоциация карбоксильных групп, образующиеся Н+ связывают избыток ОН–-ионов и pH сохраняется, белки выступают как кислоты и заряжаются отрицательно.
ГЕМОГЛОБИНОВАЯ БУФЕРНАЯ СИСТЕМА Наибольшей мощностью обладает гемоглобиновый буфер, который можно рассматривать как часть белкового. На него приходится до 30% всей буферной емкости крови. В буферной системе гемоглобина существенную роль играет гистидин, который содержится в белке в большом количестве (около 8%). Изоэлектрическая точка гистидина равна 7,6, что позволяет гемоглобину легко принимать и легко отдавать ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45). Данный буфер представлен несколькими подсистемами:
Работа гемоглобинового буфера неразрывно связана с дыхательной системой.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту ННbО2 более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 → [H-HbO2 ] → НbO2 + Н+
В капиллярах тканей постоянное поступление кислот (в том числе и угольной) из клеток приводит к диссоциации оксигемоглобина НbO2 (эффект Бора) и связыванию ионов Н+ в виде Н-Hb:
НbO2+ Н+→[H-HbO2 ] → Н-Hb + O2
МЕТАБОЛИЧЕСКИЙ АЦИДОЗ
Причины 1. Повышение содержания кислот в крови
Кетоацидоз развивается при уменьшении концентрации инсулина крови, существенном недостатке углеводов в пище при достаточном потреблении белков и жиров, при отравлении алкоголем.
2. Потеря бикарбонатов Потери бикарбонатов возможны вместе с кишечным, панкреатическим и билиарным секретами при диареях и фистулах кишечника и желчного пузыря, дренировании поджелудочной железы
3. Недостаточное выведение ионов Н+ почками В данном случае существуют органические причины – уменьшение числа функционирующих нефронов при хронической почечной недостаточности или поражение канальцев. Также причиной задержки ионов Н+ является уменьшение количества натрия в первичной моче, что ограничивает антиперенос ионов Na+ и H+, и снижение фосфатов в крови, которые связывают и выводят ионы Н+.
МЕТАБОЛИЧЕСКИЙ АЛКАЛОЗ
Причины 1. Эндогенный синтез и повышенная секреция в кровь ионов НСО3–:
-обкладочными клетками желудка при неукротимой рвоте, фистуле желудка, кишечной непроходимости,
-клетками почечного эпителия в результате повышения эффектов альдостерона, при гиповолемии, при использовании петлевых диуретиков (фуросемид, тиазиды).
2. Создание высоких концентраций ионов НСО3– при внутривенном введении щелочных растворов, при постгиперкапническом состоянии.
РЕСПИРАТОРНЫЙ АЦИДОЗ
Причины:
Причинами являются нарушение вентиляции легких:
-oповреждения или заболевания легких (пневмония, фиброз, отек легких, инородное тело),
-повреждения или заболевания дыхательных мышц (нехватка калия, боли после операции, травмы, накопление жировых отложений),
-угнетение дыхательного центра (опиаты, барбитураты), неправильный режим ИВЛ, o бронхиальная астма, эмфизема, бронхит. При недостаточной вентиляции легких рСО2 способен достичь 140-150 мм рт.ст.
РЕСПИРАТОРНЫЙ АЛКАЛОЗ
Причины 1. Возбуждение дыхательного центра.
Причин этого возбуждения может быть несколько:
-изолированный ацидоз церебральной жидкости, который является остаточным явлением после компенсированного ацидоза крови. Дело в том, СО2 легко проходит через гематоэнцефалический барьер, а ионы НСО3– – плохо. Поэтому при быстрой компенсации КОС крови ацидоз цереброспинальной жидкости сохраняется и дыхательный центр стимулируется еще некоторое время,
-субарахноидальное кровотечение, при этом происходит стимуляция дыхательного центра продуктами гемолиза,
-при циррозе печени и сепсисе происходит стимуляция дыхательного центра токсинами и циркулирующими вредными метаболитами.
2. Лихорадочные состояния.
3. Неправильный режим искусственной вентиляции легких.
ДЫХАТЕЛЬНАЯ СИСТЕМА Легочная вентиляция обеспечивает удаление угольной кислоты, образованной при функционировании бикарбонатной буферной системы. По скорости реакции на изменение рН – это вторая система после буферных систем. Дополнительная вентиляция легких приводит к удалению СО2, а значит и Н2СО3 и повышает рН крови, что компенсирует закисление межклеточной жидкости и плазмы крови продуктами метаболизма, в первую очередь, органическими кислотами.
ПОЧКИ Роль почек в регуляции сдвигов КОС заключается в изменении реабсорбции бикарбоната и секреции аммиака и титруемых кислот. Благодаря этим процессам рН мочи постепенно снижается до 4,5-5,2.
2) Неферментативные системы антирадикальной защиты и их физиологическое значение. Ферментативная система регуляции включает 3 линии защиты
Первая линия защиты
1. Супероксиддисмутаза (СОД) – фермент, представленный в цитозоле и митохондриях, выполняет функции антиоксидантного фермента, удаляя агрессивный супероксид анион-радикал и образуя при этом более устойчивый пероксид водорода.
У человека имеется три формы фермента:
цитозольная и внеклеточная формы, содержат металлы Cu и Zn,
митохондриальный изофермент, включает Mn.
![]()
2.Каталаза – антиперекисный фермент, содержит олигомерный белок с атомом Fe+2/+3. Обладает высокой активностью и работает при высокой концентрации перикиси водорода. В эритроцитах она находится в цитозоле и защищает гемоглобин от окисления.
![]()
Вторая линия защиты
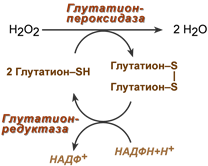
1. Глутатионпероксидаза – не обладает строгой специфичностью. Содержится во всех клетках. В активном центре Se . Способен разрушать гидроперекиси ЖК за счет Sh-групп глутатиона и образовывать дисульфидные мостики.Обладает всевдокаталазной активностью и может разрушать пероксид водорода, как каталаза. Но проявляет такую активность при более низких конц перекиси.
2.Глутатионредуктаза обеспечивает вос-ние окисленного глутатиона. Источник НАДФН+Н пентозофосфатный путь
Третья линия защиты
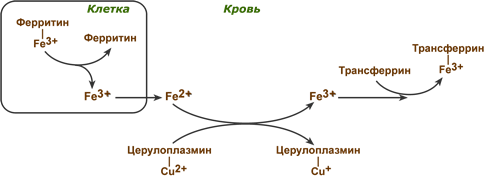
1.Церулоплазмин – белок плазмы крови и ее основной антиоксидант. Содержит Cu и окисляет Fe.
2.Трансферрин – связывает и транспортирует Fe+3 в депо.
Неферментативная система регуляции ПОЛ
Природные антиоксиданты
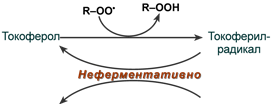
1.а-токоферол(витамин Е) – содержится в семенной жидкости и развивающихся клетках. В основе действия лежит взаимодействие с радикалами, образующимися в цепи окисления ЖК. Радикалы витамины Е выталкиваются на поверхность мембраны. 2 радикала способны к рекомбинации с образованием димеров нерадикальной природы. В мембранах он сохраняется постоянно. Восстанавливается витамином С
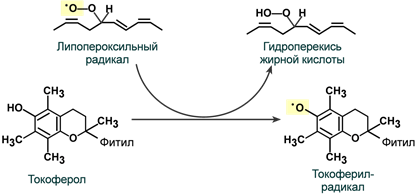
2. Витамин С- при вос-нии витамина Е отдает один из атомов Н, переходя в радикальную форму аскорбиновый кислоты, может восстановить Fe+3 в Fe+2 Две радикальные формы витамина С могут взаимодействовать друг с другом с образованием восстановленной и полностью окисленной формы аскорбиновый кислоты.
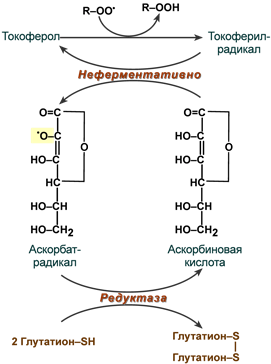
3.НS-соединения – это инактиваторы гидроперикисных радикалов жк. К ним относится к глутатион(больше всего в печени и эритроцитах) , метионин, цистеин
4.Амины – не являются истинными антиоксидантами. Например, цистамин взаимодействует с малоновым диальдегидом, а не со свободными радикалами, препятствуя реализации его повреждающего действия.
5.Многоатомные спирты(сорбит, ксилит, манит, глюкоза)- они связывают свободные радикалы АФК, ключая гидроксильный радикал, за счет своих ОН-групп.
6. Комплексообразователи - способны образовывать координационные связи с ионами Fe+2/+3. В результате образуются комплексные соли.
7. Мембрана сама является структурным антиоксидантом. Она препятствует вхождению катализатора ПОЛи контакта интактной мембраны с продуктами ПОЛ. На мембране содержатся глутатион-зависимые ферменты – глутатион –трансфераза, витамин Е, витамин С
Синтетические антиоксиданты
1. Существуют синтетические антирадикальные органические вещества, которые выступают в роли конкурента субстратов ПОЛ.
RO2+InH+RH=ROOH+In+RH
Образовавшийся радикал ингибитора малоактивен и не способен инициировать новые цепи окисления жк, тк не обладает достаточным запасом энергии для разрыва связи С-Н
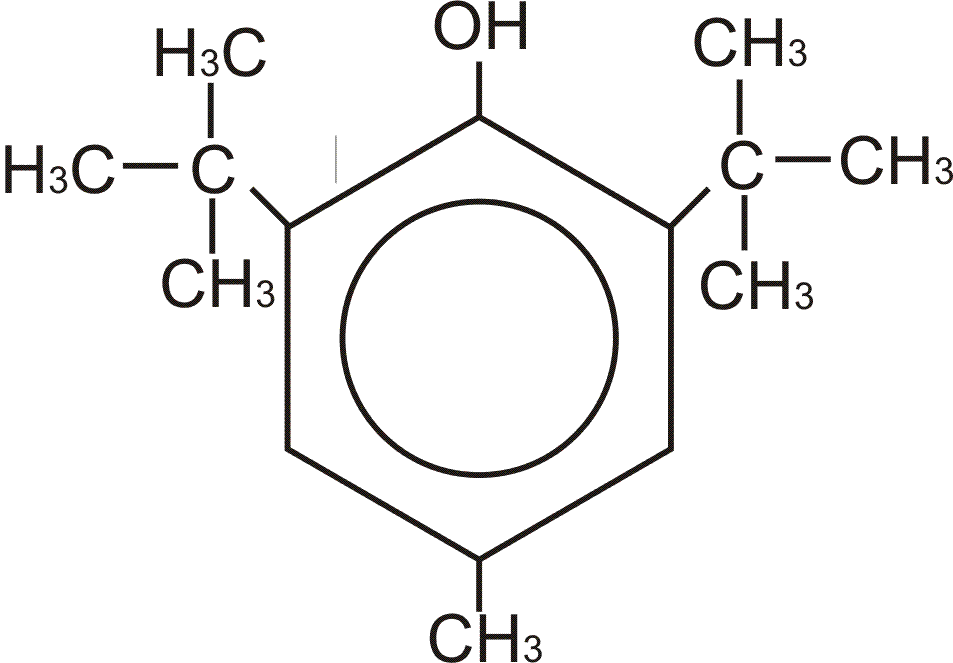
2.Ионол и дибунол. Имеют экранированный гидроксил – ОН группа, которая принимает нас ебя атаку свободных радикалов, окруженная с двух сторон гидрофобными метильными группами, защищающими мембрану. Ионол гидрофобен(не способен погружаться в мембрану, как токоферол) и используется часто при ожогах
3) Роль нейраминидазы и гемаглютининов в вирусной репликации.
билет 10 1.углеводы пищеварения В пище человекав основном содержатся полисахариды — крахмал, целлюлоза растений, в меньшем количестве - гликоген животных. Источником сахарозы служат растения, особенно сахарная свёкла, сахарный тростник. Лактоза поступает с молоком млекопитающих (в коровьем молоке до 5% лактозы, в женском молоке — до 8%). Фрукты, мёд, соки содержат небольшое количество глюкозы и фруктозы. Мальтоза есть в солоде, пиве.
Углеводы пищи являются для организма человека в основном источником моносахаридов, преимущественно глюкозы. Некоторые полисахариды: целлюлоза, пектиновые вещества, декстраны, у человека практически не перевариваются, в ЖКТ они выполняют функцию сорбента (выводят холестерин, желчные кислоты, токсины и д.р.), необходимы для стимуляции перистальтики кишечника и формирования нормальной микрофлоры.
Углеводы — обязательный компонент пищи, они составляют 75% массы пищевого рациона и дают более 50% необходимых калорий. У взрослого человека суточная потребность в углеводах 400г/сут, в целлюлозе и пектине до 10-15 г/сут. Рекомендуется употреблять в пищу больше сложных полисахаридов и меньше моносахаров.
Функции:
Резервно-энергетическая – глюкоза способна откладываться в виде крахмала(растительные клетки) или в виде гликогена (животные клетки). Большое преимущество моносахаридов (по сравнению с жирными кислотами) состоит в их способности окисляться как в аэробных, так и в анаэробных условиях (гликолиз).
Защитно-механическая – основное вещество трущихся поверхностей суставов, находятся в сосудах и слизистых оболочках (гиалуроновая кислота и другие гликозаминогликаны),
Опорно-структурная – целлюлоза в растениях, гликозаминогликаны в составе протеогликанов, например, хондроитинсульфат в соединительной ткани,
Гидроосмотическая и ионрегулирующая – гетерополисахариды обладают высокой гидрофильностью, отрицательным зарядом и, таким образом, удерживают Н2О, ионы Са2+, Mg2+, Na+ в межклеточном веществе, обеспечивают тургор кожи, упругость тканей,
Кофакторная – гепарин является кофактором липопротеинлипазы плазмы крови (участие в обмене липопротеинов) и фермента антикоагулянтной системы крови – антитромбина III.
Переваривание углеводов в желудочно-кишечном тракте
Ротовая полость:
Со слюной сюда поступает кальций-содержащий фермент α-амилаза. Оптимум ее рН 7,1-7,2, активируется ионами Cl–. Являясь эндоамилазой, она беспорядочно расщепляет внутренние α1,4-гликозидные связи и не влияет на другие типы связей.
В ротовой полости крахмал и гликоген способны расщепляться α-амилазой до декстринов и мальтозы. Дисахариды ничем не гидролизуются.
Желудок:
Из-за низкой рН амилаза инактивируется, хотя некоторое время расщепление углеводов продолжается внутри пищевого комка.
Кишечник:
В полости тонкого кишечника работают совместно панкреатическая α-амилаза, разрывающая внутренние α1,4-связи, изомальтаза, разрывающая α1,6-связи изомальтозы, олиго-α1,6-глюкозидаза, действующая на точки ветвления крахмала и гликогена.
Кроме полостного, имеется еще и пристеночное пищеварение, которое осуществляют:
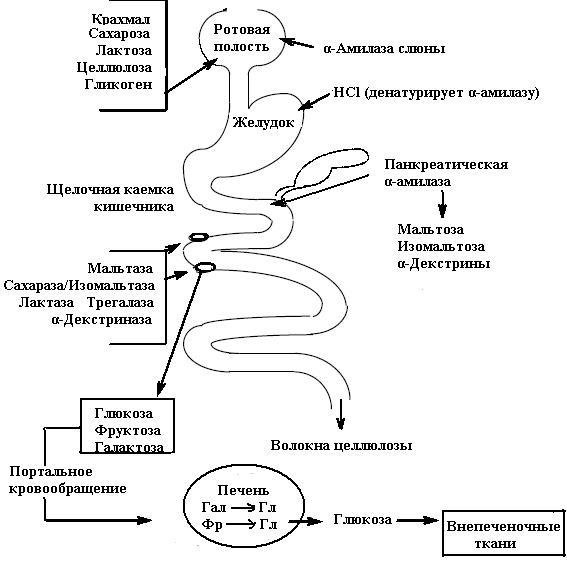 сахаразо-изомальтазный комплекс
(рабочее название сахараза)
– в тощей кишке гидролизует α1,2-, α1,4-,
α1,6-гликозидные связи, расщепляет
сахарозу, мальтозу, мальтотриозу,
изомальтозу,
сахаразо-изомальтазный комплекс
(рабочее название сахараза)
– в тощей кишке гидролизует α1,2-, α1,4-,
α1,6-гликозидные связи, расщепляет
сахарозу, мальтозу, мальтотриозу,
изомальтозу,гликоамилазный комплекс – находится в нижних отделах тонкого кишечника, расщепляет α1,4-гликозидные связи и отщепляет концевые остатки глюкозы в олигосахаридах с восстанавливающего конца,
β-гликозидазный комплекс (рабочее название лактаза) – гидролизует β1,4-гликозидные связи между галактозой и глюкозой (лактозу). У детей активность лактазы очень высока уже до рождения и сохраняется на высоком уровне до 5-7 лет, после чего снижается.
Роль целлюлозы в пищеварении
Целлюлоза ферментами человека не переваривается, т.к. не образуются соответствующие ферменты. Но в толстом кишечнике под действием ферментов микрофлоры некоторая часть ее может гидролизоваться с образованием целлобиозы и глюкозы. Глюкоза частично используется самой микрофлорой и окисляется до органических кислот (масляной, молочной), которые стимулируют перистальтику кишечника. Малая часть глюкозы может всасываться в кровь.
Основная роль целлюлозы для человека:
стимулирование перистальтики кишечника,
формирование каловых масс,
стимуляция желчеотделения,
абсорбция холестерола и других веществ, что препятствует их всасыванию.
Непереносимость лактозы (молока):
Приобретенная недостаточность:
Приобретенные формы недостаточности переваривания углеводов возникают в результате заболеваний стенок ЖКТ: энтериты, колиты, когда нарушается образование ферментов и их размещение на щеточной каемке энтероцитов. К тому же ухудшается всасывание моносахаров.
Наследственная недостаточность:
При наследственной (первичной) патологии лактазы симптомы проявляются после первых кормлений. Ее недостаточность может проявляться не только у младенцев, но зачастую развивается у подростков и взрослых в результате естественного снижения синтеза фермента в онтогенезе.
Патогенез:
Отсутствие гидролиза соответствующих дисахаридов приводит к осмотическому эффекту и задержке воды в просвете кишечника. Кроме этого, сахара активно потребляются микрофлорой толстого кишечника и метаболизируют с образованием коротких органических кислот (масляная, молочная) и газов.
В результате указанных процессов симптомами лактазной или сахаразнойнедостаточности являются дисбактериоз, диарея, срыгивания, метеоризм, вспучивание живота, его спазмы и боли. Из-за частого раздражения продуктами брожения целостность эпителия кишечника нарушается и появляется высокая верятность развития атопического дерматита.
Диагностика:
Диагноз ферментативной недостаточности ставится на основании анамнеза, симптомов заболевания и анализа кала.
Дифференциальная диагностика нарушений переваривания и всасывания заключается в контроле уровня глюкозы крови после раздельного приема дисахаридов (тест абсорбции дисахаридов) и эквивалентного количества моносахаридов. Незначительный подъем концентрации глюкозы крови в первом случае указывает на нехватку ферментов, во втором – на нарушение всасывания.
Основы лечения:
Использование препаратов, содержащих соответствующие ферменты, снижение в рационе содержания молока (при лактазной недостаточности), у младенцев использование безлактозных молочных смесей, при нарушении сахаразы - удаление из рациона продуктов с добавлением сахара.
2.Как печень влияет на пигмент чето там. Желтуха ,ее виды и признаки Пигментный обмен Участие печени в пигментном обмене заключается в превращении гидрофобного билирубина в гидрофильную форму и секреция его в желчь. Пигментный обмен, в свою очередь, играет важную роль в обмене железа в организме – в гепатоцитах находится железосодержащий белок ферритин

ГЕМОЛИТИЧЕСКАЯ ЖЕЛТУХА Гемолитическая или надпеченочная желтуха – ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза. К данному типу желтух относятся гемолитические анемии различного происхождения: врожденный сфероцитоз, серповидноклеточная анемия, дефицит глюкозо-6-фосфатдегидрогеназы, отравление сульфаниламидами, талассемии, сепсис, лучевая болезнь, несовместимость крови. В данном случае гипербилирубинемия развивается за счет фракции непрямого билирубина.
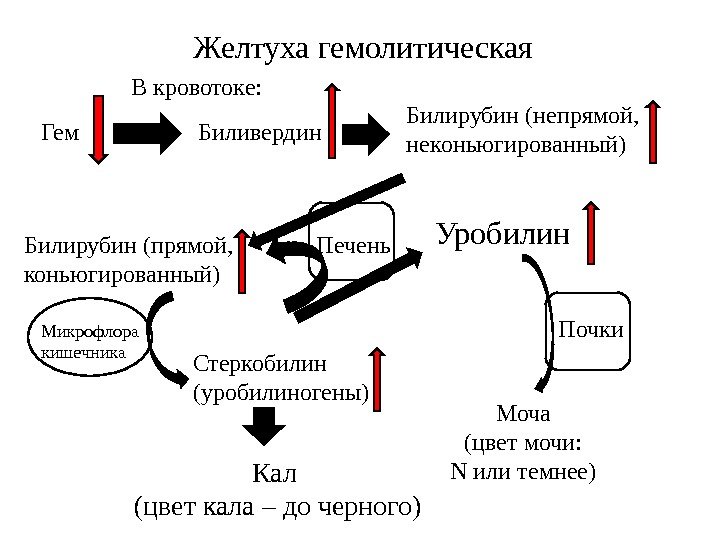 Гепатоциты
усиленно переводят непрямой билирубин
в связанную форму, секретируют его в
желчь, в результате в кале увеличивается
содержание стеркобилина, интенсивно
его окрашивая. В моче возрастает
содержание уробилина, билирубин
отсутствует. У новорожденных гемолитическая
желтуха может развиться как симптом
гемолитической болезни новорожденного.
Гепатоциты
усиленно переводят непрямой билирубин
в связанную форму, секретируют его в
желчь, в результате в кале увеличивается
содержание стеркобилина, интенсивно
его окрашивая. В моче возрастает
содержание уробилина, билирубин
отсутствует. У новорожденных гемолитическая
желтуха может развиться как симптом
гемолитической болезни новорожденного.
М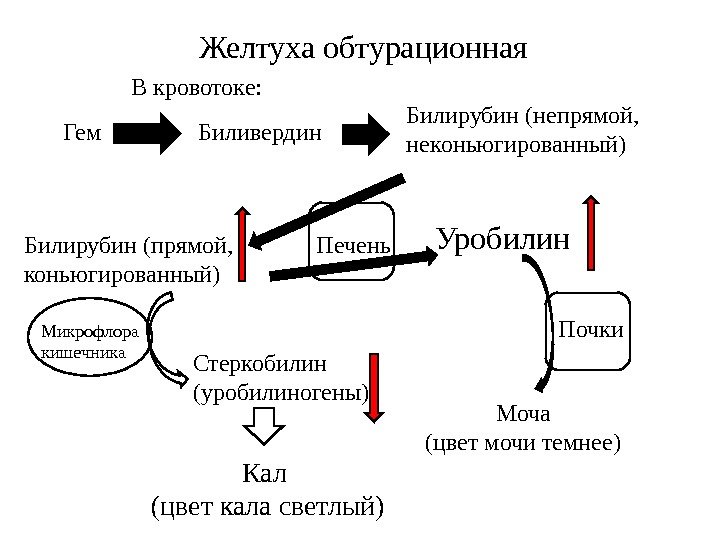 ЕХАНИЧЕСКАЯ
ЖЕЛТУХА Механическая
или подпеченочная желтуха развивается
вследствие снижения оттока желчи при
непроходимости желчного протока –
желчные камни, новообразования
поджелудочной железы, гельминтозы. В
результате застоя желчи происходит
растяжение желчных капилляров,
увеличивается проницаемость их стенок.
Не имеющий оттока в кишечник прямой
билирубин поступает в кровь, в результате
развивается гипербилирубинемия. В
тяжелых случаях, вследствие переполнения
гепатоцитов прямым билирубином, реакция
конъюгации с глюкуроновой кислотой
может нарушаться. В результате в крови
увеличивается концентрация непрямого
билирубина. В моче резко увеличен
уровень билирубина (цвет темного пива)
и снижено количество уробилина,
практически отсутствует стеркобилин
кала (серовато-белое окрашивание).
ЕХАНИЧЕСКАЯ
ЖЕЛТУХА Механическая
или подпеченочная желтуха развивается
вследствие снижения оттока желчи при
непроходимости желчного протока –
желчные камни, новообразования
поджелудочной железы, гельминтозы. В
результате застоя желчи происходит
растяжение желчных капилляров,
увеличивается проницаемость их стенок.
Не имеющий оттока в кишечник прямой
билирубин поступает в кровь, в результате
развивается гипербилирубинемия. В
тяжелых случаях, вследствие переполнения
гепатоцитов прямым билирубином, реакция
конъюгации с глюкуроновой кислотой
может нарушаться. В результате в крови
увеличивается концентрация непрямого
билирубина. В моче резко увеличен
уровень билирубина (цвет темного пива)
и снижено количество уробилина,
практически отсутствует стеркобилин
кала (серовато-белое окрашивание).
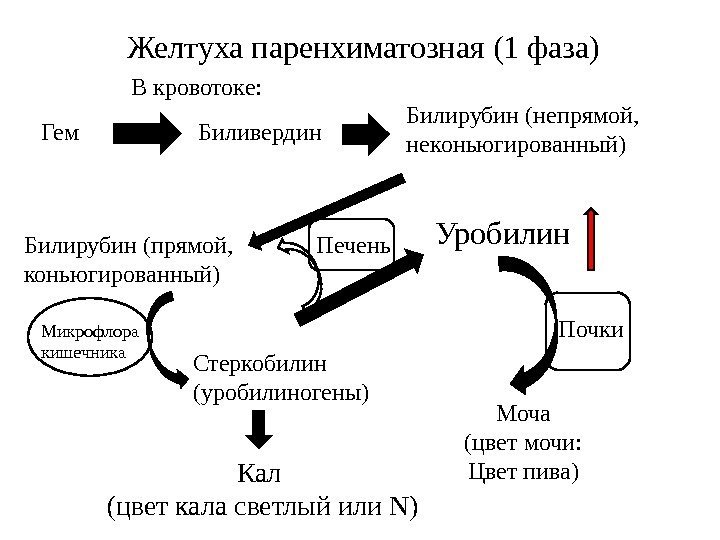
ПАРЕНХИМАТОЗНАЯ ЖЕЛТУХА Паренхиматозная (печеночно-клеточная) желтуха – причиной может быть нарушение на всех трех стадиях превращения билирубина в печени: извлечение билирубина из крови печеночными клетками, его конъюгирование и секреция в желчь. Наблюдается при вирусных и других формах гепатитов, циррозе и опухолях печени, жировой дистрофии печени, при отравлении токсическими гепатотропными веществами, при врожденных патологиях. Так как нарушаются все процессы превращения билирубина в печени, гипербилирубинемия развивается за счет обеих фракций, преимущественно прямого билирубина. Концентрация его возрастает из-за нарушения секреции в желчь и увеличения проницаемости мембран клеток печени. Количество непрямого билирубина возрастает за счет функциональной недостаточности гепатоцитов и/или снижения их количества. В моче определяется билирубин (цвет крепкого черного чая), умеренно увеличена концентрация уробилина, уровень стеркобилина кала в норме или снижен. У детей вариантами паренхиматозной желтухи являются физиологическая желтуха новорожденных и недоношенных, желтуха, вызываемая молоком матери.
,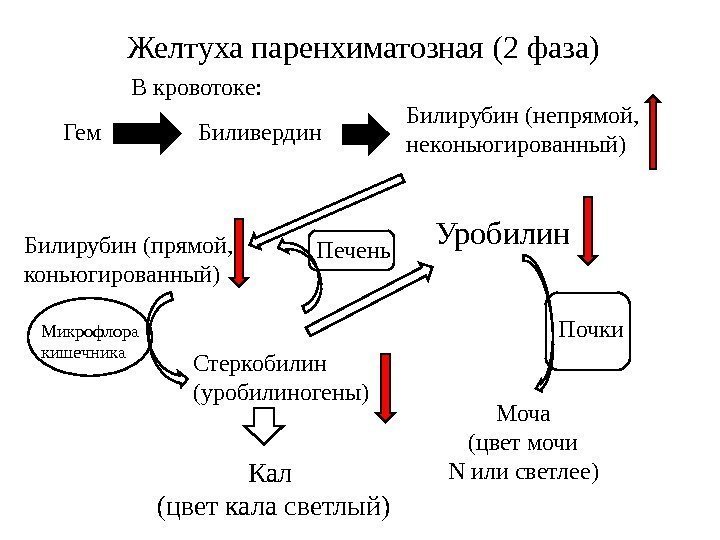
Фзиологическая (транзиторная) желтуха новорожденных
Причины :
относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,
- абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни,
- дефицит лигандина,
-слабая активность желчевыводящих путей. Клиническая диагностика o окрашивание кожи на 3-4 день после рождения, o
-гемолиза и анемии нет. Исчезает спустя 1-2 недели после рождения.
Лабораторная диагностика Увеличение концентрации свободного билирубина в сыворотке до 140-240 мкмоль/л.
Основы лечения
-фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
-аскорбиновая кислота, глюкоза,
- желчегонные средства.

задача: аспирин широко используется как жаропонижающее и противовоспалительное .Какой механизм позволяет чето там чтоб оно имело такие свойства
