Вопрос
№3. Химические свойства аминокислот
Особенности
физических и химических свойств
аминокислот обусловлены их строением
— присутствием одновременно двух
противоположных по свойствам функциональных
групп: кислотной и основной.
Именно
амфотерность аминокислот обуславливает
их наиболее характерные свойства.
1.
Кислотные свойства аминокислот
проявляются по
карбоксильной группе в
их способности взаимодействовать,
например, с щелочами:
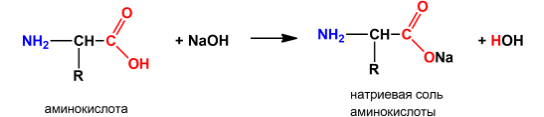 или
вступать в реакцию этерификации со
спиртами с образованием сложных
эфиров:
или
вступать в реакцию этерификации со
спиртами с образованием сложных
эфиров:
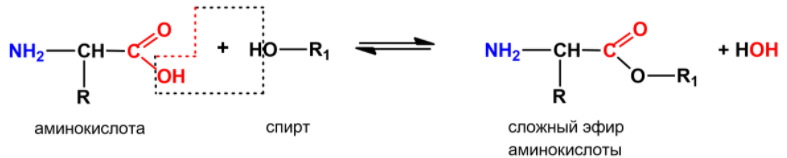 2.
Основные свойства аминокислот
проявляются по
аминогруппе в
их способности взаимодействовать с
кислотами, образуя комплексные ионы по
донорно-акцепторному механизму:
2.
Основные свойства аминокислот
проявляются по
аминогруппе в
их способности взаимодействовать с
кислотами, образуя комплексные ионы по
донорно-акцепторному механизму:
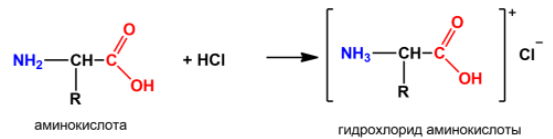 3.
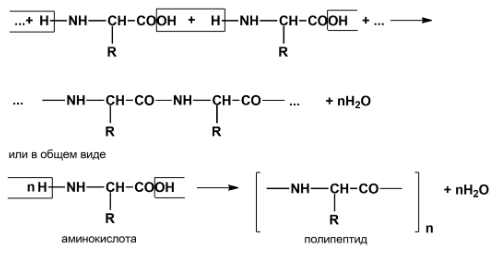
Амфотерность аминокислот проявляется
также в их способности образовывать в
растворе в результате диссоциации
биполярный ион — внутреннюю соль,
а самое главное, за счет амфотерности
аминокислоты могут вступать друг с
другом в реакции поликонденсации.
образуя полипептиды
и белки:
3.
Амфотерность аминокислот проявляется
также в их способности образовывать в
растворе в результате диссоциации
биполярный ион — внутреннюю соль,
а самое главное, за счет амфотерности
аминокислоты могут вступать друг с
другом в реакции поликонденсации.
образуя полипептиды
и белки:
 Вопрос
№4. Строение, структуру и свойства
пептидов и белков. Закономерности
формирования
различных структур белка;
Пептиды и белки -
представляют собой соединения, построенные
из остатков α-аминокислот,
соединенных пептидной (амидной) связью
-С(О)-NH-
Мономерными звеньями как
пептидов так и белков являются α-аминокислоты.
Четкой границы между пептидами и белками
не существует. Обычно, к пептидам относят
молекулы, содержащие до 100 аминокислотных
остатков (соответствует молекулярной
массе от 10 тыс.), а к белкам - более 100
(соответствует молекулярной массе от
10 тыс. до нескольких миллионов).
КЛАССИФИКАЦИЯ
ПЕПТИДОВ
Вопрос
№4. Строение, структуру и свойства
пептидов и белков. Закономерности
формирования
различных структур белка;
Пептиды и белки -
представляют собой соединения, построенные
из остатков α-аминокислот,
соединенных пептидной (амидной) связью
-С(О)-NH-
Мономерными звеньями как
пептидов так и белков являются α-аминокислоты.
Четкой границы между пептидами и белками
не существует. Обычно, к пептидам относят
молекулы, содержащие до 100 аминокислотных
остатков (соответствует молекулярной
массе от 10 тыс.), а к белкам - более 100
(соответствует молекулярной массе от
10 тыс. до нескольких миллионов).
КЛАССИФИКАЦИЯ
ПЕПТИДОВ
Деление на олигопептиды и полипептиды достаточно условно. В целом, пептиды можно классифицировать по следующим признакам:
1. По числу аминокислотных остатков, входящих в их молекулы:
олигопептиды (содержат до 10 аминокислотных остатков), среди них можно выделить дипептиды, трипептиды , тетрапептиды и т.д.
полипептиды (содержат более 10 остатков аминокислот)
2. По составу:
гомомерные пептиды при гидролизе образуют только аминокислоты
гетеромерные пептиды при гидролизе могут содержать также и неаминокислотный компонент, в зависимости от которого они называются: глико-, липо-, нуклео-, фосфопептиды и др.
3. По способу образовывать связи:
гомодетные пептиды, в которых аминокислотные остатки соединены между собой только пептидными связями
гетеродетные пептиды соединены не только пептидными, но и сложноэфирными, дисульфидными и другими связями
Гетеродетные пептиды со встроенными в цепь гидроксиаминокислотами называются пептолидами. Пептидная связь образуется между двумя молекулами аминокислот за счет отщепления молекулы воды:
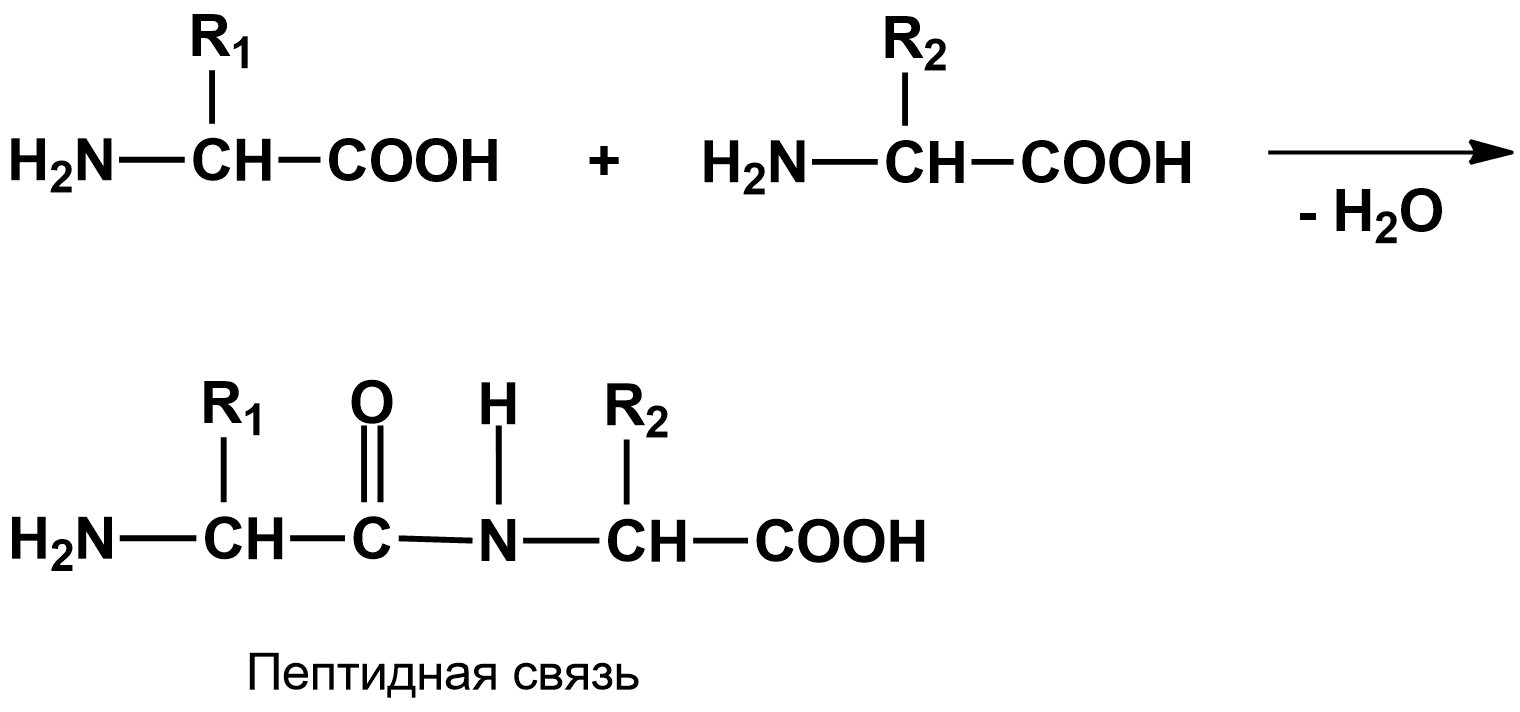
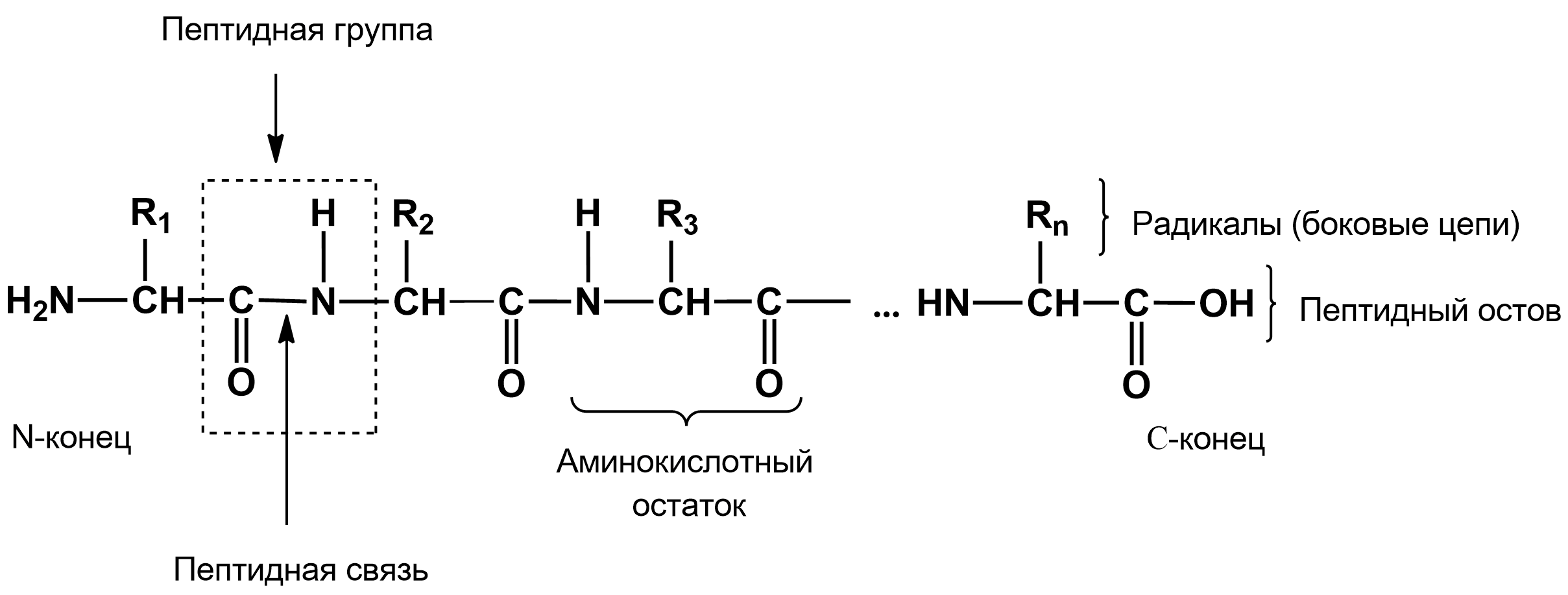
Цепочка повторяющихся атомов называется пептидным остовом. Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—C(О)—), называемое аминокислотным остатком.
 Классификация
белков может проводиться по нескольким
признакам:
Классификация
белков может проводиться по нескольким
признакам:
по аминокислотному составу
по строению
по форме молекулы
по растворимости
СТРУКТУРА БЕЛКА
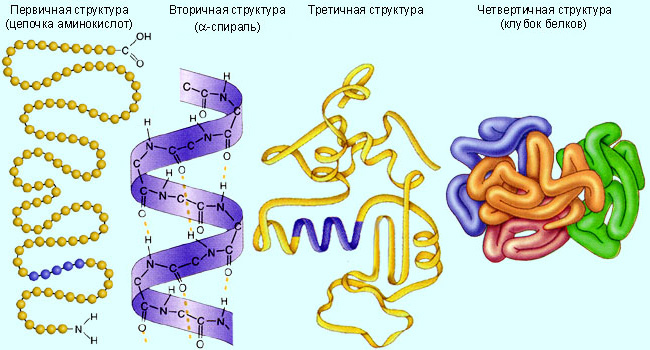
Согласно полипептидной теории А.Я.Данилевского (1888 г.), каждому белку свойственна особая геометрическая структура. При описании пространственной структуры обычно описывают четыре разных уровня организации белковой молекулы.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
Первичная структура белка – последовательность чередования аминокислотных остатков (все связи ковалентные, прочные). Первичная структура инсулина была открыта Ф. Сэнгером в 1944–54 годах. В настоящее время известна первичная структура нескольких сотен белков. Последовательность аминокислот определяет биологическую функцию белка, и замена одной единственной аминокислоты может резко изменить эту функцию.
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
Вторичная структура – форма полипептидной цепи в пространстве. Белковая цепь закручена в спираль (за счет множества водородных связей). Водородные связи, возникающие между CO- и NH-группами стабилизируют вторичную структуру. На один виток спирали приходится 3,6 аминокислотного остатка. Существуют и другие формы вторичной структуры, например, тройная спираль коллагена.
ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА
Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи). Дисульфидные, ионные и водородные связи, а также гидрофобное взаимодействие заставляют большинство белковых цепей сворачиваться в компактную глобулу.
ЧЕТВЕТРИЧНАЯ СТРУКТУРА БЕЛКА
Четвертичная
структура – соединенные друг с другом
макромолекулы белков образуют комплекс
из нескольких полипептидных цепей.
Такой способ их упаковки называется
четвертичной структурой.
 Существуют
пять типов взаимодействий, сочетание
которых обеспечивает формирование и
поддержание пространственной структуры
белка:
1) водородные связи между
R-группами аминокислотных остатков;
2)
электростатическое притяжение между
противоположно заряженными R-группами;
3) гидрофобные взаимодействия
(гидрофобные R-группы некоторых
аминокислотных остатков избегают
контактов с водным окружением и стремятся
собраться вместе внутри белковой
структуры, где они защищены от
соприкосновения с водой);
4)
Вандерваальсовы взаимодействия (из-за
флуктуаций электрического поля любые
два атома на очень близких расстояниях
слабо притягиваются;
5) ковалентные
поперечные связи (некоторые белки
содержат остатки цистеина, которые
способны образовывать дисульфидную
ковалентную связь, легко разрывающуюся
при обработке различными
веществами-восстановителями).
Подавляющая
часть того, что известно о трехмерных
белковых структурах, относится к
водорастворимым глобулярным белкам.
Для мембранных же и фибриллярных белков
расшифрованы лишь считанные пространственные
структуры или отдельные фрагменты.
Причина проста: водорастворимые белки
легче выделять в виде отдельных молекул
и их структуру легче изучать и рентгеном
— в кристаллах, и спектроскопией ЯМР
(ядерного магнитного резонанса) — в
растворах. Поэтому, говоря о "структуре
белка", "формировании структуры
белка" и т.д. — часто, на самом деле,
имеют в виду закономерности, доказанные
лишь для водорастворимых глобулярных
белков.
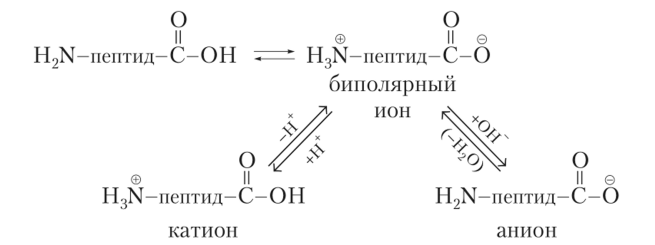
Наличие кислотных
и основных центров в составе аминокислотных
остатков пептидов определяет существование
в водных растворах пептидов в зависимости
от pH среды биполярных ионов, анионов и
катионов.
Существуют
пять типов взаимодействий, сочетание
которых обеспечивает формирование и
поддержание пространственной структуры
белка:
1) водородные связи между
R-группами аминокислотных остатков;
2)
электростатическое притяжение между
противоположно заряженными R-группами;
3) гидрофобные взаимодействия
(гидрофобные R-группы некоторых
аминокислотных остатков избегают
контактов с водным окружением и стремятся
собраться вместе внутри белковой
структуры, где они защищены от
соприкосновения с водой);
4)
Вандерваальсовы взаимодействия (из-за
флуктуаций электрического поля любые
два атома на очень близких расстояниях
слабо притягиваются;
5) ковалентные
поперечные связи (некоторые белки
содержат остатки цистеина, которые
способны образовывать дисульфидную
ковалентную связь, легко разрывающуюся
при обработке различными
веществами-восстановителями).
Подавляющая
часть того, что известно о трехмерных
белковых структурах, относится к
водорастворимым глобулярным белкам.
Для мембранных же и фибриллярных белков
расшифрованы лишь считанные пространственные
структуры или отдельные фрагменты.
Причина проста: водорастворимые белки
легче выделять в виде отдельных молекул
и их структуру легче изучать и рентгеном
— в кристаллах, и спектроскопией ЯМР
(ядерного магнитного резонанса) — в
растворах. Поэтому, говоря о "структуре
белка", "формировании структуры
белка" и т.д. — часто, на самом деле,
имеют в виду закономерности, доказанные
лишь для водорастворимых глобулярных
белков.
Наличие кислотных
и основных центров в составе аминокислотных
остатков пептидов определяет существование
в водных растворах пептидов в зависимости
от pH среды биполярных ионов, анионов и
катионов.
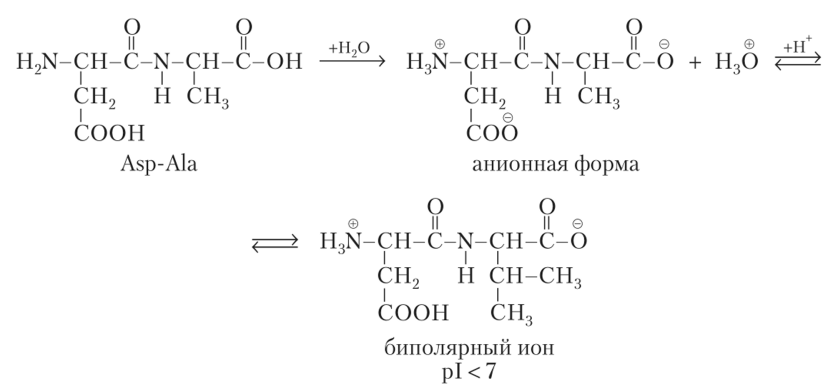
 Кислые
пептиды и белки содержат главным образом
остатки кислых аминокислот, имеющих в
радикале кислотные центры — карбоксильные
группы. В растворах таких пептидов pH <
7, их изоэлсктрическая точка находится
в кислой среде.
Кислые
пептиды и белки содержат главным образом
остатки кислых аминокислот, имеющих в
радикале кислотные центры — карбоксильные
группы. В растворах таких пептидов pH <
7, их изоэлсктрическая точка находится
в кислой среде.
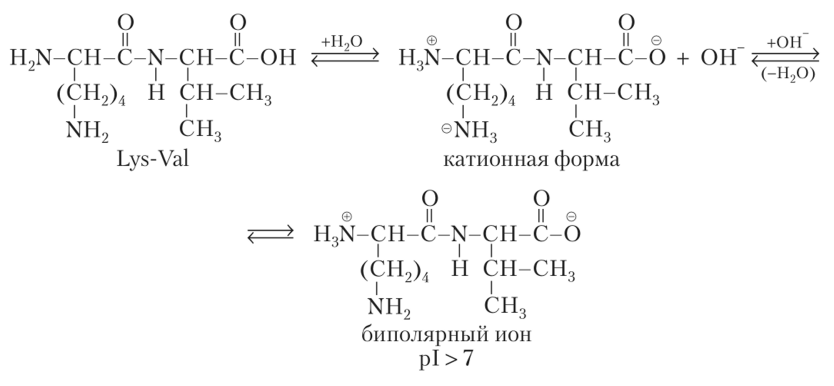
 Основные
пептиды и белки характеризуются
преобладанием в структуре остатков
основных аминокислот, имеющих в боковом
радикале дополнительные основные центры
(аминогруппы или пиридиновые атомы
азота). В водных растворах такие пептиды
существуют в виде катионов, в их растворах
pH > 7; изо- электрическая точка находится
в основной среде.
Основные
пептиды и белки характеризуются
преобладанием в структуре остатков
основных аминокислот, имеющих в боковом
радикале дополнительные основные центры
(аминогруппы или пиридиновые атомы
азота). В водных растворах такие пептиды
существуют в виде катионов, в их растворах
pH > 7; изо- электрическая точка находится
в основной среде.
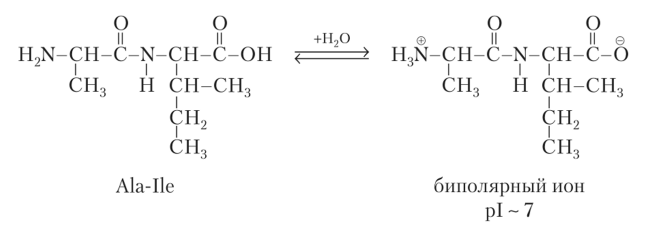
 Нейтральные
пептиды и белки содержат примерно
одинаковое количество групп кислотного
и основного характера. Реакция среды в
их растворах близка к нейтральной,
изоэлектрическая точка находится в
среде, близкой к нейтральной.
Нейтральные
пептиды и белки содержат примерно
одинаковое количество групп кислотного
и основного характера. Реакция среды в
их растворах близка к нейтральной,
изоэлектрическая точка находится в
среде, близкой к нейтральной.
 К
нейтральным белкам относится белок
крови — гемоглобин.
Вопрос№5.
Качественные реакции на аминокислоты
и пептиды.
Качественные
цветные реакции можно подразделить на
два типа: универсальные и специфические.
К универсальным реакциям относятся те,
которые дают окрашивание в присутствии
любых белков.
Специфические
реакции доказывают наличие какой-то
определенной аминокислоты. Все
качественные реакции можно наблюдать
на примере раствора яичного белка,
представляющего собой многокомпонентную
смесь аминокислот
УНИВЕРСАЛЬНЫЕ
ЦВЕТНЫЕ РЕАКЦИИ
К
нейтральным белкам относится белок
крови — гемоглобин.
Вопрос№5.
Качественные реакции на аминокислоты
и пептиды.
Качественные
цветные реакции можно подразделить на
два типа: универсальные и специфические.
К универсальным реакциям относятся те,
которые дают окрашивание в присутствии
любых белков.
Специфические
реакции доказывают наличие какой-то
определенной аминокислоты. Все
качественные реакции можно наблюдать
на примере раствора яичного белка,
представляющего собой многокомпонентную
смесь аминокислот
УНИВЕРСАЛЬНЫЕ
ЦВЕТНЫЕ РЕАКЦИИ
1. Биуретовая реакция - универсальная реакция на все белки и пептиды, так как является реакцией на пептидную связь. Представляет собой взаимодействие щелочного раствора биурета ((H2NC(O))2NH с раствором сульфата меди в присутствии гидроксида натрия (реактив Фелинга). В реакцию, подобную биуретовой, вступают многие вещества, содержащие в молекуле не менее двух амидных группировок, амиды и имиды аминокислот и некоторые другие соединения. Продукты реакции в этом случае имеют фиолетовую или синюю окраску.

В условиях биуретовой реакции белки дают фиолетовую окраску, что используется для их качественного и количественного анализа. Биуретовая реакция обусловлена присутствием в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные солеобразные комплексы меди.
2.
Нингидриновая реакция - цветная
реакция на α-аминокислоты, которую
осуществляют нагреванием последних
в избытке щелочного
раствора нингидрина (гидрата
1,2,3-индантриона).
 Образующееся
в результате реакции соединение
(дикетогидринимин - на рисунке самый
левый продукт реакции) имеет фиолетово-синюю
окраску. Данную используют для
колориметрического количественного
определения α-аминокислот,
в том числе в автоматических аминокислотных
анализаторах.
Образующееся
в результате реакции соединение
(дикетогидринимин - на рисунке самый
левый продукт реакции) имеет фиолетово-синюю
окраску. Данную используют для
колориметрического количественного
определения α-аминокислот,
в том числе в автоматических аминокислотных
анализаторах.
 СПЕЦИФИЧЕСКИЕ
ЦВЕТНЫЕ РЕАКЦИИ
СПЕЦИФИЧЕСКИЕ
ЦВЕТНЫЕ РЕАКЦИИ
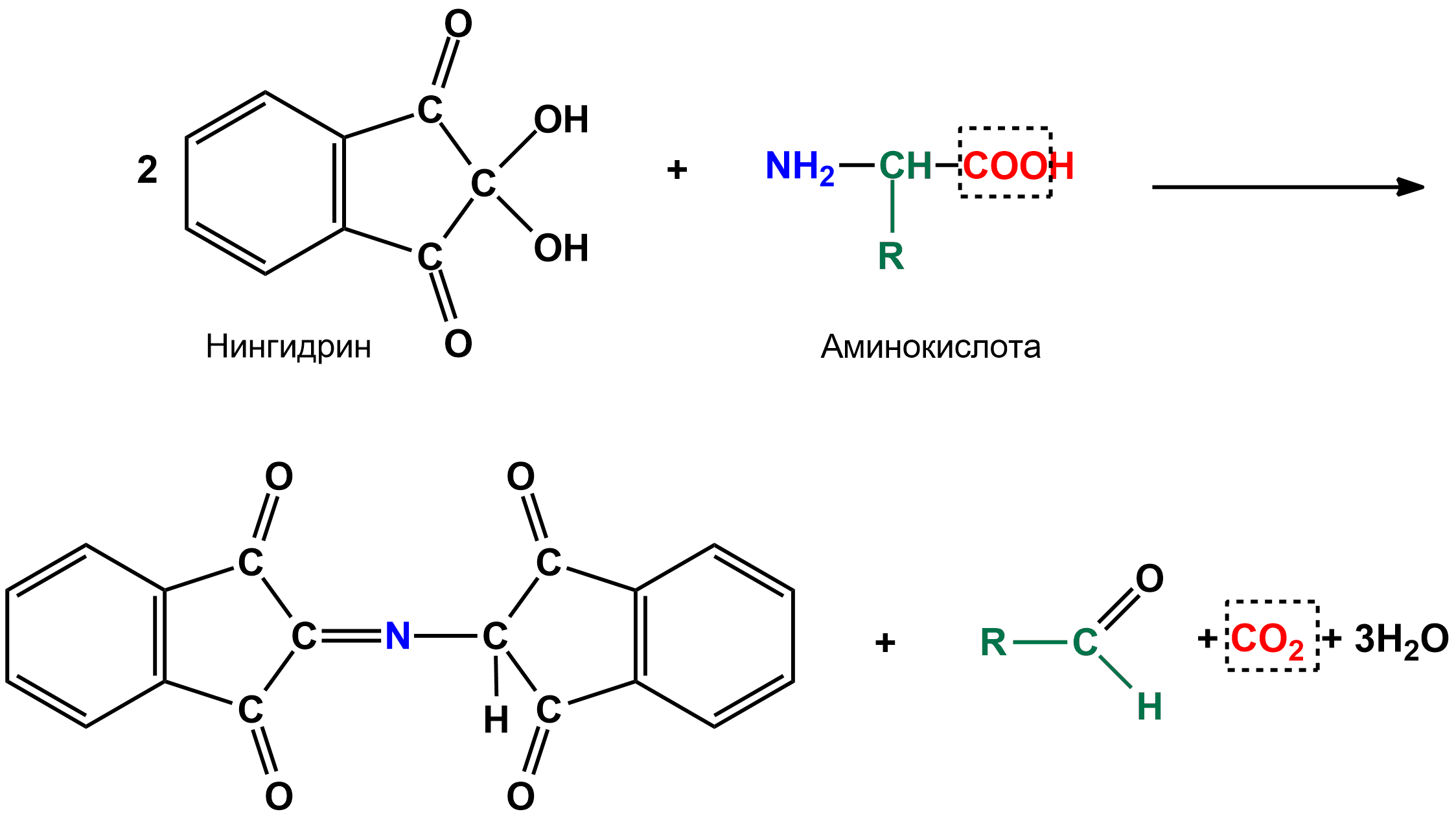
1. Реакция Щульца-Распайли
(аналогично проводится реакция Адамкевича,
только с добавлением глиоксиловой
кислоты) - является специфической
реакцией на аминокислоту триптофан -
взаимодействие раствора яичного белка
с 10% раствором сахарозы и равным объемом
концентрированной . На границе двух
жидкостей образуется красно-фиолетовое
кольцо (при нагревании на водяной бане
реакция идет быстрее - главное не
смешивать жидкости).
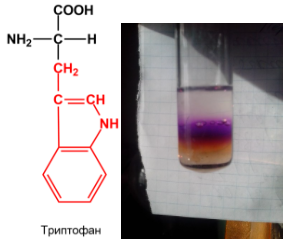 2. Реакция
Милона -
используется для обнаружения тирозина,
в составе которого имеется фенольный
гидроксил.
При добавлении к раствору белка реактива
Милона (раствор HgNO3 и Hg(NO3)2 в
разбавленной азотной кислоты HNO3,
содержащей примесь азотистой кислоты HNO2)
образуется осадок, сначала окрашенный
в розовый, а затем в пурпурно-красный
цвет. Нагревание до 50∘C ускоряет
эту реакцию.
2. Реакция
Милона -
используется для обнаружения тирозина,
в составе которого имеется фенольный
гидроксил.
При добавлении к раствору белка реактива
Милона (раствор HgNO3 и Hg(NO3)2 в
разбавленной азотной кислоты HNO3,
содержащей примесь азотистой кислоты HNO2)
образуется осадок, сначала окрашенный
в розовый, а затем в пурпурно-красный
цвет. Нагревание до 50∘C ускоряет
эту реакцию.
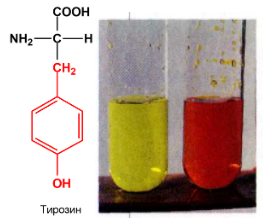 3.
Ксантопротеиновая реакция - является
специфической реакцией и используется
для обнаружения α-аминокислот,
содержащих в радикале ароматический
цикл, например фенилаланина. Для
ее осуществления к раствору белка
прибавляют концентрированную азотную
кислоту HNO3 до
тех пор, пока не прекратится образование
осадка, который при нагревании окрашивается
в желтый цвет. Окраска возникает в
результате нитрования ароматических
колец аминокислотных остатков белка
(тирозина и триптофана). При добавлении
к охлажденной жидкости избытка щелочи
появляется оранжевое окрашивание,
обусловленное образованием солей
нитроновых кислот.
3.
Ксантопротеиновая реакция - является
специфической реакцией и используется
для обнаружения α-аминокислот,
содержащих в радикале ароматический
цикл, например фенилаланина. Для
ее осуществления к раствору белка
прибавляют концентрированную азотную
кислоту HNO3 до
тех пор, пока не прекратится образование
осадка, который при нагревании окрашивается
в желтый цвет. Окраска возникает в
результате нитрования ароматических
колец аминокислотных остатков белка
(тирозина и триптофана). При добавлении
к охлажденной жидкости избытка щелочи
появляется оранжевое окрашивание,
обусловленное образованием солей
нитроновых кислот.
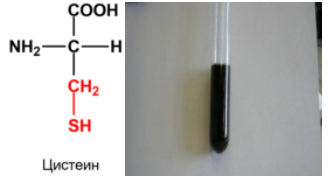
 4. Реакция
Фоля на серосодержащие аминокислоты
(цистеин, метионин) -
взаимодействие раствора яичного белка
с 30% раствором NaOH и 5% раствором
уксуснокислого свинца - Pb(CH3COO)2. При
длительном нагревании жидкость буреет,
выпадает черный осадок сульфида свинца.
4. Реакция
Фоля на серосодержащие аминокислоты
(цистеин, метионин) -
взаимодействие раствора яичного белка
с 30% раствором NaOH и 5% раствором
уксуснокислого свинца - Pb(CH3COO)2. При
длительном нагревании жидкость буреет,
выпадает черный осадок сульфида свинца.